X
Код презентации скопируйте его
Скорость химической реакции
Скачать эту презентациюПрезентация на тему Скорость химической реакции
Скачать эту презентациюCлайд 2
 Девиз урока : «Химик без знания физики подобен человеку ,который всё должен искать щупом …» (М.В. Ломоносов)
Девиз урока : «Химик без знания физики подобен человеку ,который всё должен искать щупом …» (М.В. Ломоносов)
Cлайд 3
 Вводимые опорные химические понятия: энергия активации правило Вант – Гоффа химическая кинетика Учение о скорости и механизмах химических реакций называется химической кинетикой.
Вводимые опорные химические понятия: энергия активации правило Вант – Гоффа химическая кинетика Учение о скорости и механизмах химических реакций называется химической кинетикой.
Cлайд 4
 1). Поместите в одну пробирку железный гвоздь, а в другую - железные опилки(взятые на кончике шпателя).Прилейте к ним по 1 мл. раствора HCl (10%) 2). Во вторую пробирку поместите по грануле Zn. В одну прилейте 1 мл. разбавленной HCl(1:10) в другую концентрированной HCl. Лабораторный опыт Сделайте вывод о том, что влияет на скорость химической реакции.
1). Поместите в одну пробирку железный гвоздь, а в другую - железные опилки(взятые на кончике шпателя).Прилейте к ним по 1 мл. раствора HCl (10%) 2). Во вторую пробирку поместите по грануле Zn. В одну прилейте 1 мл. разбавленной HCl(1:10) в другую концентрированной HCl. Лабораторный опыт Сделайте вывод о том, что влияет на скорость химической реакции.
Cлайд 5
 Определяет скорость химической реакции: 1) Природа реагирующих веществ 2) Условия при которых протекает реакция концентрация реагирующих веществ, температура, давление(для газов), облучение, 3) Присутствие катализаторов
Определяет скорость химической реакции: 1) Природа реагирующих веществ 2) Условия при которых протекает реакция концентрация реагирующих веществ, температура, давление(для газов), облучение, 3) Присутствие катализаторов
Cлайд 6
 Самостоятельная работа с учебником: Прочитайте в §24.7 на странице 47(с 8 абзаца)- 48 и объясните: Что такое энергия активации? - От чего зависит энергия активации? - В чём выражается эта зависимость? Как температура влияет на скорость химической реакции? Выпишите формулировку правила Вант- Гоффа и её математическое выражение.
Самостоятельная работа с учебником: Прочитайте в §24.7 на странице 47(с 8 абзаца)- 48 и объясните: Что такое энергия активации? - От чего зависит энергия активации? - В чём выражается эта зависимость? Как температура влияет на скорость химической реакции? Выпишите формулировку правила Вант- Гоффа и её математическое выражение.
Cлайд 8
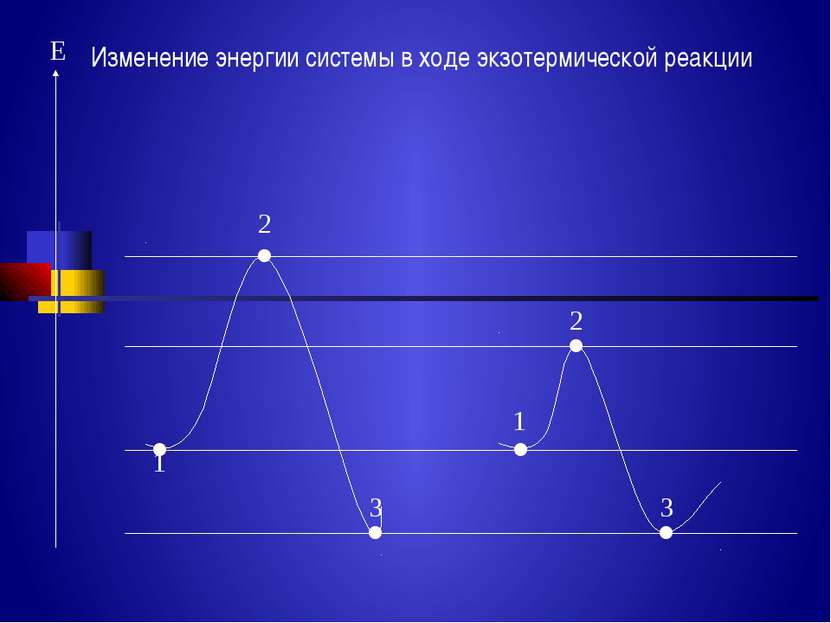
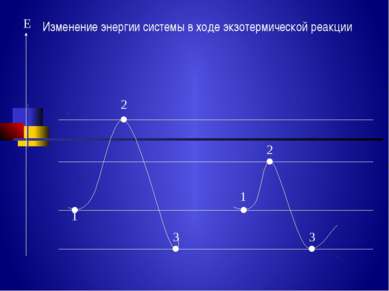
 Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации Еа – кдж /моль
Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, называется энергией активации Еа – кдж /моль