X
Код презентации скопируйте его
Ионная связь 11 класс
Скачать эту презентациюПрезентация на тему Ионная связь 11 класс
Скачать эту презентациюCлайд 1
 Химическая связь 11 класс РАБОТА ВЫПОЛНЕНА учителем химии средней школы №118 Выборгского района Санкт - Петербурга ТИХОМИРОВОЙ ЛЮДМИЛОЙ ВИКТОРОВНОЙ
Химическая связь 11 класс РАБОТА ВЫПОЛНЕНА учителем химии средней школы №118 Выборгского района Санкт - Петербурга ТИХОМИРОВОЙ ЛЮДМИЛОЙ ВИКТОРОВНОЙ
Cлайд 3
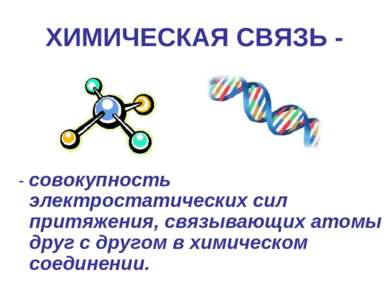 ХИМИЧЕСКАЯ СВЯЗЬ - - совокупность электростатических сил притяжения, связывающих атомы друг с другом в химическом соединении.
ХИМИЧЕСКАЯ СВЯЗЬ - - совокупность электростатических сил притяжения, связывающих атомы друг с другом в химическом соединении.
Cлайд 4
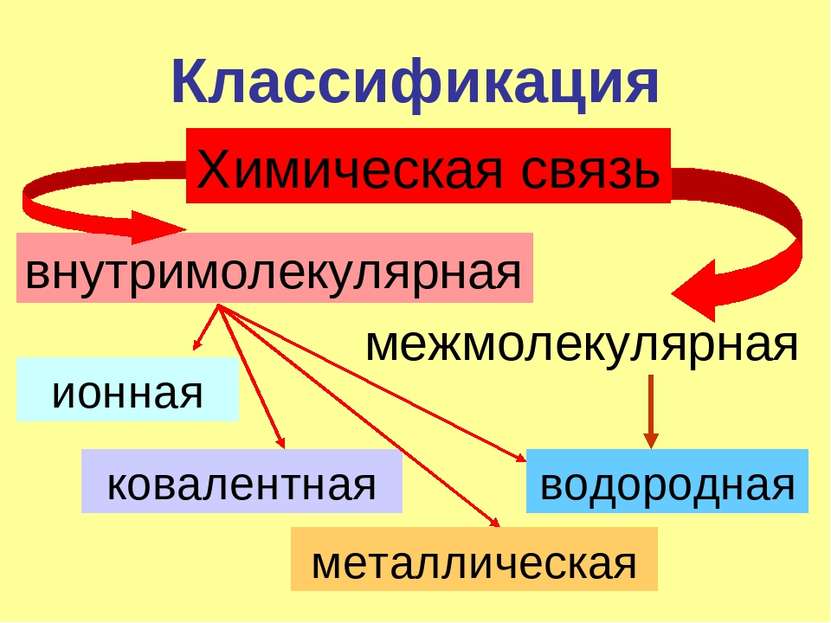
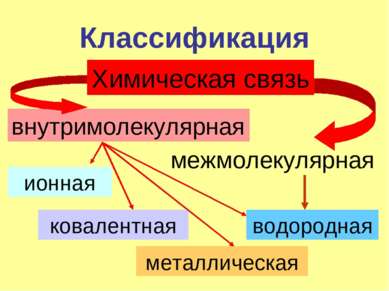 Классификация Химическая связь внутримолекулярная межмолекулярная ионная ковалентная металлическая водородная
Классификация Химическая связь внутримолекулярная межмолекулярная ионная ковалентная металлическая водородная
Cлайд 6
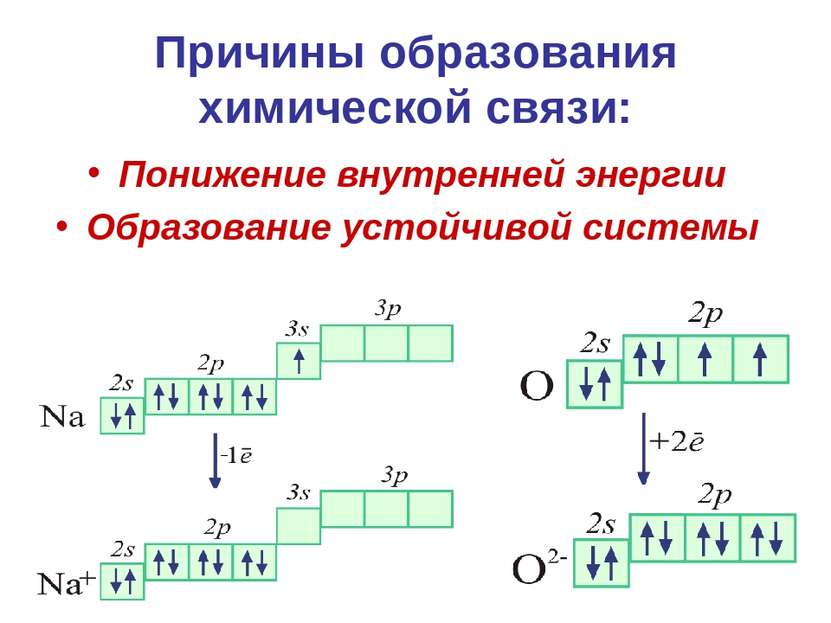
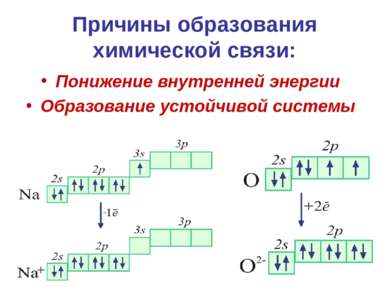 Причины образования химической связи: Понижение внутренней энергии Образование устойчивой системы
Причины образования химической связи: Понижение внутренней энергии Образование устойчивой системы
Cлайд 7
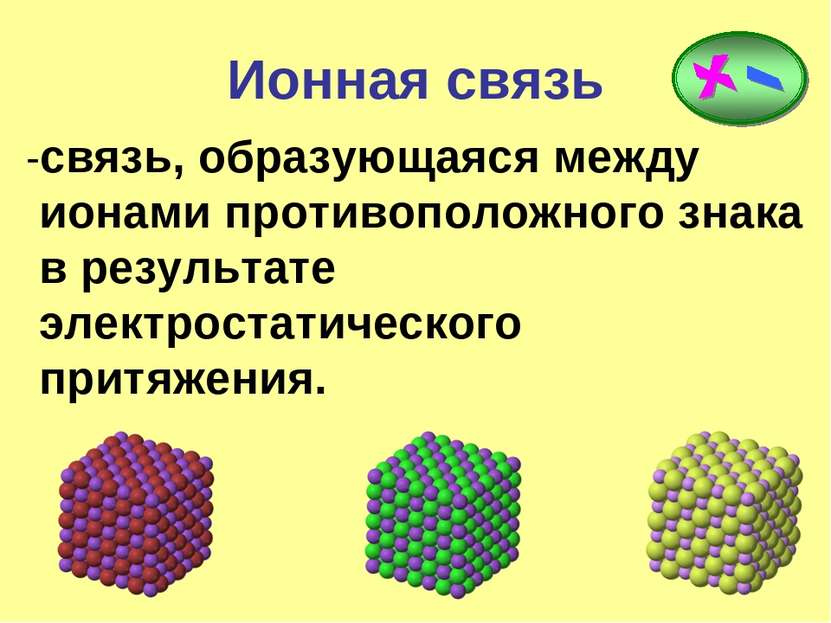
 Ионная связь -связь, образующаяся между ионами противоположного знака в результате электростатического притяжения.
Ионная связь -связь, образующаяся между ионами противоположного знака в результате электростатического притяжения.
Cлайд 8
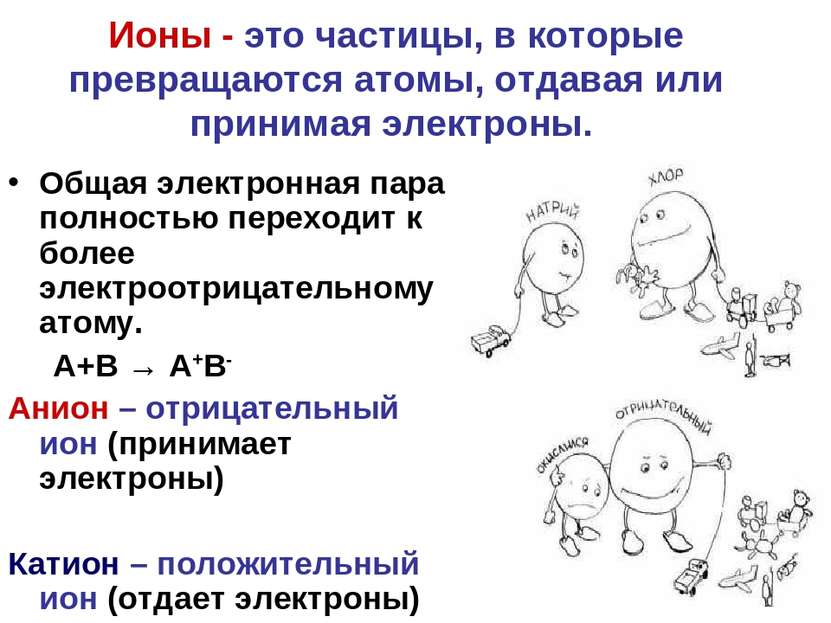
 Ионы - это частицы, в которые превращаются атомы, отдавая или принимая электроны. Общая электронная пара полностью переходит к более электроотрицательному атому. А+В → А+В- Анион – отрицательный ион (принимает электроны) Катион – положительный ион (отдает электроны)
Ионы - это частицы, в которые превращаются атомы, отдавая или принимая электроны. Общая электронная пара полностью переходит к более электроотрицательному атому. А+В → А+В- Анион – отрицательный ион (принимает электроны) Катион – положительный ион (отдает электроны)
Cлайд 9
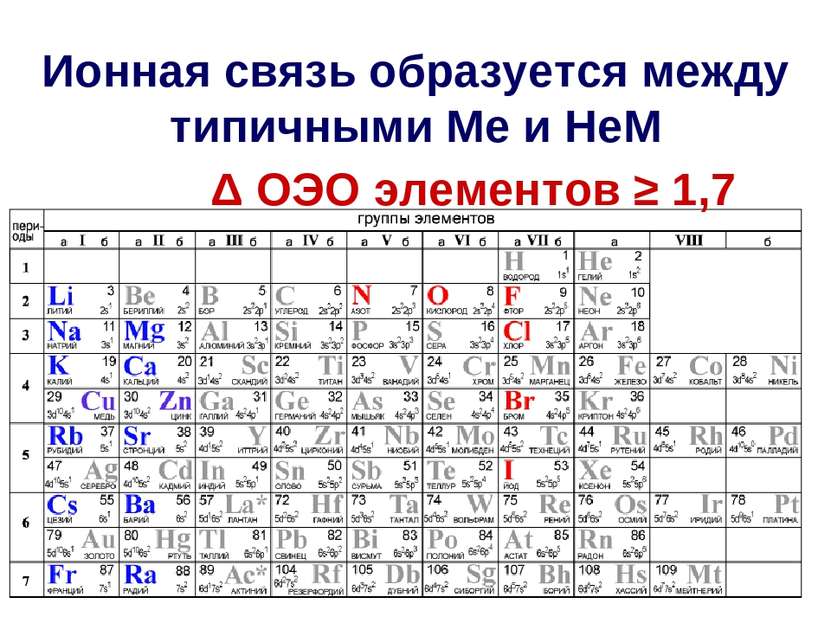
 Электроотрицательность (ЭО) Электроотрицательность (ЭО)- это способность атома смещать к себе общую электронную пару ОЭО Li = 1
Электроотрицательность (ЭО) Электроотрицательность (ЭО)- это способность атома смещать к себе общую электронную пару ОЭО Li = 1
Cлайд 11
 Ионные соединения 1. Бинарные соединения типичных металлов и неметаллов; 2. Соли кислородсодержащих кислот; 3. Щёлочи; 4.Соли аммония NH4Cl, (NH4)2SO4 др.; 5. Соли аминов [СН3NH3]+Cl- и др. NaOH NaCl KOH
Ионные соединения 1. Бинарные соединения типичных металлов и неметаллов; 2. Соли кислородсодержащих кислот; 3. Щёлочи; 4.Соли аммония NH4Cl, (NH4)2SO4 др.; 5. Соли аминов [СН3NH3]+Cl- и др. NaOH NaCl KOH
Cлайд 12
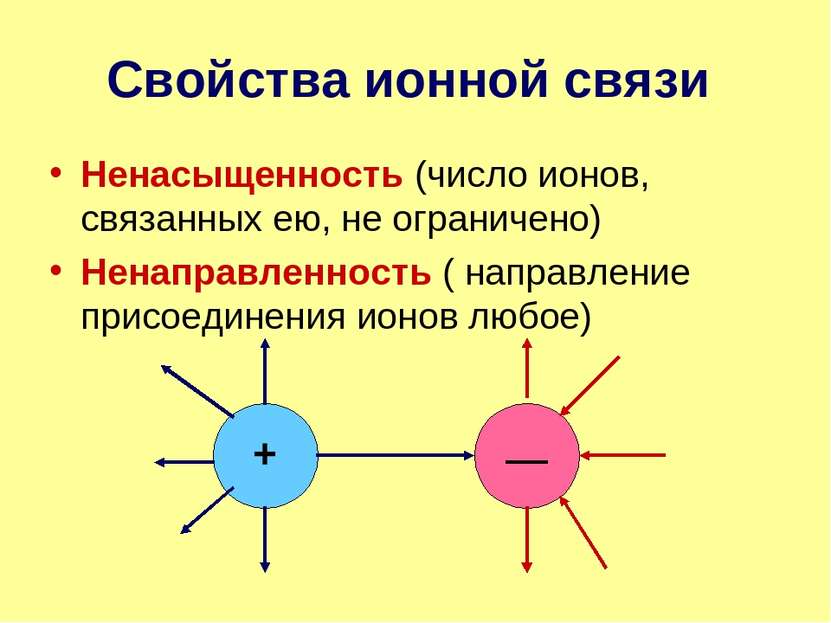
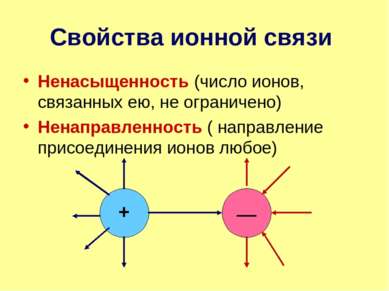 Свойства ионной связи Ненасыщенность (число ионов, связанных ею, не ограничено) Ненаправленность ( направление присоединения ионов любое)
Свойства ионной связи Ненасыщенность (число ионов, связанных ею, не ограничено) Ненаправленность ( направление присоединения ионов любое)
Cлайд 16
 Кристаллические тела – характеризуются пространственной периодичностью в расположении равновесных положений атомов или молекул, при чем эта периодичность выполняется как для малых, так и на больших расстояниях. В кристаллических телах реализуется как дальний, так и ближний порядок.
Кристаллические тела – характеризуются пространственной периодичностью в расположении равновесных положений атомов или молекул, при чем эта периодичность выполняется как для малых, так и на больших расстояниях. В кристаллических телах реализуется как дальний, так и ближний порядок.
Cлайд 17
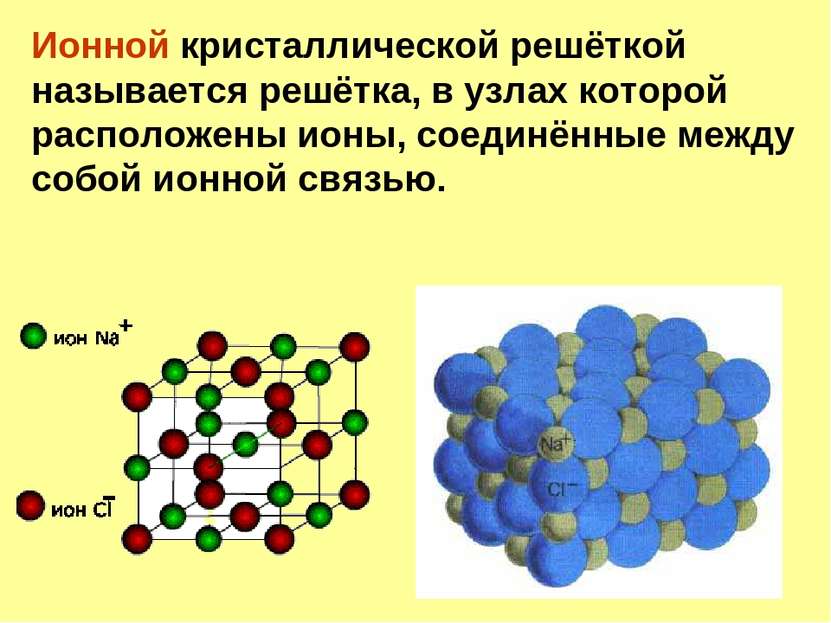
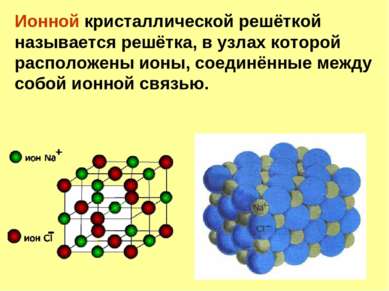 Ионной кристаллической решёткой называется решётка, в узлах которой расположены ионы, соединённые между собой ионной связью.
Ионной кристаллической решёткой называется решётка, в узлах которой расположены ионы, соединённые между собой ионной связью.