X
Код презентации скопируйте его
Окислительно-восстановительные реакции
Скачать эту презентациюПрезентация на тему Окислительно-восстановительные реакции
Скачать эту презентациюCлайд 2
 Важнейшие окислители Сильные F2, O2, O3, H2O2, Cl2 HClO, HClO3, H2SO4, HNO3 Царская водка NO2 KMnO4, MnO2 K2Cr2O7, CrO3 PbO2 Слабые I2, Br2, SO2 HNO2 Соединения Fe3+
Важнейшие окислители Сильные F2, O2, O3, H2O2, Cl2 HClO, HClO3, H2SO4, HNO3 Царская водка NO2 KMnO4, MnO2 K2Cr2O7, CrO3 PbO2 Слабые I2, Br2, SO2 HNO2 Соединения Fe3+
Cлайд 3
 Сильные Щелочные и щелочно-земельные металлы Mg, Al, H2 HI и йодиды HBr и бромиды H2S и сульфиды NH3, PH3, H3PO3 C, CO Соединения Fe2+, Cr2+ Слабые Малоактивные металлы (Pb, Cu, Ag, Hg) HCl SO2 HNO2 Альдегиды, спирты, муравьиная кислота, щавелевая кислота, глюкоза Важнейшие восстановители
Сильные Щелочные и щелочно-земельные металлы Mg, Al, H2 HI и йодиды HBr и бромиды H2S и сульфиды NH3, PH3, H3PO3 C, CO Соединения Fe2+, Cr2+ Слабые Малоактивные металлы (Pb, Cu, Ag, Hg) HCl SO2 HNO2 Альдегиды, спирты, муравьиная кислота, щавелевая кислота, глюкоза Важнейшие восстановители
Cлайд 4
 Составление уравнений окислительно-восстановительных реакций Метод электронного баланса применяется при рассмотрении ОВР, протекающих при: сплавлении веществ, термическом разложении, взаимодействии твердого вещества с газообразным (обжиг), при взаимодействии сухих солей и металлов с практически безводными кислотами Метод ионно-электронного баланса (метод полуреакций) применяется при рассмотрении ОВР, протекающих в водных растворах
Составление уравнений окислительно-восстановительных реакций Метод электронного баланса применяется при рассмотрении ОВР, протекающих при: сплавлении веществ, термическом разложении, взаимодействии твердого вещества с газообразным (обжиг), при взаимодействии сухих солей и металлов с практически безводными кислотами Метод ионно-электронного баланса (метод полуреакций) применяется при рассмотрении ОВР, протекающих в водных растворах
Cлайд 5
 Ионно-электронный метод Достоинства метода В нем применяются не гипотетические ионы, а реально существующие ( не Mn7+, а MnO4-) Видна роль среды как активного участника всего процесса Не нужно знать все получающиеся в результате реакции вещества, они появляются в уравнении реакции при выводе его
Ионно-электронный метод Достоинства метода В нем применяются не гипотетические ионы, а реально существующие ( не Mn7+, а MnO4-) Видна роль среды как активного участника всего процесса Не нужно знать все получающиеся в результате реакции вещества, они появляются в уравнении реакции при выводе его
Cлайд 6
 Ионно-электронный метод Избыток ионов О2- связывается: в кислой среде – ионами Н+ О2- + 2Н+ → Н2О в нейтральной или щелочной средах – молекулами Н2О или гидроксид-ионами ОН- О2- + Н2О → 2ОН-
Ионно-электронный метод Избыток ионов О2- связывается: в кислой среде – ионами Н+ О2- + 2Н+ → Н2О в нейтральной или щелочной средах – молекулами Н2О или гидроксид-ионами ОН- О2- + Н2О → 2ОН-
Cлайд 7
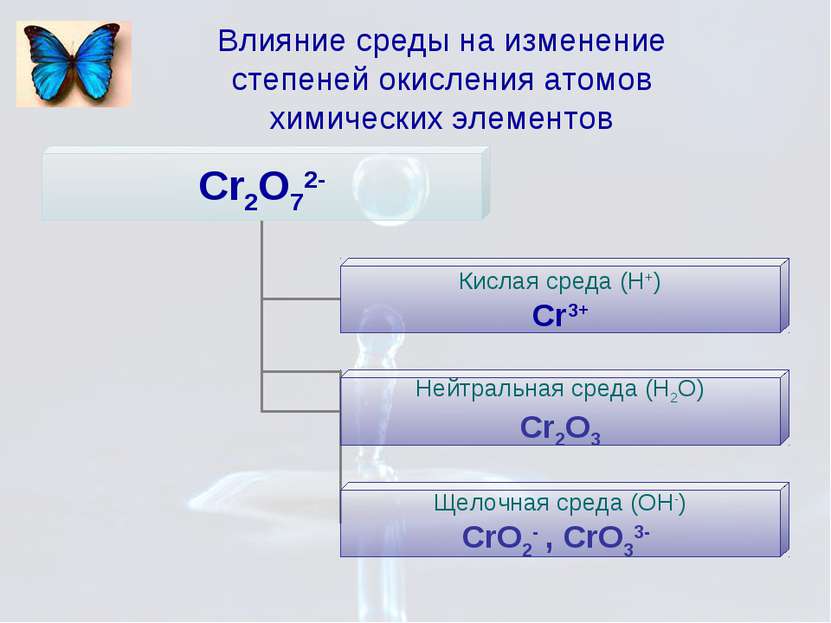
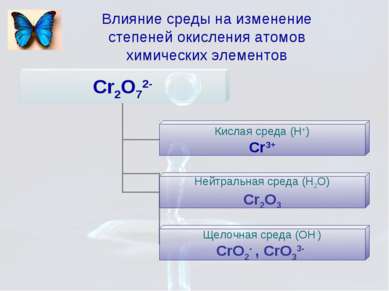
 Влияние некоторых факторов на характер протекания реакции Степень окисления элемента в продуктах реакции зависит от условия проведения этой реакции: от силы окислителя и восстановителя от концентрации окислителя и восстановителя от характера среды (кислотности раствора) от температуры
Влияние некоторых факторов на характер протекания реакции Степень окисления элемента в продуктах реакции зависит от условия проведения этой реакции: от силы окислителя и восстановителя от концентрации окислителя и восстановителя от характера среды (кислотности раствора) от температуры
Cлайд 12
 Литература Володина, М.А, Решетникова, Л.П., Кузяков, Ю.А., Мастрюков, В.С., Чуранов, С.С. Пособие по химии. М.: Изд-во Московского университета, 1978 Новошинский, И.И. Химия. 10 кл.: Учеб. для общеобразоват. Учреждений /И.И. Новошинский, Н.С. Новошинская. – М.: ООО «Издательство Оникс»:ООО «Издательство «Мтр и образование», 2005 – 352 с.: ил. Прошлецов, А.Н., Рунов, Н.Н. Справочник по химии для поступающих в ВУЗы. Ярославль: Изд-во ЯГПУ, 2006 Химия. Медико-биологическое значение и применение в медицине металлов и их соединений. Ярославль, ЯГМА, 1998 Хомченко, Г.П. Химия для поступающих в ВУЗы.: Учебное пособие. – 2-е изд.,испр.- М.: Высшая школа, 1994
Литература Володина, М.А, Решетникова, Л.П., Кузяков, Ю.А., Мастрюков, В.С., Чуранов, С.С. Пособие по химии. М.: Изд-во Московского университета, 1978 Новошинский, И.И. Химия. 10 кл.: Учеб. для общеобразоват. Учреждений /И.И. Новошинский, Н.С. Новошинская. – М.: ООО «Издательство Оникс»:ООО «Издательство «Мтр и образование», 2005 – 352 с.: ил. Прошлецов, А.Н., Рунов, Н.Н. Справочник по химии для поступающих в ВУЗы. Ярославль: Изд-во ЯГПУ, 2006 Химия. Медико-биологическое значение и применение в медицине металлов и их соединений. Ярославль, ЯГМА, 1998 Хомченко, Г.П. Химия для поступающих в ВУЗы.: Учебное пособие. – 2-е изд.,испр.- М.: Высшая школа, 1994