X
Код презентации скопируйте его
Почему протекают химические реакции
Скачать эту презентациюПрезентация на тему Почему протекают химические реакции
Скачать эту презентациюCлайд 1
 11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова И.Г.
11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова И.Г.
Cлайд 2
 План урока. Закон сохранения массы и энергии. Тепловой эффект химической реакции. Экзотермические и эндотермические реакции. Термохимия. Законы термохимии. Кто он Герман Гесс? Понятие об энтропии и энтальпии. Выводы по теме.
План урока. Закон сохранения массы и энергии. Тепловой эффект химической реакции. Экзотермические и эндотермические реакции. Термохимия. Законы термохимии. Кто он Герман Гесс? Понятие об энтропии и энтальпии. Выводы по теме.
Cлайд 3
 Почему протекают химические реакции Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе веществ, образующихся в результате реакции. Закон сохранения массы дает материальную основу для составления уравнений химических реакций и проведения расчетов по ним.
Почему протекают химические реакции Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе веществ, образующихся в результате реакции. Закон сохранения массы дает материальную основу для составления уравнений химических реакций и проведения расчетов по ним.
Cлайд 4
 Закон сохранения массы и энергии Взаимосвязь массы и энергии выражается уравнением Эйнштейна: E = mc2 где Е – энергия; m – масса; с – скорость света в вакууме.
Закон сохранения массы и энергии Взаимосвязь массы и энергии выражается уравнением Эйнштейна: E = mc2 где Е – энергия; m – масса; с – скорость света в вакууме.
Cлайд 5
 Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы
Cлайд 6
 Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов. • И трещат сухие сучья, Разгораясь жарко, Освещая тьму ночную Далеко и ярко! И.Суриков
Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов. • И трещат сухие сучья, Разгораясь жарко, Освещая тьму ночную Далеко и ярко! И.Суриков
Cлайд 9
 Тепловой эффект химической реакции Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентов обычно обозначают символом Q. Q р = Q кон.- Q исх.
Тепловой эффект химической реакции Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентов обычно обозначают символом Q. Q р = Q кон.- Q исх.
Cлайд 11
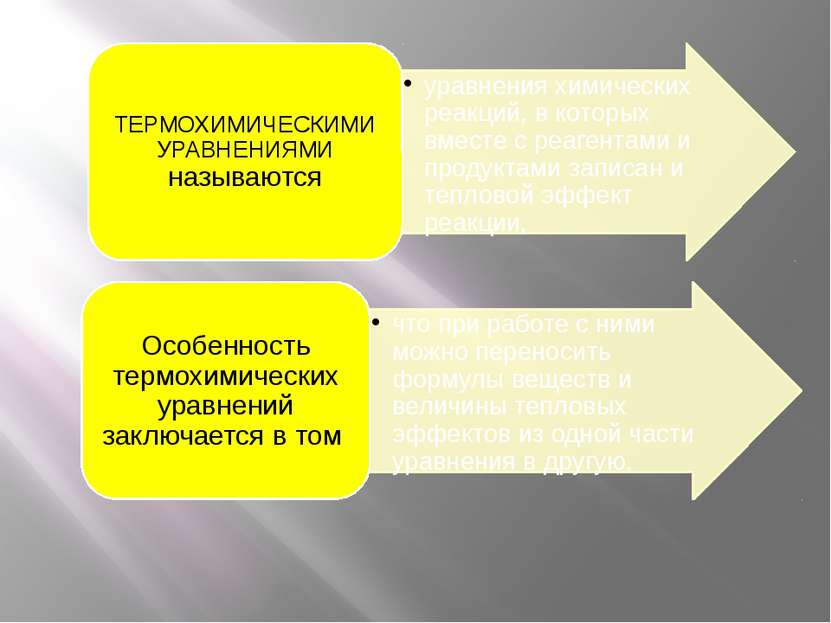
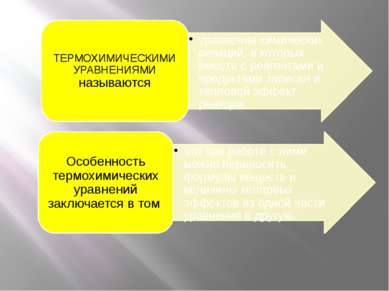
 Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ. Существует два важнейших закона термохимии. Первый из них, закон Лавуазье–Лапласа, формулируется следующим образом:
Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ. Существует два важнейших закона термохимии. Первый из них, закон Лавуазье–Лапласа, формулируется следующим образом:
Cлайд 12
 закон Лавуазье–Лапласа Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
закон Лавуазье–Лапласа Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
Cлайд 13
 Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом: Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом: Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Cлайд 14
 Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Первый путь (одностадийный): 2 NaOH + H2SO4 = Na2SO4 + 2 H2O + 131 кДж; Второй путь (двухстадийный): а) NaOH + H2SO4 = NaНSO4 + H2O + 62 кДж б) NaHSO4 + NaOH = Na2SO4 + H2O + 69 кДж складывая тепловые эффекты двух последовательных реакций в способе (2) мы получаем тот же тепловой эффект, что и для способа (1): 65 кДж + 69 кДж = 131 кДж
Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Первый путь (одностадийный): 2 NaOH + H2SO4 = Na2SO4 + 2 H2O + 131 кДж; Второй путь (двухстадийный): а) NaOH + H2SO4 = NaНSO4 + H2O + 62 кДж б) NaHSO4 + NaOH = Na2SO4 + H2O + 69 кДж складывая тепловые эффекты двух последовательных реакций в способе (2) мы получаем тот же тепловой эффект, что и для способа (1): 65 кДж + 69 кДж = 131 кДж
Cлайд 15
 Ученый, чьим именем назван основной закон термохимии, несколько лет работал врачом в Иркутске; по учебнику, написанному им, учился Дмитрий Менделеев По-настоящему его звали Гесс Герман Генрих. И немудрено — родился он в многонациональной Женеве, где говорили по-немецки столь же широко, как и на других языках. Однако вырос и до конца своих дней прожил в России, где его величали на славянский манер — Герман Иванович. Так что в историю науки он вошел русским ученым, хоть и с заморской фамилией. Герман Гесс стал мировым светилом. Что примечательно, не только благодаря острому уму, знаниям и интересу к химии, но и Сибири — Иркутску, Байкалу. Изучая наш край, он собрал богатый фактический материал и написал работу, представив которую в Санкт-Петербургскую академию наук, был сразу произведен в адъюнкты и продолжил исследования по части химии при этом авторитетном научном заведении: открыл лабораторию, проводил многочисленные опыты.
Ученый, чьим именем назван основной закон термохимии, несколько лет работал врачом в Иркутске; по учебнику, написанному им, учился Дмитрий Менделеев По-настоящему его звали Гесс Герман Генрих. И немудрено — родился он в многонациональной Женеве, где говорили по-немецки столь же широко, как и на других языках. Однако вырос и до конца своих дней прожил в России, где его величали на славянский манер — Герман Иванович. Так что в историю науки он вошел русским ученым, хоть и с заморской фамилией. Герман Гесс стал мировым светилом. Что примечательно, не только благодаря острому уму, знаниям и интересу к химии, но и Сибири — Иркутску, Байкалу. Изучая наш край, он собрал богатый фактический материал и написал работу, представив которую в Санкт-Петербургскую академию наук, был сразу произведен в адъюнкты и продолжил исследования по части химии при этом авторитетном научном заведении: открыл лабораторию, проводил многочисленные опыты.
Cлайд 17
 Энтальпия это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании. Величина, характеризующая теплосодержание - D Н
Энтальпия это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании. Величина, характеризующая теплосодержание - D Н
Cлайд 18
 Энтальпия и тепловой эффект противоположны по знаку При экзотермических реакциях, когда тепло выделяется, D Н отрицательно. При эндотермических реакциях (тепло поглощается) и D H положительно.
Энтальпия и тепловой эффект противоположны по знаку При экзотермических реакциях, когда тепло выделяется, D Н отрицательно. При эндотермических реакциях (тепло поглощается) и D H положительно.
Cлайд 19
 Как вычислить тепловой эффект реакции Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом числа молей веществ, участвующих в реакции, т. е. стехиометрических коэффициентов в уравнении протекающей реакции): DH = Hкон.- Hисх.
Как вычислить тепловой эффект реакции Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом числа молей веществ, участвующих в реакции, т. е. стехиометрических коэффициентов в уравнении протекающей реакции): DH = Hкон.- Hисх.
Cлайд 20
 энтропия Функция характеризующая степень беспорядка DS Чем больше частиц в системе, тем больше в системе беспорядка Твердое вещество жидкость газ Степень беспорядка увеличивается -----> Вычислить изменения энтропии можно на основании справочных данных по формуле: DS =S кон.- Sисх.
энтропия Функция характеризующая степень беспорядка DS Чем больше частиц в системе, тем больше в системе беспорядка Твердое вещество жидкость газ Степень беспорядка увеличивается -----> Вычислить изменения энтропии можно на основании справочных данных по формуле: DS =S кон.- Sисх.
Cлайд 21
 Выводы Всякая химическая реакция характеризуется двумя энергетическими характеристиками: энтальпией (DH) и энтропией (DS). Для самопроизвольных реакций характерно стремление к уменьшению энергии за счет выделения ее в окружающую среду и к увеличению степени беспорядка. При вычислении Qр необходимо учитывать закон Гесса.
Выводы Всякая химическая реакция характеризуется двумя энергетическими характеристиками: энтальпией (DH) и энтропией (DS). Для самопроизвольных реакций характерно стремление к уменьшению энергии за счет выделения ее в окружающую среду и к увеличению степени беспорядка. При вычислении Qр необходимо учитывать закон Гесса.
Cлайд 22
 Задача 5 При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции. Решение Составить уравнение. 3О2 + 4Аl = 2Аl2О3 + Х кДж Вычислить количество вещества содержащего 18 г алюминия. n = m/M n (Аl) = 18г : 27г/моль =0,67 моль Составить и решить пропорцию. При окислении 0,67 моль алюминия выделяется 547 кДж теплоты При окислении 4 моль алюминия выделяется Х кДж теплоты Х = 4 •547 : 0,67 = 3265,67 кДж Составим термохимическое уравнение этой реакции. 3О2 + 4Аl = 2Аl2О3 + 2365 кДж
Задача 5 При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции. Решение Составить уравнение. 3О2 + 4Аl = 2Аl2О3 + Х кДж Вычислить количество вещества содержащего 18 г алюминия. n = m/M n (Аl) = 18г : 27г/моль =0,67 моль Составить и решить пропорцию. При окислении 0,67 моль алюминия выделяется 547 кДж теплоты При окислении 4 моль алюминия выделяется Х кДж теплоты Х = 4 •547 : 0,67 = 3265,67 кДж Составим термохимическое уравнение этой реакции. 3О2 + 4Аl = 2Аl2О3 + 2365 кДж