X
Код презентации скопируйте его
Скорость химической реакции. Факторы влияющие на скорость химических реакций
Скачать эту презентациюПрезентация на тему Скорость химической реакции. Факторы влияющие на скорость химических реакций
Скачать эту презентациюCлайд 2
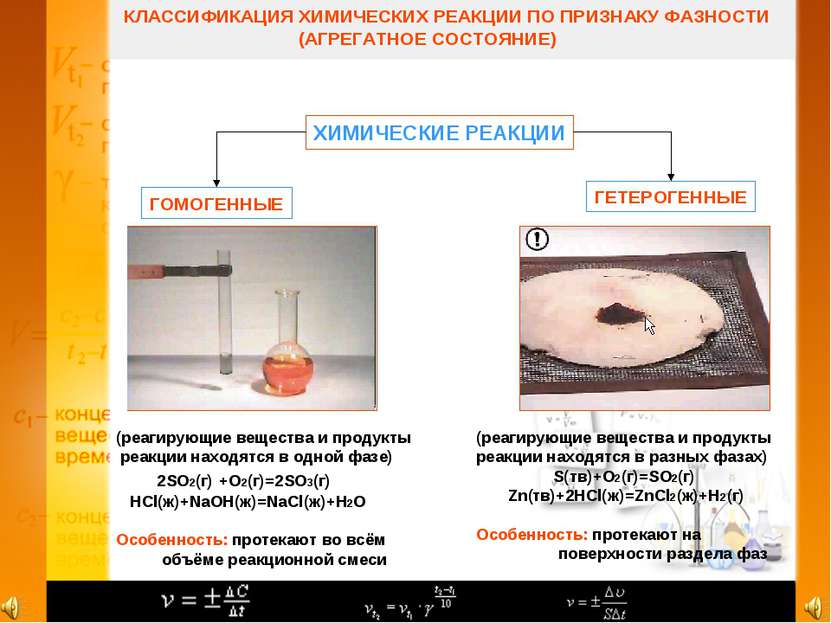
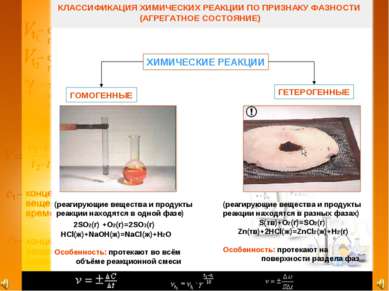 КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ПРИЗНАКУ ФАЗНОСТИ (АГРЕГАТНОЕ СОСТОЯНИЕ) ХИМИЧЕСКИЕ РЕАКЦИИ ГОМОГЕННЫЕ ГЕТЕРОГЕННЫЕ (реагирующие вещества и продукты реакции находятся в одной фазе) 2SO2(г) +O2(г)=2SO3(г) HCl(ж)+NaOH(ж)=NaCl(ж)+H2O Особенность: протекают во всём объёме реакционной смеси (реагирующие вещества и продукты реакции находятся в разных фазах) S(тв)+O2(г)=SO2(г) Zn(тв)+2HCl(ж)=ZnCl2(ж)+H2(г) Особенность: протекают на поверхности раздела фаз
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ПРИЗНАКУ ФАЗНОСТИ (АГРЕГАТНОЕ СОСТОЯНИЕ) ХИМИЧЕСКИЕ РЕАКЦИИ ГОМОГЕННЫЕ ГЕТЕРОГЕННЫЕ (реагирующие вещества и продукты реакции находятся в одной фазе) 2SO2(г) +O2(г)=2SO3(г) HCl(ж)+NaOH(ж)=NaCl(ж)+H2O Особенность: протекают во всём объёме реакционной смеси (реагирующие вещества и продукты реакции находятся в разных фазах) S(тв)+O2(г)=SO2(г) Zn(тв)+2HCl(ж)=ZnCl2(ж)+H2(г) Особенность: протекают на поверхности раздела фаз
Cлайд 3
 СКОРОСТИ РЕАКЦИЙ Скорость гомогенной реакции Скорость гетерогенной реакции А (г) +В (г) = С (г) ∆V = V2-V1 ∆ t = t2-t1 V (гом) = ∆V /(∆ t * V) С = V / V (моль/л) V (гом) = ± ∆С/ ∆ t (моль/л*с) V (гет) = ± ∆V /(S*∆ t ) (моль/м^2*с)
СКОРОСТИ РЕАКЦИЙ Скорость гомогенной реакции Скорость гетерогенной реакции А (г) +В (г) = С (г) ∆V = V2-V1 ∆ t = t2-t1 V (гом) = ∆V /(∆ t * V) С = V / V (моль/л) V (гом) = ± ∆С/ ∆ t (моль/л*с) V (гет) = ± ∆V /(S*∆ t ) (моль/м^2*с)
Cлайд 4
![Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[... Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[...](https://bigslide.ru/images/17/16271/389/img3.jpg) Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[B] Природа реагирующих веществ Площадь поверхности соприкосновения температура катализатор
Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[B] Природа реагирующих веществ Площадь поверхности соприкосновения температура катализатор
Cлайд 5
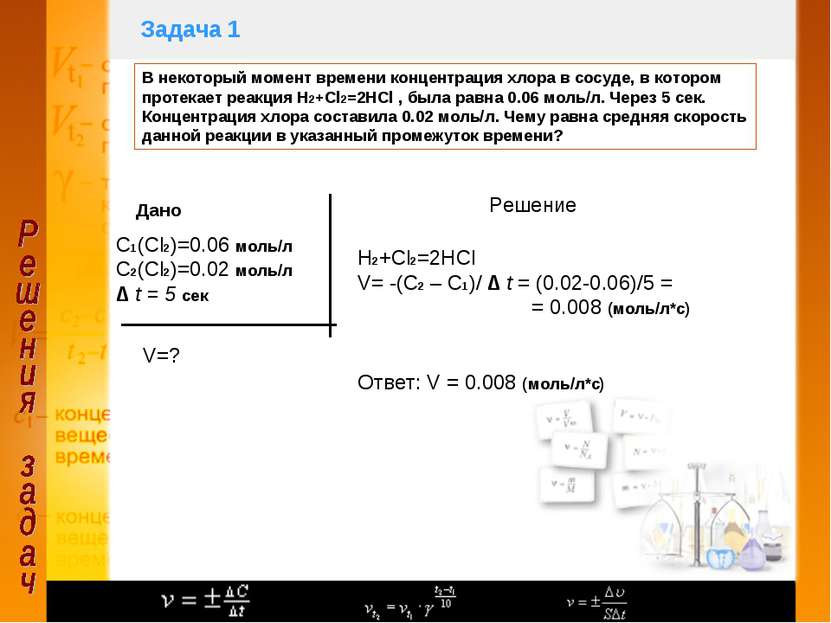
 Задача 1 В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2+Cl2=2HCl , была равна 0.06 моль/л. Через 5 сек. Концентрация хлора составила 0.02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени? Дано С1(Cl2)=0.06 моль/л С2(Сl2)=0.02 моль/л ∆ t = 5 сек V=? Решение H2+Cl2=2HCl V= -(C2 – C1)/ ∆ t = (0.02-0.06)/5 = = 0.008 (моль/л*с) Ответ: V = 0.008 (моль/л*с)
Задача 1 В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2+Cl2=2HCl , была равна 0.06 моль/л. Через 5 сек. Концентрация хлора составила 0.02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени? Дано С1(Cl2)=0.06 моль/л С2(Сl2)=0.02 моль/л ∆ t = 5 сек V=? Решение H2+Cl2=2HCl V= -(C2 – C1)/ ∆ t = (0.02-0.06)/5 = = 0.008 (моль/л*с) Ответ: V = 0.008 (моль/л*с)
Cлайд 6
 Задача 2 Как изменится скорость, протекающей в водном растворе, реакции FeCl3+3KCNS=Fe(CNS)3+3KCl при разбавлении реагирующей смеси водой в два раза Дано С(ионов) < 2 раза V2/V1=? Решение Fe(3+) + 3CNS(-) = Fe(CNS)3 V =k[Fe(3+)]*[CNS(-)]^3 пусть до разбавления: х = [Fe(3+)] Y = [CNS(-)]^3 В результате разбавления концентрация ионов уменьшается: x/2 = [Fe(3+)] y/2 = [CNS(-)] V2/V1 = k*(x/2)*(y/2)^3 = 16 Ответ: V2/V1 = 16 ^3 – в степени 3
Задача 2 Как изменится скорость, протекающей в водном растворе, реакции FeCl3+3KCNS=Fe(CNS)3+3KCl при разбавлении реагирующей смеси водой в два раза Дано С(ионов) < 2 раза V2/V1=? Решение Fe(3+) + 3CNS(-) = Fe(CNS)3 V =k[Fe(3+)]*[CNS(-)]^3 пусть до разбавления: х = [Fe(3+)] Y = [CNS(-)]^3 В результате разбавления концентрация ионов уменьшается: x/2 = [Fe(3+)] y/2 = [CNS(-)] V2/V1 = k*(x/2)*(y/2)^3 = 16 Ответ: V2/V1 = 16 ^3 – в степени 3
Cлайд 7
 Задача 3 Как изменится скорость реакции при повышении температуры от 55 до 100 ‘С, если температурный коэффициент скорости этой реакции равен 2.5 ? Дано γ =2.5 t1= 55 ‘ t2 = 100 ’ Vt2/Vt1=? Решение = 2.5*((100-55)/10) = =25^4.5 = (5/2)^9/9= 43.7 Ответ: скорость реакции увеличивается в 43.7 раза
Задача 3 Как изменится скорость реакции при повышении температуры от 55 до 100 ‘С, если температурный коэффициент скорости этой реакции равен 2.5 ? Дано γ =2.5 t1= 55 ‘ t2 = 100 ’ Vt2/Vt1=? Решение = 2.5*((100-55)/10) = =25^4.5 = (5/2)^9/9= 43.7 Ответ: скорость реакции увеличивается в 43.7 раза
Cлайд 8
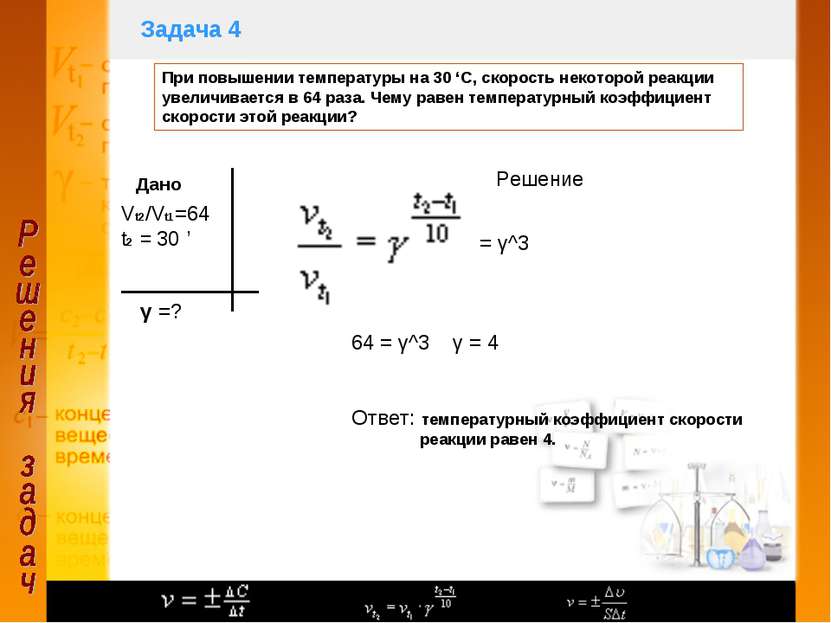
 Задача 4 При повышении температуры на 30 ‘С, скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент скорости этой реакции? Дано Vt2/Vt1=64 t2 = 30 ’ γ =? Решение = γ^3 64 = γ^3 γ = 4 Ответ: температурный коэффициент скорости реакции равен 4.
Задача 4 При повышении температуры на 30 ‘С, скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент скорости этой реакции? Дано Vt2/Vt1=64 t2 = 30 ’ γ =? Решение = γ^3 64 = γ^3 γ = 4 Ответ: температурный коэффициент скорости реакции равен 4.
Cлайд 9
 Тест: закрепление знаний 1. Для уменьшения скорости реакции необходимо: а) увеличить концентрацию реагирующих веществ б) ввести в систему катализатор в) повысить температуру г) понизить температуру 2. С наибольшей скоростью протекает реакция: а) нейтрализации б) горение серы в воздухе в) растворение магния в кислоте г) восстановление оксида меди водородом 3. Укажите гомогенную реакцию. а) CaO+H2O=Ca(OH)2 б) S+O2=SO2 в) 2CO+O2=2CO2 г) MgCO3 MgO+CO2 4. Укажите гетерогенную реакцию. а) 2CO+O2=2CO2 б) H2+Cl2=2HCl в) 2SO2+O2=2SO2 (кат V2O5) г) N2O+H2=N2+H2O 5. Отметьте, какая реакция является одновременно гомогенной и каталитической. а) 2SO2+O2=2SO3 (кат NO2) б) CaO+CO2=CaCO3 в) H2+Cl2=2HCl г) N2+3H2=2NH3 (кат Fe)
Тест: закрепление знаний 1. Для уменьшения скорости реакции необходимо: а) увеличить концентрацию реагирующих веществ б) ввести в систему катализатор в) повысить температуру г) понизить температуру 2. С наибольшей скоростью протекает реакция: а) нейтрализации б) горение серы в воздухе в) растворение магния в кислоте г) восстановление оксида меди водородом 3. Укажите гомогенную реакцию. а) CaO+H2O=Ca(OH)2 б) S+O2=SO2 в) 2CO+O2=2CO2 г) MgCO3 MgO+CO2 4. Укажите гетерогенную реакцию. а) 2CO+O2=2CO2 б) H2+Cl2=2HCl в) 2SO2+O2=2SO2 (кат V2O5) г) N2O+H2=N2+H2O 5. Отметьте, какая реакция является одновременно гомогенной и каталитической. а) 2SO2+O2=2SO3 (кат NO2) б) CaO+CO2=CaCO3 в) H2+Cl2=2HCl г) N2+3H2=2NH3 (кат Fe)
Cлайд 10
 Тест: закрепление знаний 6. Укажите, как изменится скорость бимолекулярной газовой реакции 2NO2=N2O4 при увеличении концентрации NO2 в три раза. а) увеличится в 3 раза б) уменьшится в 6 раз в) увеличится в 9 раз г) увеличится в 6 раз 7. Укажите какому процессу соответствует выражение закона действующих масс для скорости химической реакции V=k[O2]^x. а) S+O2=SO2 б) 2H2+O2=2H2O в) 2CO+O2=2CO2 г) N2+O2=2NO 8. Отметьте, скорость какого процесса не изменится, если увеличить давление в реакционном сосуде ( t без изменения ). а) 2NO+O2=2NO2 б) H2+Cl2=2HCl в) CaO+H2O=Ca(OH)2 г) N2O4=2NO2 9. Рассчитайте, чему равен температурный коэффициент скорости реакции, если при понижении температуры на 40’С её скорость уменьшилась в 81 раз.
Тест: закрепление знаний 6. Укажите, как изменится скорость бимолекулярной газовой реакции 2NO2=N2O4 при увеличении концентрации NO2 в три раза. а) увеличится в 3 раза б) уменьшится в 6 раз в) увеличится в 9 раз г) увеличится в 6 раз 7. Укажите какому процессу соответствует выражение закона действующих масс для скорости химической реакции V=k[O2]^x. а) S+O2=SO2 б) 2H2+O2=2H2O в) 2CO+O2=2CO2 г) N2+O2=2NO 8. Отметьте, скорость какого процесса не изменится, если увеличить давление в реакционном сосуде ( t без изменения ). а) 2NO+O2=2NO2 б) H2+Cl2=2HCl в) CaO+H2O=Ca(OH)2 г) N2O4=2NO2 9. Рассчитайте, чему равен температурный коэффициент скорости реакции, если при понижении температуры на 40’С её скорость уменьшилась в 81 раз.



![Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[... Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[...](https://bigslide.ru/images/17/16271/831/img3.jpg)