X
Код презентации скопируйте его
Электролитическая диссоциация
Скачать эту презентациюПрезентация на тему Электролитическая диссоциация
Скачать эту презентациюCлайд 1
 Проектная работа: Электролитическая диссоциация ИКТ фестиваль учителей химии Автор работы Русецкая О.П. учитель химии высшей категории МОУ СОШ № 7 г.Ноябрьска
Проектная работа: Электролитическая диссоциация ИКТ фестиваль учителей химии Автор работы Русецкая О.П. учитель химии высшей категории МОУ СОШ № 7 г.Ноябрьска
Cлайд 3
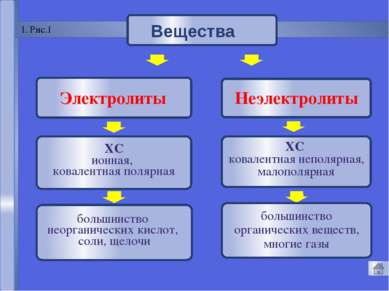 «Капля воды и камень точит» 1. Электролиты и неэлектролиты Вода – хороший растворитель, т.к. молекулы воды полярны. слабый амфотерный электролит. ион гидроксония Ионное произведение воды КН2О = [Н+]•[ОН-] = 10-7•10-7 = 10-14 (КН2О) Вода – Механизм ЭД 104,50
«Капля воды и камень точит» 1. Электролиты и неэлектролиты Вода – хороший растворитель, т.к. молекулы воды полярны. слабый амфотерный электролит. ион гидроксония Ионное произведение воды КН2О = [Н+]•[ОН-] = 10-7•10-7 = 10-14 (КН2О) Вода – Механизм ЭД 104,50
Cлайд 4
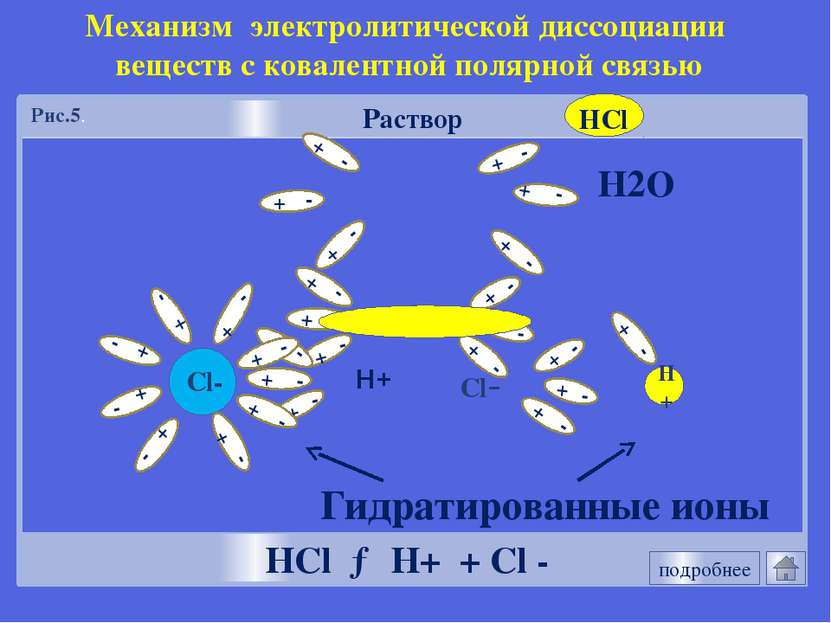
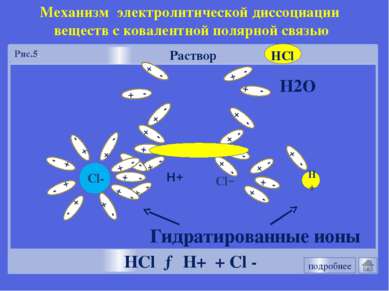
 Механизм электролитической диссоциации NaCl Разрушение кристаллической решетки под действием молекул воды. Гидратация NaCl + nН2О →Na+ (Н2О)х + Сl-(Н2О)n-х NaCl → Na+ + Cl - HCl Поляризация связи в молекуле НСl под действием молекул воды. Гидратация HCl + nН2О →H+ (Н2О)х + Сl-(Н2О)n-х НCl → Н+ + Cl - Механизм ЭД Механизм ЭД
Механизм электролитической диссоциации NaCl Разрушение кристаллической решетки под действием молекул воды. Гидратация NaCl + nН2О →Na+ (Н2О)х + Сl-(Н2О)n-х NaCl → Na+ + Cl - HCl Поляризация связи в молекуле НСl под действием молекул воды. Гидратация HCl + nН2О →H+ (Н2О)х + Сl-(Н2О)n-х НCl → Н+ + Cl - Механизм ЭД Механизм ЭД
Cлайд 5
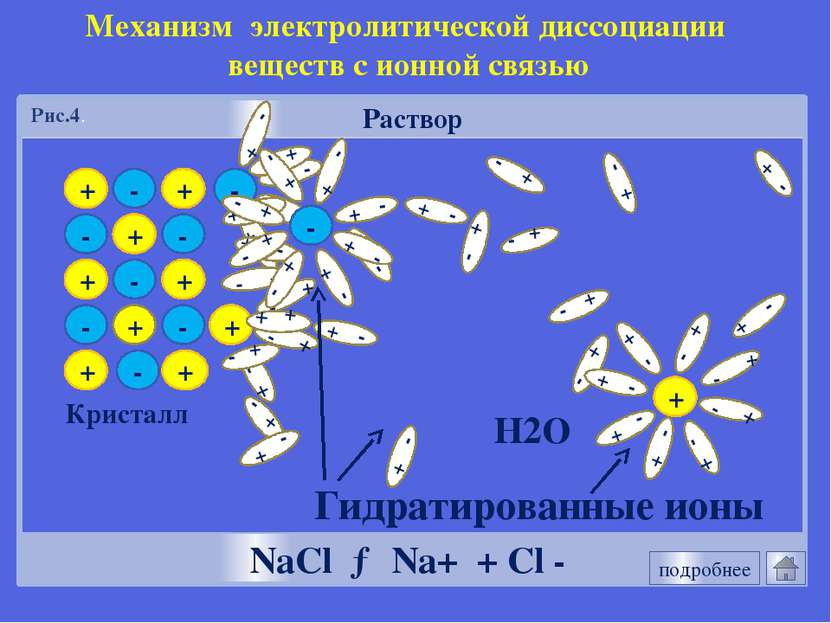
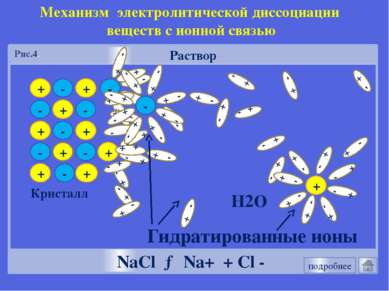
 + + - - + + - - Раствор Кристалл - + + + - - + + - - - + NaCl → Na+ + Cl - Механизм электролитической диссоциации веществ с ионной связью Гидратированные ионы Н2О Рис.4. подробнее + - - - Рисунок 1.
+ + - - + + - - Раствор Кристалл - + + + - - + + - - - + NaCl → Na+ + Cl - Механизм электролитической диссоциации веществ с ионной связью Гидратированные ионы Н2О Рис.4. подробнее + - - - Рисунок 1.
Cлайд 6
 6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных тканей живых организмов. Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2; имеют большое значение для физиологических и биохимических процессов: ионы H+; OH- играют большую роль в работе ферментов, обмене веществ, переваривании пищи и др. при нарушении водно-солевого обмена в медицине применяется физиологический раствор – 0,85% раствор NaCl; ионы I - влияют на работу щитовидной железы. НCO3-
6. О значении электролитов для живых организмов Электролитическая диссоциация Электролиты – составная часть жидкостей и плотных тканей живых организмов. Ионы Na+,K+,Ca2+,Mg2+,H+; OH-; Cl-; SO4-2; имеют большое значение для физиологических и биохимических процессов: ионы H+; OH- играют большую роль в работе ферментов, обмене веществ, переваривании пищи и др. при нарушении водно-солевого обмена в медицине применяется физиологический раствор – 0,85% раствор NaCl; ионы I - влияют на работу щитовидной железы. НCO3-
Cлайд 7
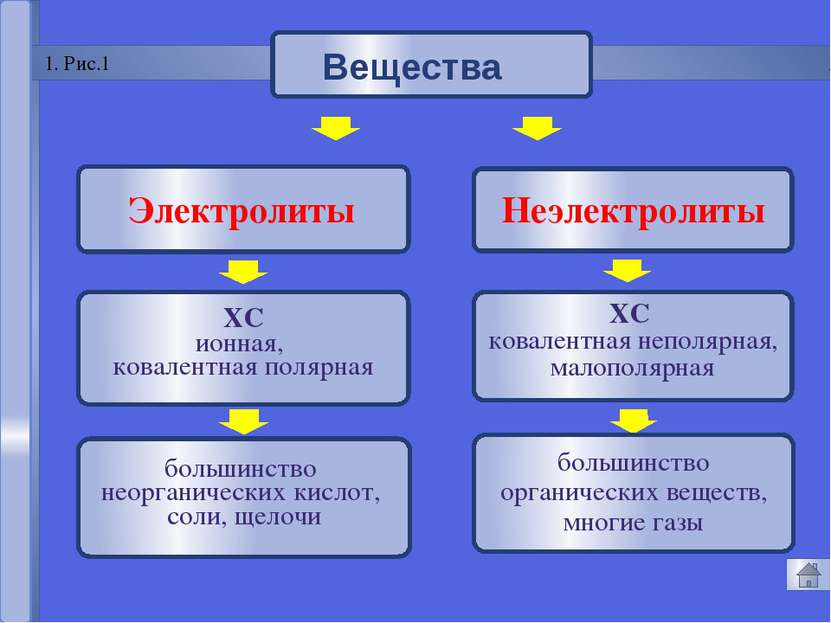
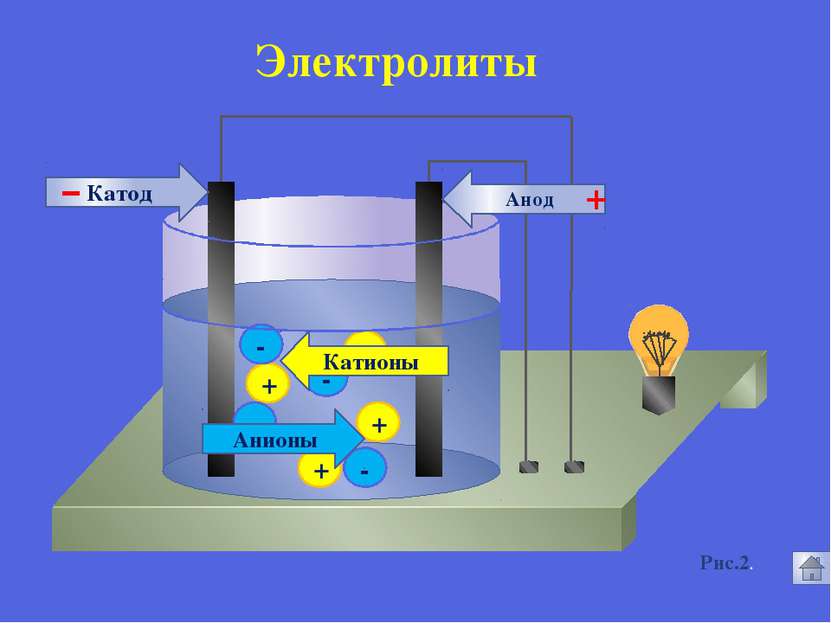
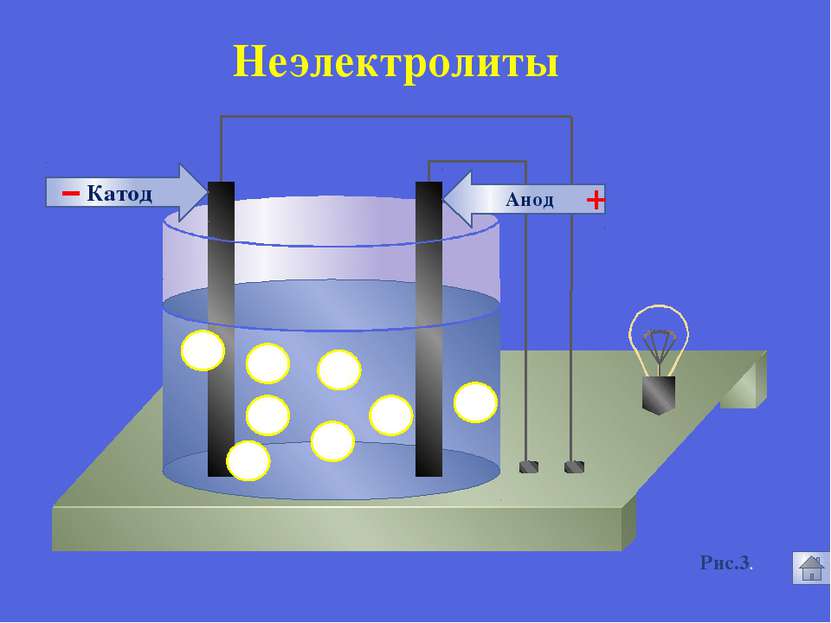
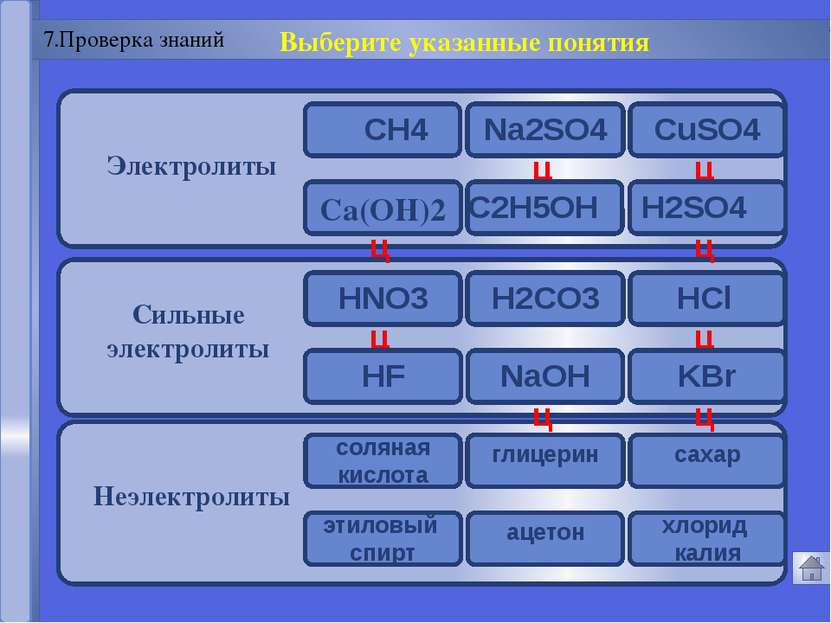
 Русецкая О.П. 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Неэлектролиты - Органические вещества: сахар, ацетон,бензин, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот идр.
Русецкая О.П. 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Неэлектролиты - Органические вещества: сахар, ацетон,бензин, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот идр.
Cлайд 9
 «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация процесс распада молекул электролита на ионы в растворе или расплаве. С.Аррениус Электролитическая диссоциация - Теория электролитической диссоциации. 1887 г.
«Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация процесс распада молекул электролита на ионы в растворе или расплаве. С.Аррениус Электролитическая диссоциация - Теория электролитической диссоциации. 1887 г.
Cлайд 10
 «Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация Аррениус Сванте Август Шведский ученый, академик. В 1887 году сформулировал основные положения теории электролитической диссоциации. В 1903 г. награжден Нобелевской премией. Проводил исследования во многих других областях науки. С.Аррениус (1859 – 1927)
«Честь науке- ей дано уменье, выводить нас из заблужденья». М.Светлов 2.Электролитическая диссоциация Аррениус Сванте Август Шведский ученый, академик. В 1887 году сформулировал основные положения теории электролитической диссоциации. В 1903 г. награжден Нобелевской премией. Проводил исследования во многих других областях науки. С.Аррениус (1859 – 1927)
Cлайд 11
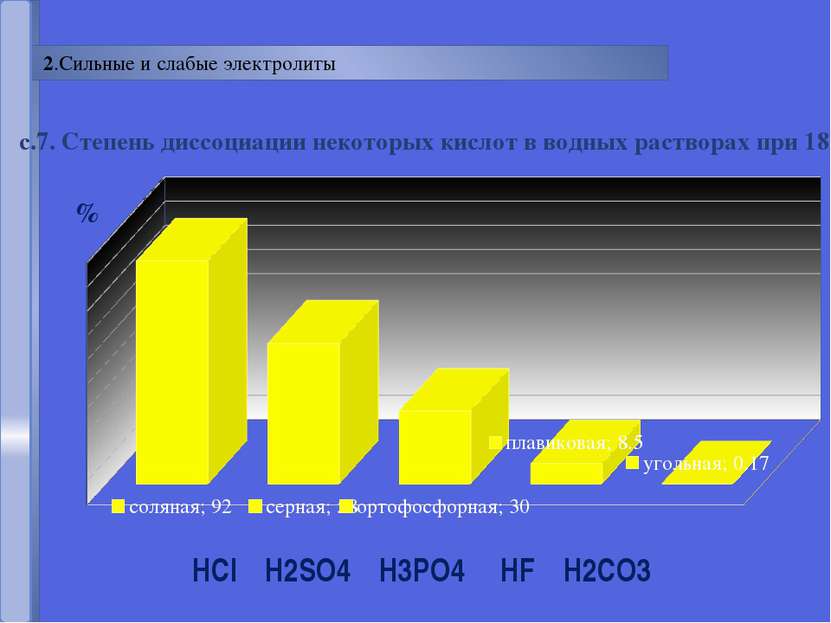
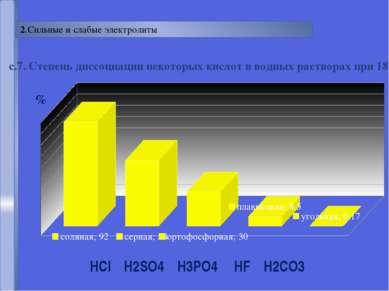
 Русецкая О.П. отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. Степень электролитической диссоциации (α) - α = n N Сильные электролиты α > 30% Слабые электролиты α< 30%
Русецкая О.П. отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. Степень электролитической диссоциации (α) - α = n N Сильные электролиты α > 30% Слабые электролиты α< 30%
Cлайд 14
 Русецкая О.П. это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы. Основания - Диссоциация оснований KOH → K + + OН- Ca(OH)2 Ca2+ + 2 Мe(OH)n Men+ + n OН- OН- ОН-
Русецкая О.П. это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы. Основания - Диссоциация оснований KOH → K + + OН- Ca(OH)2 Ca2+ + 2 Мe(OH)n Men+ + n OН- OН- ОН-
Cлайд 15
 Русецкая О.П. это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка. Соли - Диссоциация солей NaCl → + K2SO4 → 2 + Al(NO3)3 → + 3 Na+ K+ Al3+ (кислотный остаток)в- NO3 - Сl- SO4 2- Men+
Русецкая О.П. это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка. Соли - Диссоциация солей NaCl → + K2SO4 → 2 + Al(NO3)3 → + 3 Na+ K+ Al3+ (кислотный остаток)в- NO3 - Сl- SO4 2- Men+
Cлайд 16
 6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека подробнее Ионы Типичный симптом Са2+ Замедлениероста скелета Mg2+ Мускульные судороги Fe2+ Анемия, нарушение иммунной системы Zn2+ Повреждение кожи, замедлениеполового созревания Mn2+ Учащение депрессий, дерматиты
6. Рис.8. Характерные симптомы дефицита химических элементов в организме человека подробнее Ионы Типичный симптом Са2+ Замедлениероста скелета Mg2+ Мускульные судороги Fe2+ Анемия, нарушение иммунной системы Zn2+ Повреждение кожи, замедлениеполового созревания Mn2+ Учащение депрессий, дерматиты
Cлайд 17
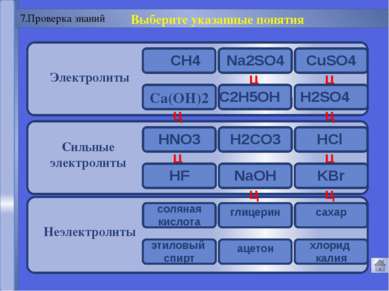
 Русецкая О.П. Электролитическая диссоциация 7. Проверка знаний Русецкая О.П. Электролитическая диссоциация в растворах – это процесс распада электролита на __________ . Вопрос 1 Русецкая О.П. Электролитическая диссоциация электролитов в растворах протекает под действием __________ . Вопрос 2 Русецкая О.П. Слабым электролитом является _______ . Вопрос 3 Русецкая О.П. Электролитами не являются ________ . Вопрос 4 Русецкая О.П. Основные положения электролитической диссоциации сформулировал ученый ______. Вопрос 5 А B С D атомы А ионы B молекулы С электроны D электрического тока А катализатора B молекул растворителя С температуры D KCl А HNO3 B NaOH С H2S D оксиды А кислоты B соли С щелочи D Д.И.Менделеев А С.Аррениус B М.В.Ломоносов С М.Фарадей D
Русецкая О.П. Электролитическая диссоциация 7. Проверка знаний Русецкая О.П. Электролитическая диссоциация в растворах – это процесс распада электролита на __________ . Вопрос 1 Русецкая О.П. Электролитическая диссоциация электролитов в растворах протекает под действием __________ . Вопрос 2 Русецкая О.П. Слабым электролитом является _______ . Вопрос 3 Русецкая О.П. Электролитами не являются ________ . Вопрос 4 Русецкая О.П. Основные положения электролитической диссоциации сформулировал ученый ______. Вопрос 5 А B С D атомы А ионы B молекулы С электроны D электрического тока А катализатора B молекул растворителя С температуры D KCl А HNO3 B NaOH С H2S D оксиды А кислоты B соли С щелочи D Д.И.Менделеев А С.Аррениус B М.В.Ломоносов С М.Фарадей D
Cлайд 18
 Литература Баженов А.А. Мастер-класс «Создание презентаций к урокам химии». Сеть творческих учителей. http://www.it-ru/communities.aspx?cat_no=75761&tmpl=com Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 кл. – М.: Просвещение, 2008. Мартыненко Б.В. Химия: кислоты и основания. – М.: Просвещение, 2000. Слета Л.А. Химия: Справочник. – Харьков: Фолио, 1997. Егоров А.С. Химия. Пособие –репетитор для поступающих в вузы. – Ростов н/Д: изд-во Феникс, 2006. Гаршин А.П.Неорганическая химия. – СПб.: изд-во «Лань», 2000. http://www.alhimik.ru/kunst/man's_elem.html Благодарю за внимание!
Литература Баженов А.А. Мастер-класс «Создание презентаций к урокам химии». Сеть творческих учителей. http://www.it-ru/communities.aspx?cat_no=75761&tmpl=com Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 кл. – М.: Просвещение, 2008. Мартыненко Б.В. Химия: кислоты и основания. – М.: Просвещение, 2000. Слета Л.А. Химия: Справочник. – Харьков: Фолио, 1997. Егоров А.С. Химия. Пособие –репетитор для поступающих в вузы. – Ростов н/Д: изд-во Феникс, 2006. Гаршин А.П.Неорганическая химия. – СПб.: изд-во «Лань», 2000. http://www.alhimik.ru/kunst/man's_elem.html Благодарю за внимание!