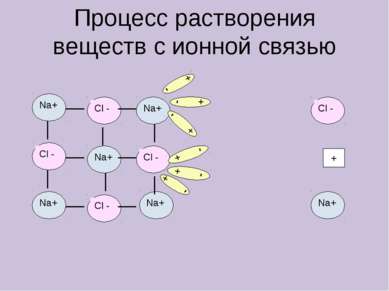
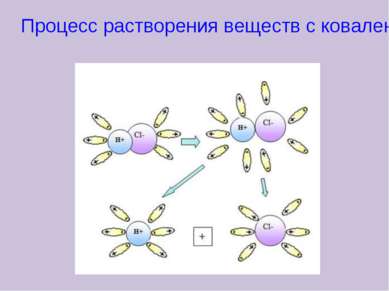
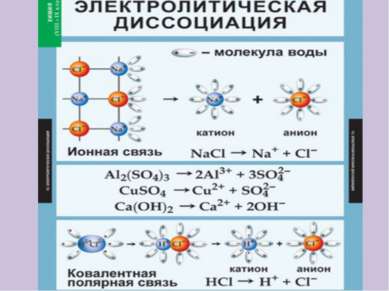
X
Код презентации скопируйте его
Электролитическая диссоциация. Электролиты и неэлектролиты
Скачать эту презентациюПрезентация на тему Электролитическая диссоциация. Электролиты и неэлектролиты
Скачать эту презентациюCлайд 2
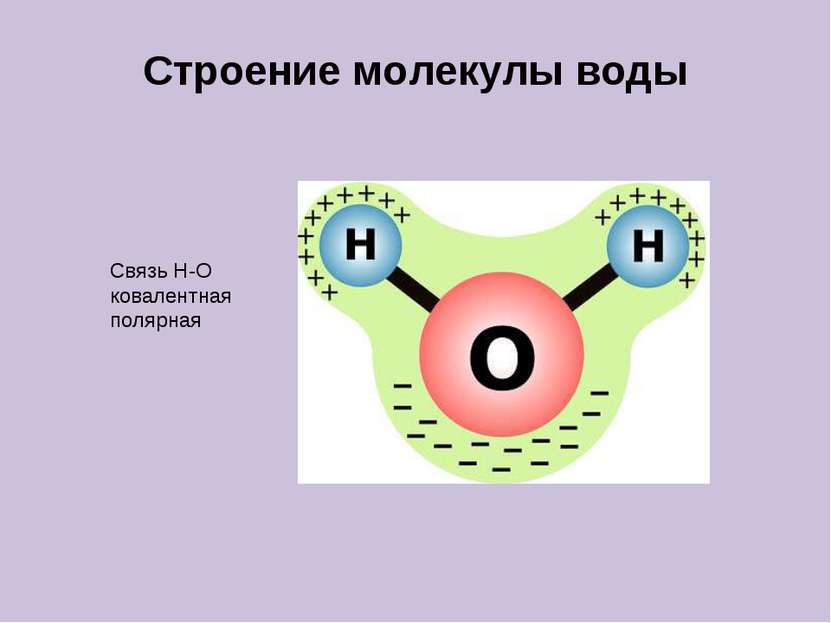
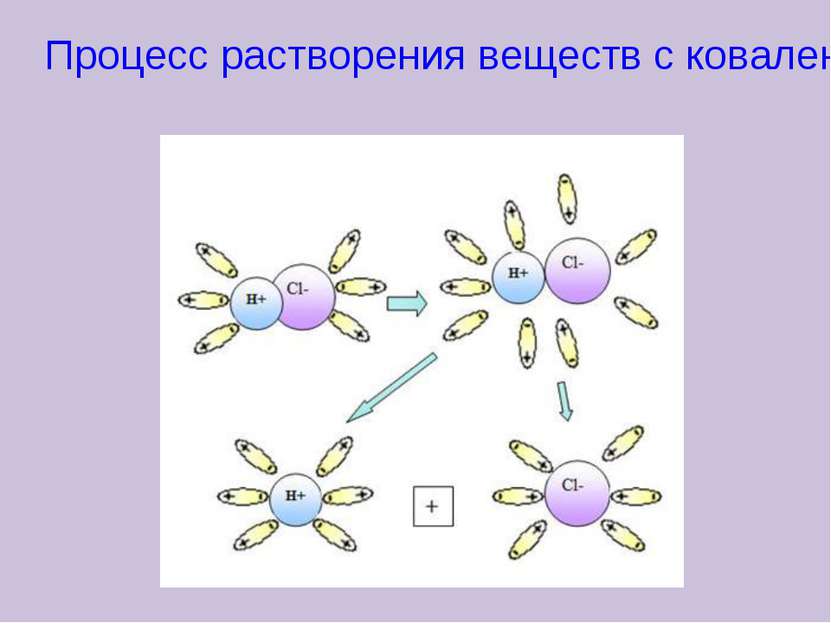
 Тест 1. Выберите вещество с ковалентной неполярной связью: А) NaCl; б) О2; в) AlCl3; г) H2O 2. Выберите вещество с ионной связью: А) BaCl2; б) Н2; в) Mg; г) СН4 3. Выберите вещество с ковалентной полярной связью: А) KF; б) Br2; в)Na2S; г) NH3 4. Какой тип кристаллической решётки у воды: А) ионная; Б) атомная; В) молекулярная; Г) металлическая 5. Твёрдость, высокая температура плавления, хорошая растворимость в воде характерна для веществ с : А) ионная; Б) атомная; В) молекулярная;
Тест 1. Выберите вещество с ковалентной неполярной связью: А) NaCl; б) О2; в) AlCl3; г) H2O 2. Выберите вещество с ионной связью: А) BaCl2; б) Н2; в) Mg; г) СН4 3. Выберите вещество с ковалентной полярной связью: А) KF; б) Br2; в)Na2S; г) NH3 4. Какой тип кристаллической решётки у воды: А) ионная; Б) атомная; В) молекулярная; Г) металлическая 5. Твёрдость, высокая температура плавления, хорошая растворимость в воде характерна для веществ с : А) ионная; Б) атомная; В) молекулярная;
Cлайд 3
 НАЗВАНИЕ ВЕЩЕСТВА НАБЛЮДЕНИЯ ОБЪЯСНЕНИЯ 1. NaCl, крист. 2. Сахар (С12Н22О11), крист 3. Вода дист. 4. NaCl, раствор 5. Сахар, раствор
НАЗВАНИЕ ВЕЩЕСТВА НАБЛЮДЕНИЯ ОБЪЯСНЕНИЯ 1. NaCl, крист. 2. Сахар (С12Н22О11), крист 3. Вода дист. 4. NaCl, раствор 5. Сахар, раствор
Cлайд 10
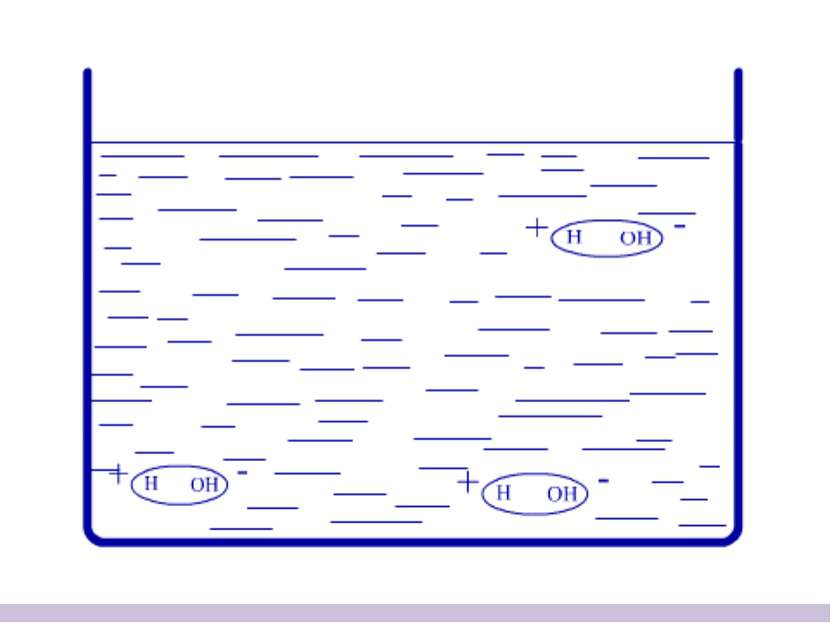
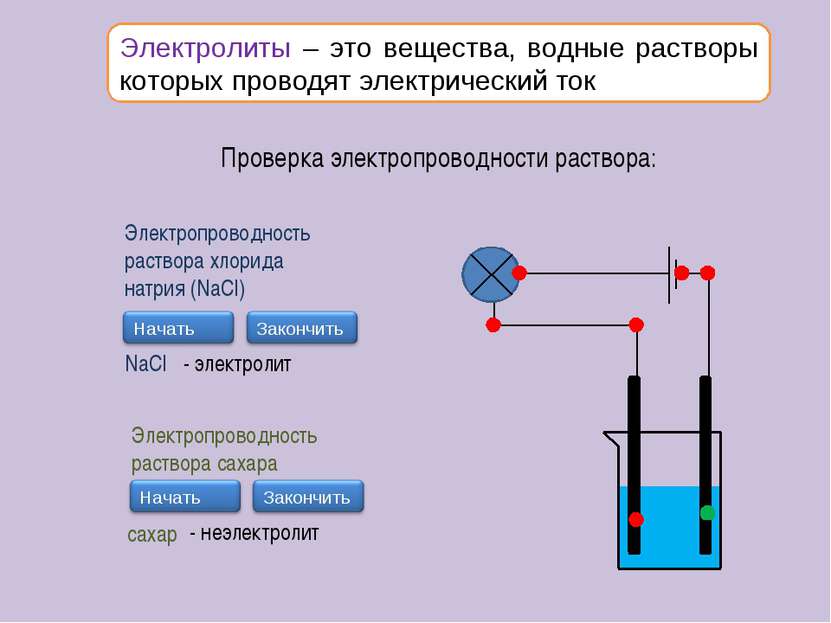
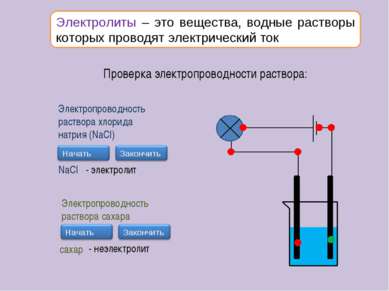 Электролиты – это вещества, водные растворы которых проводят электрический ток Проверка электропроводности раствора: Электропроводность раствора хлорида натрия (NaCl) NaCl - электролит Электропроводность раствора сахара сахар - неэлектролит
Электролиты – это вещества, водные растворы которых проводят электрический ток Проверка электропроводности раствора: Электропроводность раствора хлорида натрия (NaCl) NaCl - электролит Электропроводность раствора сахара сахар - неэлектролит
Cлайд 11
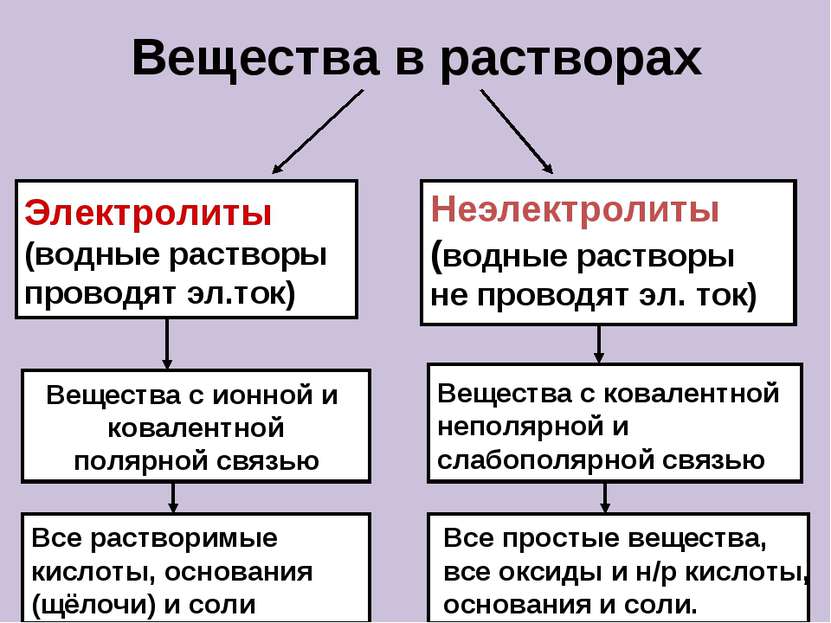
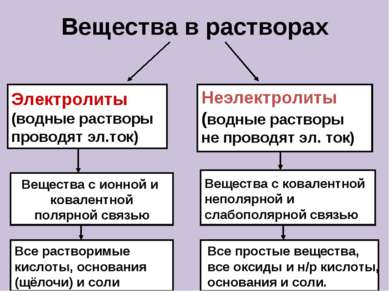 Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества с ионной и ковалентной полярной связью Вещества с ковалентной неполярной и слабополярной связью Все растворимые кислоты, основания (щёлочи) и соли Все простые вещества, все оксиды и н/р кислоты, основания и соли.
Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества с ионной и ковалентной полярной связью Вещества с ковалентной неполярной и слабополярной связью Все растворимые кислоты, основания (щёлочи) и соли Все простые вещества, все оксиды и н/р кислоты, основания и соли.
Cлайд 12
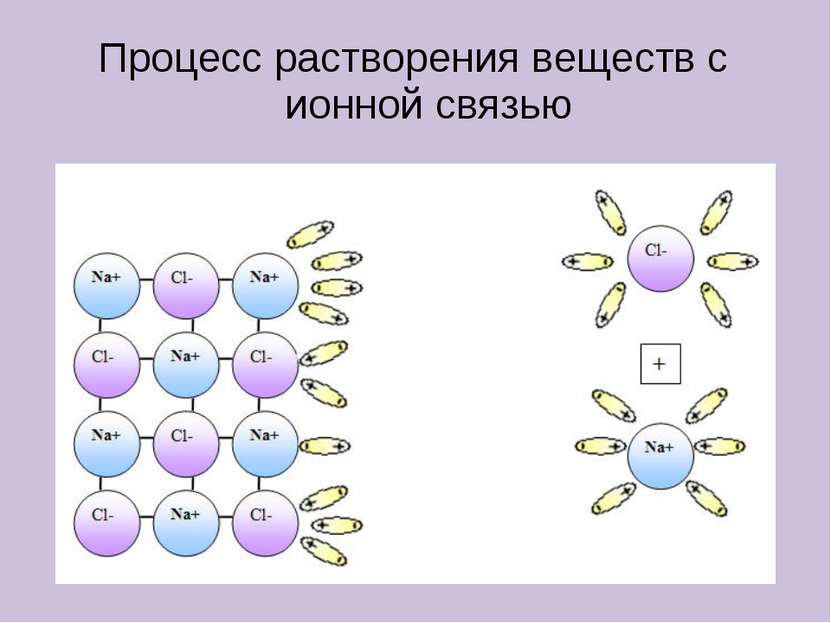
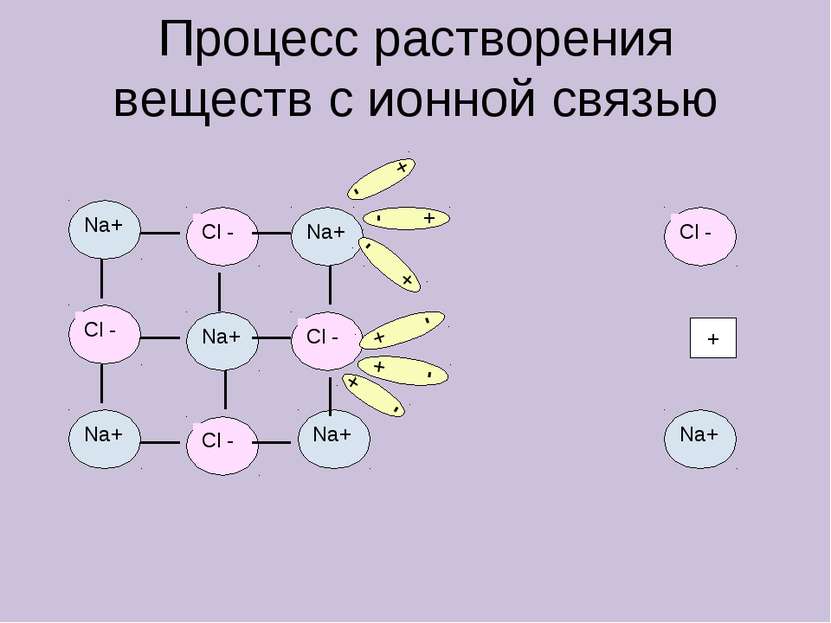
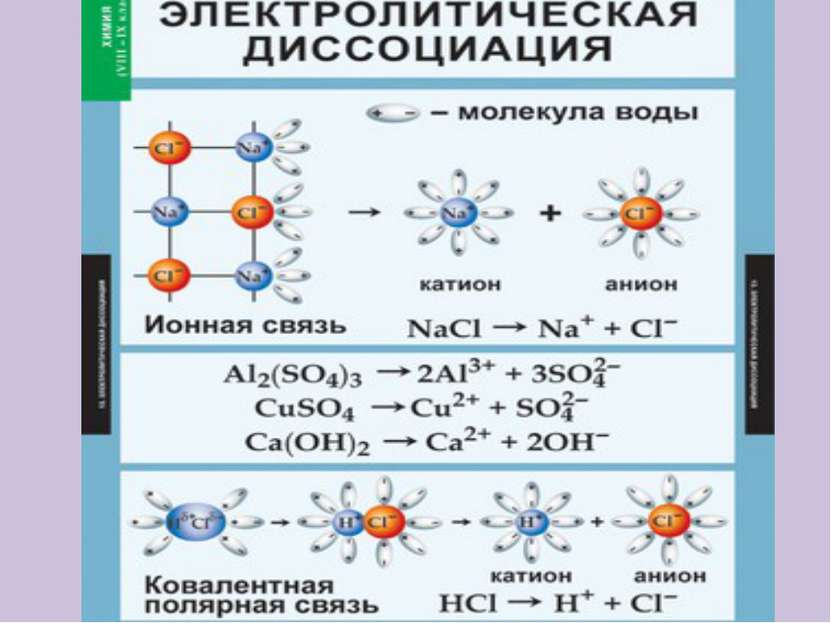
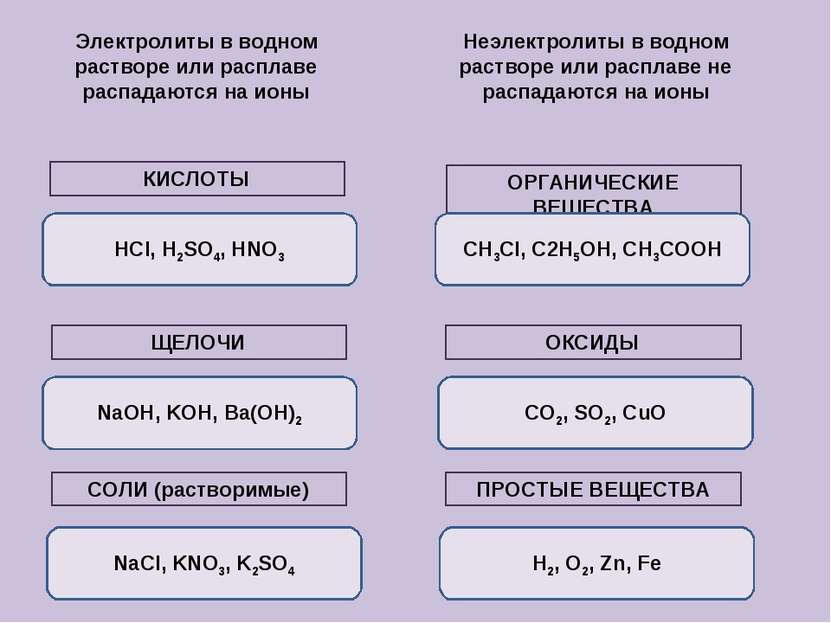
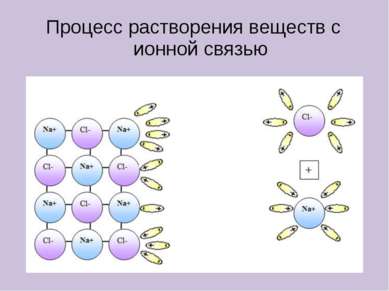
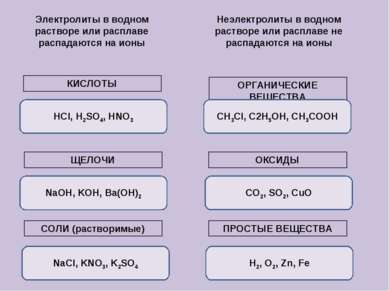 Электролиты в водном растворе или расплаве распадаются на ионы Неэлектролиты в водном растворе или расплаве не распадаются на ионы КИСЛОТЫ ЩЕЛОЧИ СОЛИ (растворимые) ОРГАНИЧЕСКИЕ ВЕЩЕСТВА ОКСИДЫ ПРОСТЫЕ ВЕЩЕСТВА HCl, H2SO4, HNO3 NaOH, KOH, Ba(OH)2 NaCl, KNO3, K2SO4 CH3Cl, C2H5OH, CH3COOH H2, O2, Zn, Fe CO2, SO2, CuO
Электролиты в водном растворе или расплаве распадаются на ионы Неэлектролиты в водном растворе или расплаве не распадаются на ионы КИСЛОТЫ ЩЕЛОЧИ СОЛИ (растворимые) ОРГАНИЧЕСКИЕ ВЕЩЕСТВА ОКСИДЫ ПРОСТЫЕ ВЕЩЕСТВА HCl, H2SO4, HNO3 NaOH, KOH, Ba(OH)2 NaCl, KNO3, K2SO4 CH3Cl, C2H5OH, CH3COOH H2, O2, Zn, Fe CO2, SO2, CuO
Cлайд 13
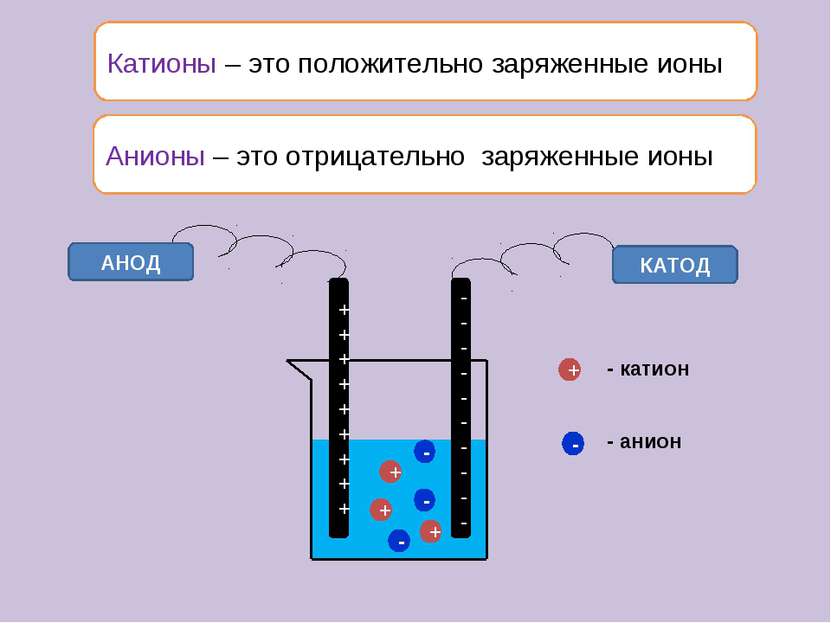
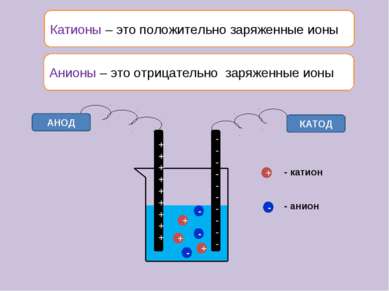 Катионы – это положительно заряженные ионы АНОД КАТОД + + + - - - + - - катион - анион Анионы – это отрицательно заряженные ионы
Катионы – это положительно заряженные ионы АНОД КАТОД + + + - - - + - - катион - анион Анионы – это отрицательно заряженные ионы
Cлайд 14
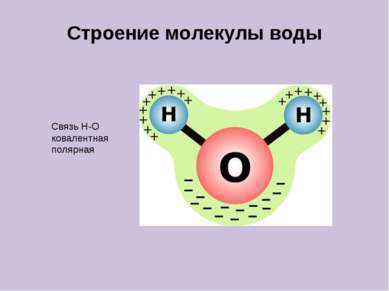
 Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные ( в безводных средах) По составу: простые и сложные.
Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные ( в безводных средах) По составу: простые и сложные.
Cлайд 15
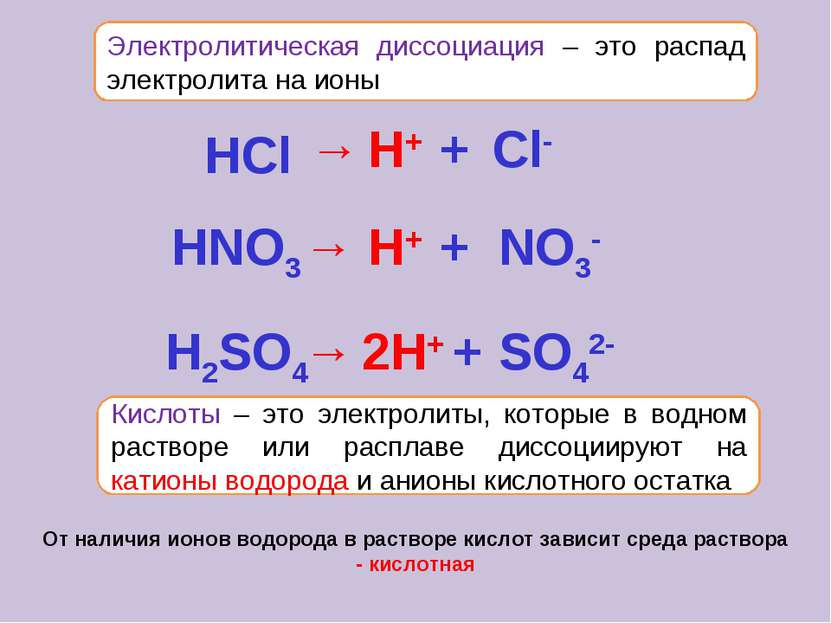
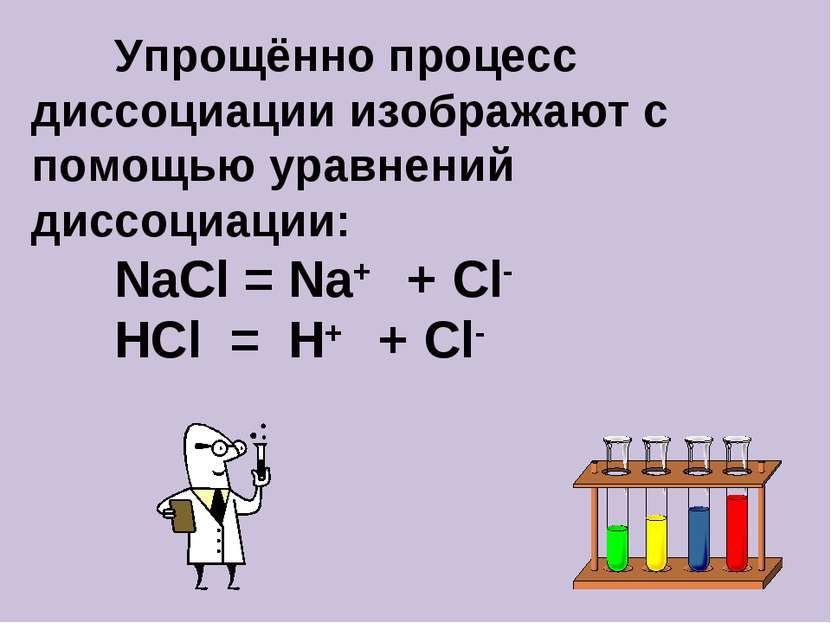
 Электролитическая диссоциация – это распад электролита на ионы Кислоты – это электролиты, которые в водном растворе или расплаве диссоциируют на катионы водорода и анионы кислотного остатка От наличия ионов водорода в растворе кислот зависит среда раствора - кислотная
Электролитическая диссоциация – это распад электролита на ионы Кислоты – это электролиты, которые в водном растворе или расплаве диссоциируют на катионы водорода и анионы кислотного остатка От наличия ионов водорода в растворе кислот зависит среда раствора - кислотная
Cлайд 16
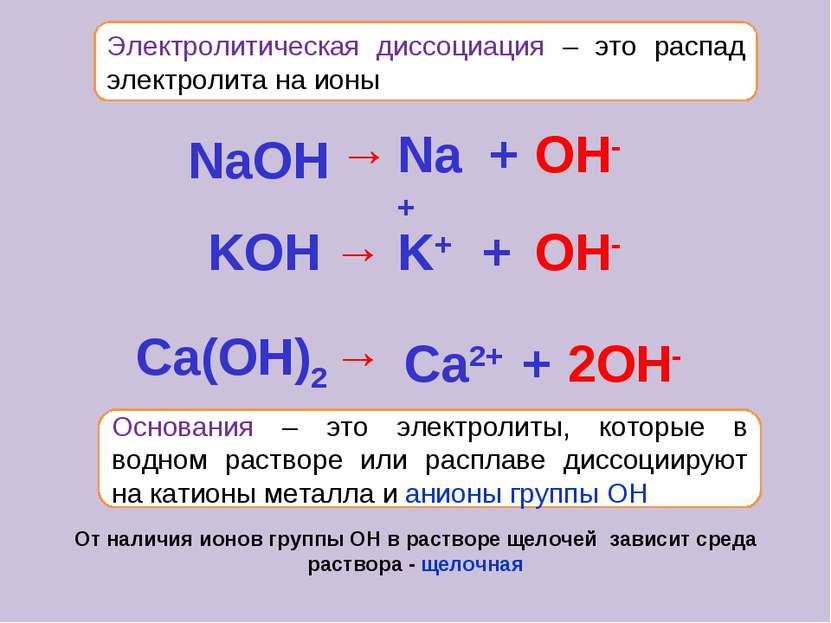
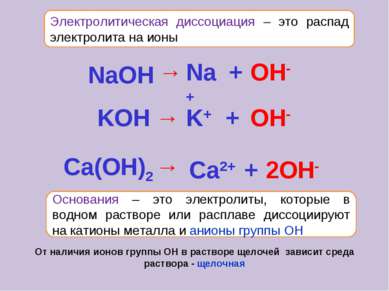 Электролитическая диссоциация – это распад электролита на ионы Основания – это электролиты, которые в водном растворе или расплаве диссоциируют на катионы металла и анионы группы ОН От наличия ионов группы ОН в растворе щелочей зависит среда раствора - щелочная
Электролитическая диссоциация – это распад электролита на ионы Основания – это электролиты, которые в водном растворе или расплаве диссоциируют на катионы металла и анионы группы ОН От наличия ионов группы ОН в растворе щелочей зависит среда раствора - щелочная
Cлайд 17
 Электролитическая диссоциация – это распад электролита на ионы Соли – это электролиты, которые в водном растворе или расплаве диссоциируют на катионы металла и анионы кислотного остатка
Электролитическая диссоциация – это распад электролита на ионы Соли – это электролиты, которые в водном растворе или расплаве диссоциируют на катионы металла и анионы кислотного остатка