X
Код презентации скопируйте его
Электролитическая диссоциация (обобщение знаний)
Скачать эту презентациюПрезентация на тему Электролитическая диссоциация (обобщение знаний)
Скачать эту презентациюCлайд 1
 Тема урока: обобщение знаний по теме «Электролитическая диссоциация» Этапы урока: 1) Цели и задачи урока, запись д/з. 2) Фронтальная работа по воспроизведению основных понятий темы. 3) Работа по выполнению практических заданий. *
Тема урока: обобщение знаний по теме «Электролитическая диссоциация» Этапы урока: 1) Цели и задачи урока, запись д/з. 2) Фронтальная работа по воспроизведению основных понятий темы. 3) Работа по выполнению практических заданий. *
Cлайд 2
 Электролитическая диссоциация – это процесс распада электролитов на ионы при их растворении в воде или расплавлении. Электролит – это вещество, диссоциирующее на ионы при растворении в воде или расплавлении и проводящее электрический ток. Неэлектролит - это вещество, не диссоциирующее на ионы при растворении в воде или расплавлении и не проводящее электрический ток. Степень диссоциации –это отношение числа распавшихся на ионы молекул к общему числу растворённых молекул вещества. *
Электролитическая диссоциация – это процесс распада электролитов на ионы при их растворении в воде или расплавлении. Электролит – это вещество, диссоциирующее на ионы при растворении в воде или расплавлении и проводящее электрический ток. Неэлектролит - это вещество, не диссоциирующее на ионы при растворении в воде или расплавлении и не проводящее электрический ток. Степень диссоциации –это отношение числа распавшихся на ионы молекул к общему числу растворённых молекул вещества. *
Cлайд 3
 Слабый электролит – это вещество, частично диссоциирующее на ионы и плохо проводящее электрический ток. Сильный электролит – это вещество, полностью диссоциирующее на ионы и хорошо проводящее электрический ток. Кислота – это электролит, диссоциирующий на катионы водорода и анионы кислотных остатков. Основание - это электролит, диссоциирующий на катионы металла и анионы гидроксо-групп. Соль - это электролит, диссоциирующий на катионы металла и анионы кислотных остатков. *
Слабый электролит – это вещество, частично диссоциирующее на ионы и плохо проводящее электрический ток. Сильный электролит – это вещество, полностью диссоциирующее на ионы и хорошо проводящее электрический ток. Кислота – это электролит, диссоциирующий на катионы водорода и анионы кислотных остатков. Основание - это электролит, диссоциирующий на катионы металла и анионы гидроксо-групп. Соль - это электролит, диссоциирующий на катионы металла и анионы кислотных остатков. *
Cлайд 4
 Реакция ионного обмена – это реакция между элетролитами в растворе. Катион – это положительно заряженный ион. Анион – это отрицательно заряженный ион. Гидролиз – это взаимодействие солей с водой, приводящее к образованию слабого электролита. *
Реакция ионного обмена – это реакция между элетролитами в растворе. Катион – это положительно заряженный ион. Анион – это отрицательно заряженный ион. Гидролиз – это взаимодействие солей с водой, приводящее к образованию слабого электролита. *
Cлайд 5
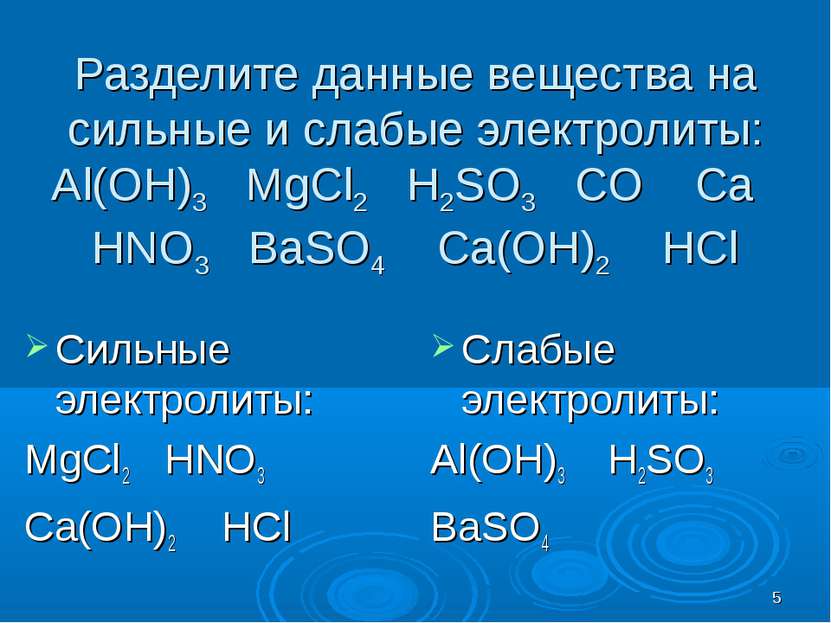
 Разделите данные вещества на сильные и слабые электролиты: Al(OH)3 MgCl2 H2SO3 CO Ca HNO3 BaSO4 Ca(OH)2 HCl Сильные электролиты: MgCl2 HNO3 Ca(OH)2 HCl Слабые электролиты: Al(OH)3 H2SO3 BaSO4 *
Разделите данные вещества на сильные и слабые электролиты: Al(OH)3 MgCl2 H2SO3 CO Ca HNO3 BaSO4 Ca(OH)2 HCl Сильные электролиты: MgCl2 HNO3 Ca(OH)2 HCl Слабые электролиты: Al(OH)3 H2SO3 BaSO4 *
Cлайд 6
 Закончите молекулярные уравнения, составьте ионные: Zn(NO3)2 + HCl = NaOH + CaO = K2CO3 + H2SO4 = *
Закончите молекулярные уравнения, составьте ионные: Zn(NO3)2 + HCl = NaOH + CaO = K2CO3 + H2SO4 = *