X
Код презентации скопируйте его
Соли угольной кислоты
Скачать эту презентациюПрезентация на тему Соли угольной кислоты
Скачать эту презентациюCлайд 2
 Na2CO3 –карбонат натрия NaHCO3 -гидрокарбонат натрия CaCO3 -карбонат кальция Ca(HCO3)2 –гидрокарбонат кальция
Na2CO3 –карбонат натрия NaHCO3 -гидрокарбонат натрия CaCO3 -карбонат кальция Ca(HCO3)2 –гидрокарбонат кальция
Cлайд 3
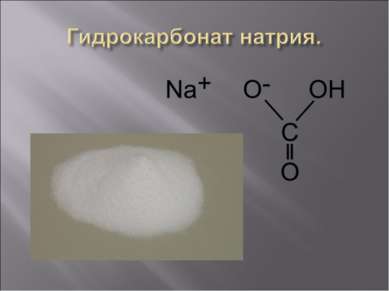
 Карбона т на трия — химическое соединение Na2CO3, натриевая соль угольной кислоты. Карбонат натрия представляет собой бесцветный кристаллический порошок.
Карбона т на трия — химическое соединение Na2CO3, натриевая соль угольной кислоты. Карбонат натрия представляет собой бесцветный кристаллический порошок.
Cлайд 4
 Способ 1. Способ Леблана. Уголь восстанавливает сульфат натрия до сульфида: Na2SO4 + 2C → Na2S + 2CO2↑. Сульфид натрия реагирует с карбонатом кальция: Na2S + СаСО3 → Na2CO3 + CaS.
Способ 1. Способ Леблана. Уголь восстанавливает сульфат натрия до сульфида: Na2SO4 + 2C → Na2S + 2CO2↑. Сульфид натрия реагирует с карбонатом кальция: Na2S + СаСО3 → Na2CO3 + CaS.
Cлайд 5
 Способ 2. Промышленный аммиачный способ (способ Сольве). NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
Способ 2. Промышленный аммиачный способ (способ Сольве). NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl 2NaHCO3 →(t) Na2CO3 + CO2↑ + H2O 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
Cлайд 6
 Способ 3. Способ Хоу. Отличается от процесса Леблана тем, что не использует карбонат кальция.
Способ 3. Способ Хоу. Отличается от процесса Леблана тем, что не использует карбонат кальция.
Cлайд 9
 Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду: NaHCO3 + HCl → NaCl + H2CO3 H2CO3 → H2O + CO2↑ В быту чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия: NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду: NaHCO3 + HCl → NaCl + H2CO3 H2CO3 → H2O + CO2↑ В быту чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия: NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Cлайд 10
 Карбонат кальция (мел, углекислый кальций, известняк) — неорганическое химическое соединение, соль угольной кислоты и кальция. В природе встречается в виде минералов — кальцита, арагонита и ватерита. Карбонат кальция является главной составной частью известняка, мела и мрамора. Нерастворим в воде и этаноле. Зарегистрирован как белый пищевой краситель (E170).
Карбонат кальция (мел, углекислый кальций, известняк) — неорганическое химическое соединение, соль угольной кислоты и кальция. В природе встречается в виде минералов — кальцита, арагонита и ватерита. Карбонат кальция является главной составной частью известняка, мела и мрамора. Нерастворим в воде и этаноле. Зарегистрирован как белый пищевой краситель (E170).
Cлайд 12
 При нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO. В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2.
При нагревании до 900−1000 °C расщепляется на кислотный оксид — углекислый газ CO2 и оксид — негашёную известь CaO. В воде с углекислым газом растворяется, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2.