X
Код презентации скопируйте его
Азотная кислота и ее соли (9 класс)
Скачать эту презентациюПрезентация на тему Азотная кислота и ее соли (9 класс)
Скачать эту презентациюCлайд 1
 «Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью» Л. Н. Толстой
«Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью» Л. Н. Толстой
Cлайд 2
 Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей - Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит. Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1 Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола) - Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».
Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей - Благодаря этому веществу русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит. Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1 Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола) - Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1-ого объёма этого вещества и 3-ёх объёмов соляной кислоты, называется «царской водкой».
Cлайд 3
 Её величество Азотная кислота Яконюк Вера Сергеевна учитель химии МОУ Знаменская СОШ Урок химии 9класс
Её величество Азотная кислота Яконюк Вера Сергеевна учитель химии МОУ Знаменская СОШ Урок химии 9класс
Cлайд 4
 СОДЕРЖАНИЕ: Историческая справка Строение Получение.Лабороторный способ Промышленный способ Физические свойства Химические свойства.Общие с другими кислотами Химические свойства.Специфические Таблица Применение
СОДЕРЖАНИЕ: Историческая справка Строение Получение.Лабороторный способ Промышленный способ Физические свойства Химические свойства.Общие с другими кислотами Химические свойства.Специфические Таблица Применение
Cлайд 5
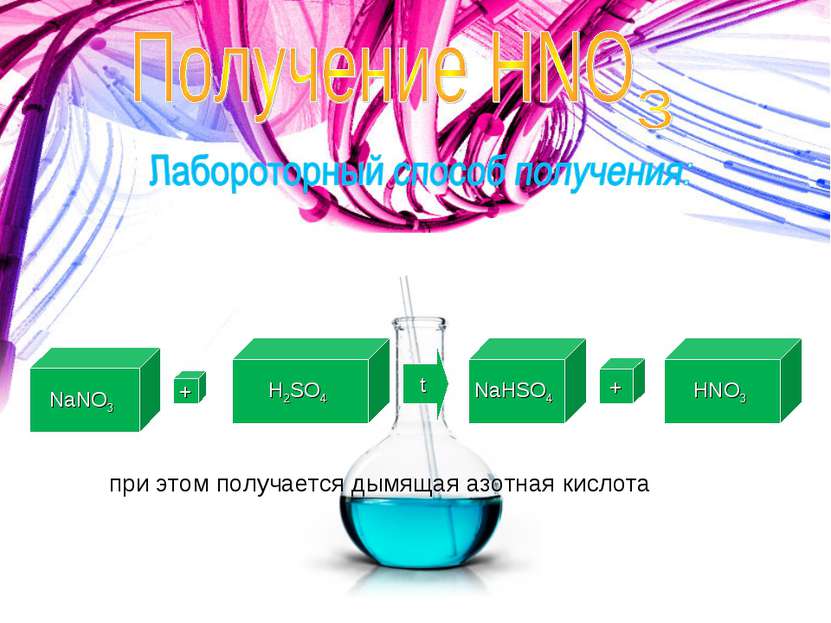
 Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой: KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑ Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды Историческая справка
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой: KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑ Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды Историческая справка
Cлайд 6
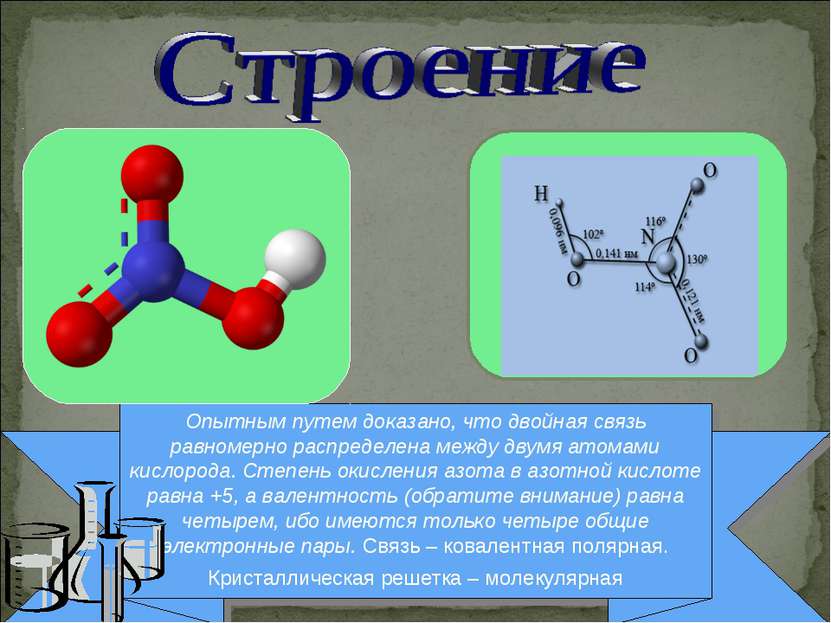
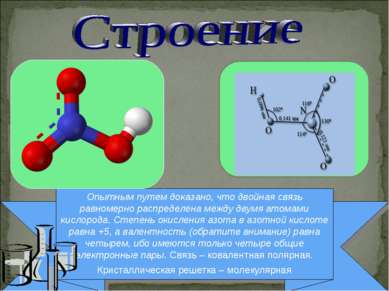 Опытным путем доказано, что двойная связь равномерно распределена между двумя атомами кислорода. Степень окисления азота в азотной кислоте равна +5, а валентность (обратите внимание) равна четырем, ибо имеются только четыре общие электронные пары. Связь – ковалентная полярная. Кристаллическая решетка – молекулярная
Опытным путем доказано, что двойная связь равномерно распределена между двумя атомами кислорода. Степень окисления азота в азотной кислоте равна +5, а валентность (обратите внимание) равна четырем, ибо имеются только четыре общие электронные пары. Связь – ковалентная полярная. Кристаллическая решетка – молекулярная
Cлайд 8
 1. Окисления аммиaка в NO в присутствии платино-родиевого катализатора: 4NH3 + 5O2 = 4NO + 6H2O 3. Поглощения NO2 водой в присутствии кислорода: 4NO2 + 2H2O + O2= 4HNO3 Массовая доля HNO3 составляет около 60% 2. Окисления NO в NO2 на холоду под давлением (10 ат): 2NO + O2 = 2NO2
1. Окисления аммиaка в NO в присутствии платино-родиевого катализатора: 4NH3 + 5O2 = 4NO + 6H2O 3. Поглощения NO2 водой в присутствии кислорода: 4NO2 + 2H2O + O2= 4HNO3 Массовая доля HNO3 составляет около 60% 2. Окисления NO в NO2 на холоду под давлением (10 ат): 2NO + O2 = 2NO2
Cлайд 9
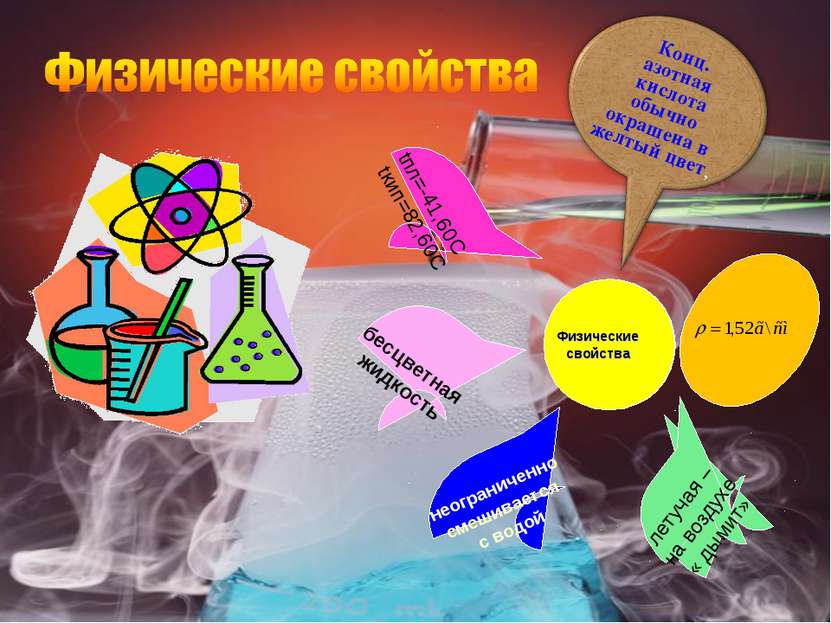
 Физические свойства бесцветная жидкость tпл=-41,60C tкип=82,60C неограниченно смешивается с водой летучая – на воздухе « дымит»
Физические свойства бесцветная жидкость tпл=-41,60C tкип=82,60C неограниченно смешивается с водой летучая – на воздухе « дымит»
Cлайд 11
 Группа №1 CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая CuO + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + H2O CuO + 2H+ = Cu2+ + H2O Группа №2 CuCl2 + 2 NaOH = Cu(OH)2↓ + 2 NaCl (получение нерастворимого основания) Cu(OH)2 ↓+ 2 HNO3 = Cu(NO3)2 + 2 H2O - реакция ионного обмена, необратимая Cu(OH)2 ↓ + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + 2 H2O Cu(OH)2↓ + 2H+ = Cu2+ + 2 H2O Признак реакции – растворение голубого осадка Cu(OH)2 Группа №3 2 HNO3 + Na2CO3 = 2 NaNO3 + H2O + CO2 ↑ - реакция ионного обмена, необратимая 2 H+ + 2NO3- + 2 Na+ + CO3 2- = 2 Na+ +NO3- + H2O + CO2↑ 2 H+ + CO3 2- = H2O + CO2 ↑ Признак реакции – характерное «вскипание».
Группа №1 CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая CuO + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + H2O CuO + 2H+ = Cu2+ + H2O Группа №2 CuCl2 + 2 NaOH = Cu(OH)2↓ + 2 NaCl (получение нерастворимого основания) Cu(OH)2 ↓+ 2 HNO3 = Cu(NO3)2 + 2 H2O - реакция ионного обмена, необратимая Cu(OH)2 ↓ + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + 2 H2O Cu(OH)2↓ + 2H+ = Cu2+ + 2 H2O Признак реакции – растворение голубого осадка Cu(OH)2 Группа №3 2 HNO3 + Na2CO3 = 2 NaNO3 + H2O + CO2 ↑ - реакция ионного обмена, необратимая 2 H+ + 2NO3- + 2 Na+ + CO3 2- = 2 Na+ +NO3- + H2O + CO2↑ 2 H+ + CO3 2- = H2O + CO2 ↑ Признак реакции – характерное «вскипание».
Cлайд 14
 Взаимодействие азотной кислоты с металлами изучено довольно хорошо, т.к. конц. HNO3 используется в качестве окислителя ракетного топлива. Смысл заключается в том, что продукты реакции зависят от двух факторов: 1) концентрация азотной кислоты; 2) активность металла Комбинацией этих двух параметров и определяется состав продуктов реакции. Что может быть? а) металл может вступать в реакцию, а может не вступать (не реагировать вообще, пассивироваться); б) состав газов смешанный (как правило выделяется не один газообразный продукт, а смесь газов, иногда какой-то газ преобладает над другими); в) обычно водород в этих процессах не выделяется (есть исключение, когда на практике доказывается, что Mn + разб. HNO3 действительно выделяется газ водород) Главное правило: Чем активнее металл и чем разбавленнее азотная кислота, тем глубже идёт восстановление азотной кислоты (крайний вариант - восстановление до амммиака NH3, точнее до NH4NO3 ; здесь процесс воссстановления N{+5} + 8e ----> N{-3} ). Возможны промежуточные варианты восстановления до NO2, NO, N2O, N2 Общая схема процесса: HNO3 + Me ---> соль азотной кислоты (нитрат) + продукт восстановления азотной кислоты + H2O
Взаимодействие азотной кислоты с металлами изучено довольно хорошо, т.к. конц. HNO3 используется в качестве окислителя ракетного топлива. Смысл заключается в том, что продукты реакции зависят от двух факторов: 1) концентрация азотной кислоты; 2) активность металла Комбинацией этих двух параметров и определяется состав продуктов реакции. Что может быть? а) металл может вступать в реакцию, а может не вступать (не реагировать вообще, пассивироваться); б) состав газов смешанный (как правило выделяется не один газообразный продукт, а смесь газов, иногда какой-то газ преобладает над другими); в) обычно водород в этих процессах не выделяется (есть исключение, когда на практике доказывается, что Mn + разб. HNO3 действительно выделяется газ водород) Главное правило: Чем активнее металл и чем разбавленнее азотная кислота, тем глубже идёт восстановление азотной кислоты (крайний вариант - восстановление до амммиака NH3, точнее до NH4NO3 ; здесь процесс воссстановления N{+5} + 8e ----> N{-3} ). Возможны промежуточные варианты восстановления до NO2, NO, N2O, N2 Общая схема процесса: HNO3 + Me ---> соль азотной кислоты (нитрат) + продукт восстановления азотной кислоты + H2O
Cлайд 15
 Взаимодействие с металлами: При взаимодействии с металлами образуются нитрат, вода и третий продукт по схеме: HNO3(р.)+Me(до H2)→нитрат+H2O+NH3(NH4NO3) HNO3(р.)+Me(после H2)→нитрат+H2O+NO HNO3(к.)+Me(до H2)→нитрат+H2O+N2O(N2) HNO3(к.)+Me(после H2)→нитрат+H2O+NO2 Концентрированная HNO3 на Al, Cr, Fe,Au, Pt не действует.
Взаимодействие с металлами: При взаимодействии с металлами образуются нитрат, вода и третий продукт по схеме: HNO3(р.)+Me(до H2)→нитрат+H2O+NH3(NH4NO3) HNO3(р.)+Me(после H2)→нитрат+H2O+NO HNO3(к.)+Me(до H2)→нитрат+H2O+N2O(N2) HNO3(к.)+Me(после H2)→нитрат+H2O+NO2 Концентрированная HNO3 на Al, Cr, Fe,Au, Pt не действует.
Cлайд 16
 P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 < 30% на холоде: железо, хром, алюминий пассивирует Взаимодействие с металлами Активные металлы Li Na …….Zn Металлы средней активности Cr………..Sn Металлы малоактивные и неактивные Pb…...........Ag Благородные металлы Au Pt Os Ir Конц HNO3 Раз HNO3 очень раз HNO3 концHNO3 разHNO3 очень Раз HNO3 концHNO разHNO3 Раств. только в царской водке-смеси 3об.HCl B 1об. HNO3 NO NO2 N2O или N2, NO2 NH3 (NHNO3) Не реагируют NO2, ,NO,N2O,NH3 NO2, ,NO, N2O, NH3 NO2 NO
P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 < 30% на холоде: железо, хром, алюминий пассивирует Взаимодействие с металлами Активные металлы Li Na …….Zn Металлы средней активности Cr………..Sn Металлы малоактивные и неактивные Pb…...........Ag Благородные металлы Au Pt Os Ir Конц HNO3 Раз HNO3 очень раз HNO3 концHNO3 разHNO3 очень Раз HNO3 концHNO разHNO3 Раств. только в царской водке-смеси 3об.HCl B 1об. HNO3 NO NO2 N2O или N2, NO2 NH3 (NHNO3) Не реагируют NO2, ,NO,N2O,NH3 NO2, ,NO, N2O, NH3 NO2 NO
Cлайд 17
 - производство азотных и комбинированных удобрений, -взрывчатых веществ (тринитротолуола и др.), -органических красителей. -как окислитель ракетного топлива. - В металлургии Азотная кислота применяют для травления и растворения металлов, а также для разделения золота и серебра.
- производство азотных и комбинированных удобрений, -взрывчатых веществ (тринитротолуола и др.), -органических красителей. -как окислитель ракетного топлива. - В металлургии Азотная кислота применяют для травления и растворения металлов, а также для разделения золота и серебра.
Cлайд 18
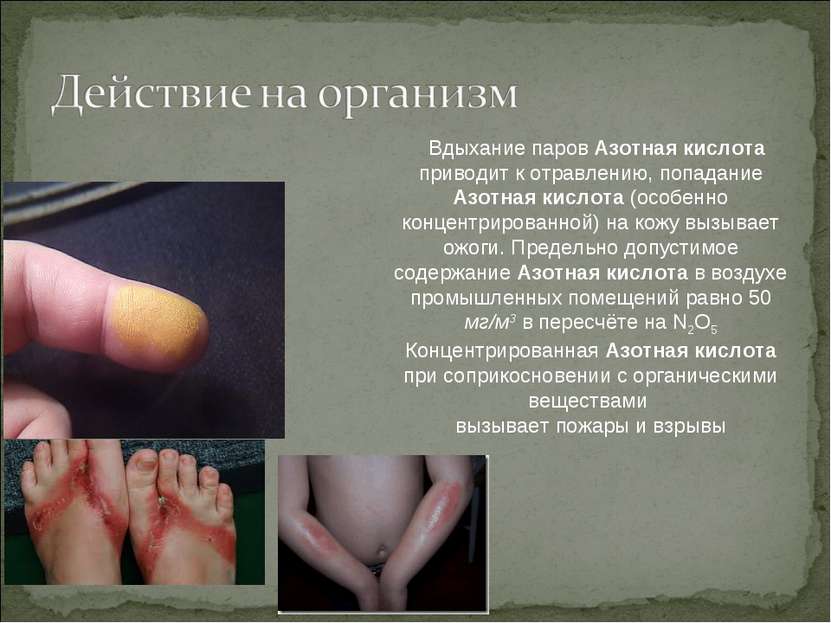
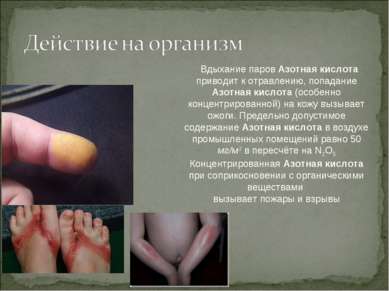 Вдыхание паров Азотная кислота приводит к отравлению, попадание Азотная кислота (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание Азотная кислота в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5 Концентрированная Азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы
Вдыхание паров Азотная кислота приводит к отравлению, попадание Азотная кислота (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание Азотная кислота в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5 Концентрированная Азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы
Cлайд 19
 Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4 При хранении на свету HNO3 а) краснеет б) желтеет в) остается бесцветной При взаимодействии с металлами азотная кислота является: а)окислителем, б)восстановителем, в)и тем, и другим. Азотная кислота в растворе не реагирует с веществом, формула которого: а) CO2 ; б) NaOH; в) Al(OH)3 ; г) NH3 . Царская водка- это а)концентрированный спирт б)3 объема HCl и 1 объем HNO3 в) концентрированная азотная кислота
Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4 При хранении на свету HNO3 а) краснеет б) желтеет в) остается бесцветной При взаимодействии с металлами азотная кислота является: а)окислителем, б)восстановителем, в)и тем, и другим. Азотная кислота в растворе не реагирует с веществом, формула которого: а) CO2 ; б) NaOH; в) Al(OH)3 ; г) NH3 . Царская водка- это а)концентрированный спирт б)3 объема HCl и 1 объем HNO3 в) концентрированная азотная кислота
Cлайд 21
 1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами, солями более слабых кислот обусловленные наличием в молекулах иона Н+; 2. Сильные окислительные свойства азотной кислоты обусловлены строением ее молекулы; При ее взаимодействии с металлами никогда не образуется водород, а образуются нитраты, оксиды азота или другие его соединения (азот, нитрат аммония) и вода в зависимости от концентрации кислоты и активности металла; 3. Сильные окислительные способности HNO3 широко применяются для получения различных важных продуктов народного хозяйства (удобрения, лекарства, пластики и т.д.)
1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами, солями более слабых кислот обусловленные наличием в молекулах иона Н+; 2. Сильные окислительные свойства азотной кислоты обусловлены строением ее молекулы; При ее взаимодействии с металлами никогда не образуется водород, а образуются нитраты, оксиды азота или другие его соединения (азот, нитрат аммония) и вода в зависимости от концентрации кислоты и активности металла; 3. Сильные окислительные способности HNO3 широко применяются для получения различных важных продуктов народного хозяйства (удобрения, лекарства, пластики и т.д.)
Cлайд 22
 §26 упр 4,5 Творческое задание –презентация история открытия азотной кислоты. Применение азотной кислоты
§26 упр 4,5 Творческое задание –презентация история открытия азотной кислоты. Применение азотной кислоты
Cлайд 24
 О.С.Габриелян , И.Г. Остроумов Настольная книга учителя химии 9 класс. Дрофа 2003 Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ Химия2000 http://ru.wikipedia.org/wiki/HNO3http://centralnyj.fis.ru/Petrochemicalshttp://dic.academic.ru/dic.nsf/bse/61981/%D0%90%D0%B7%D0%BE%D1
О.С.Габриелян , И.Г. Остроумов Настольная книга учителя химии 9 класс. Дрофа 2003 Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ Химия2000 http://ru.wikipedia.org/wiki/HNO3http://centralnyj.fis.ru/Petrochemicalshttp://dic.academic.ru/dic.nsf/bse/61981/%D0%90%D0%B7%D0%BE%D1