X
Код презентации скопируйте его
Соли, их классификация и свойства
Скачать эту презентациюПрезентация на тему Соли, их классификация и свойства
Скачать эту презентациюCлайд 1
 Соли, их классификация и свойства Автор: учитель химии МКОУ «Касторенская СОШ №1», п.г.т. Касторное Парамонов А.Ю., 2014
Соли, их классификация и свойства Автор: учитель химии МКОУ «Касторенская СОШ №1», п.г.т. Касторное Парамонов А.Ю., 2014
Cлайд 2
 Цели урока: 1)Познакомить учащихся с понятием соли, изучить основные классификации солей; 2)Изучить основные химические свойства солей; 3)Продолжить формирование умений составлять уравнения химических реакций; 4)Продолжить воспитывать культуру работы с реактивами;
Цели урока: 1)Познакомить учащихся с понятием соли, изучить основные классификации солей; 2)Изучить основные химические свойства солей; 3)Продолжить формирование умений составлять уравнения химических реакций; 4)Продолжить воспитывать культуру работы с реактивами;
Cлайд 3
 Что такое соли? Соли – это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка. (Например: NaCl, NH4NO3, AgY) Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотных остатков. (Например: K3PO4 = 3K+ + PO43- )
Что такое соли? Соли – это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка. (Например: NaCl, NH4NO3, AgY) Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4+) и анионы кислотных остатков. (Например: K3PO4 = 3K+ + PO43- )
Cлайд 4
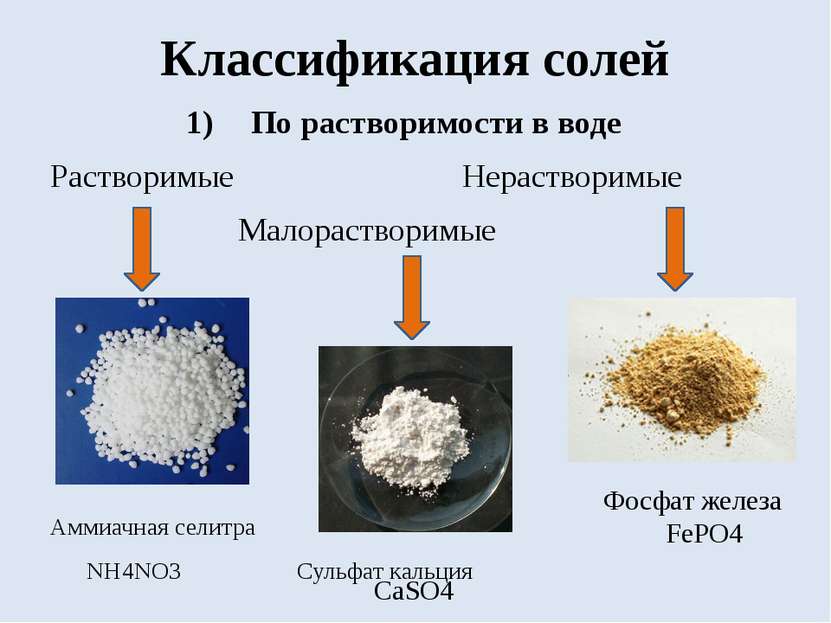
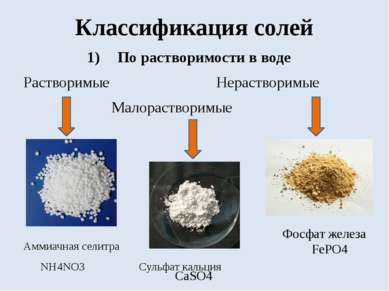 Классификация солей По растворимости в воде Растворимые Нерастворимые Малорастворимые Аммиачная селитра NH4NO3 Сульфат кальция Фосфат железа FePO4 CaSO4
Классификация солей По растворимости в воде Растворимые Нерастворимые Малорастворимые Аммиачная селитра NH4NO3 Сульфат кальция Фосфат железа FePO4 CaSO4
Cлайд 5
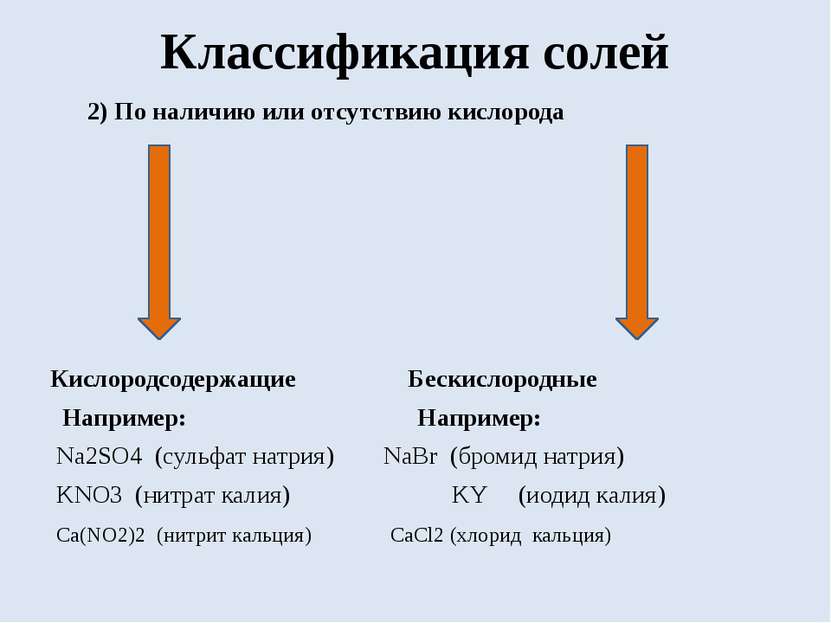
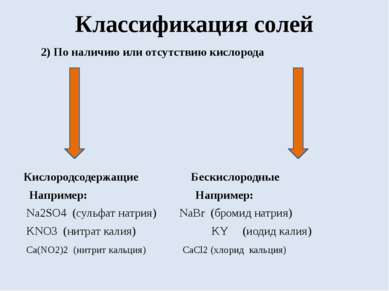 Классификация солей 2) По наличию или отсутствию кислорода Кислородсодержащие Бескислородные Например: Например: Na2SO4 (сульфат натрия) NaBr (бромид натрия) KNO3 (нитрат калия) KY (иодид калия) Ca(NO2)2 (нитрит кальция) CaCl2 (хлорид кальция)
Классификация солей 2) По наличию или отсутствию кислорода Кислородсодержащие Бескислородные Например: Например: Na2SO4 (сульфат натрия) NaBr (бромид натрия) KNO3 (нитрат калия) KY (иодид калия) Ca(NO2)2 (нитрит кальция) CaCl2 (хлорид кальция)
Cлайд 6
 Разновидности солей Соли бывают: Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Например: Na2CO3 (карбонат натрия) CuSO4 (сульфат меди) Диссоциация средних солей: Na2CO3 = 2Na+ + CO32-
Разновидности солей Соли бывают: Средние соли – это продукты полного замещения атомов водорода в кислоте на металл. Например: Na2CO3 (карбонат натрия) CuSO4 (сульфат меди) Диссоциация средних солей: Na2CO3 = 2Na+ + CO32-
Cлайд 7
 Разновидности солей 2) Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл. Например: NaHCO3 (гидрокарбонат натрия) Mg(HSO4)2 (гидросульфат магния) Диссоциация кислых солей: Ca(HSO4)2 = Ca2+ + 2HSO4-
Разновидности солей 2) Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл. Например: NaHCO3 (гидрокарбонат натрия) Mg(HSO4)2 (гидросульфат магния) Диссоциация кислых солей: Ca(HSO4)2 = Ca2+ + 2HSO4-
Cлайд 8
 Разновидности солей 3) Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например: (CuOH)2CO3 (гидроксокарбонат меди (II)) AlOHCl2 (гидроксохлорид алюминия) Диссоциация основных солей: AlOHCl2 = AlOH2+ + 2Cl-
Разновидности солей 3) Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например: (CuOH)2CO3 (гидроксокарбонат меди (II)) AlOHCl2 (гидроксохлорид алюминия) Диссоциация основных солей: AlOHCl2 = AlOH2+ + 2Cl-
Cлайд 9
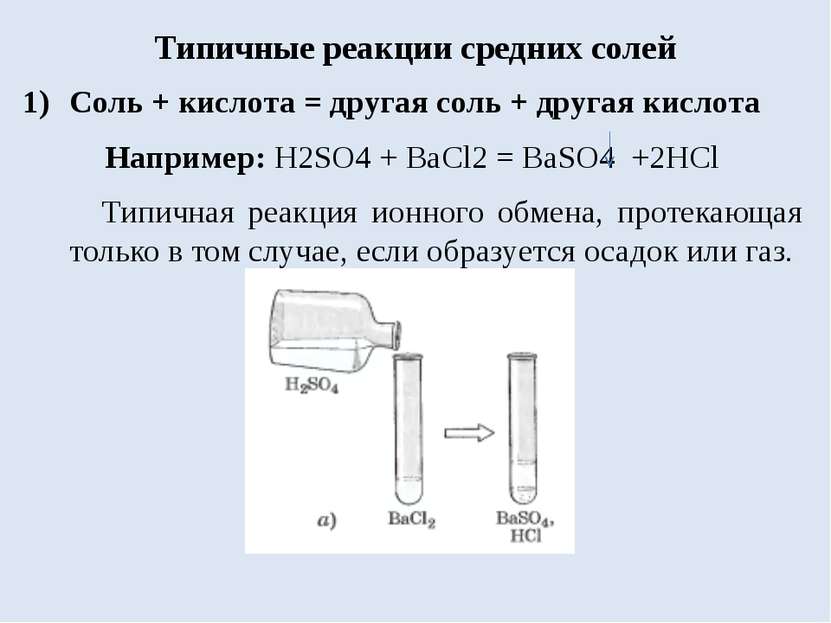
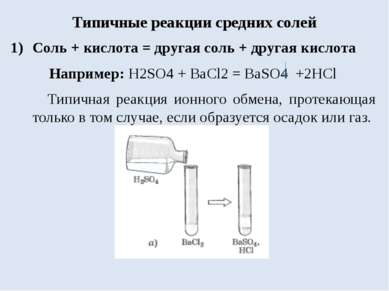 Типичные реакции средних солей Соль + кислота = другая соль + другая кислота Например: H2SO4 + BaCl2 = BaSO4 +2HCl Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Типичные реакции средних солей Соль + кислота = другая соль + другая кислота Например: H2SO4 + BaCl2 = BaSO4 +2HCl Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Cлайд 10
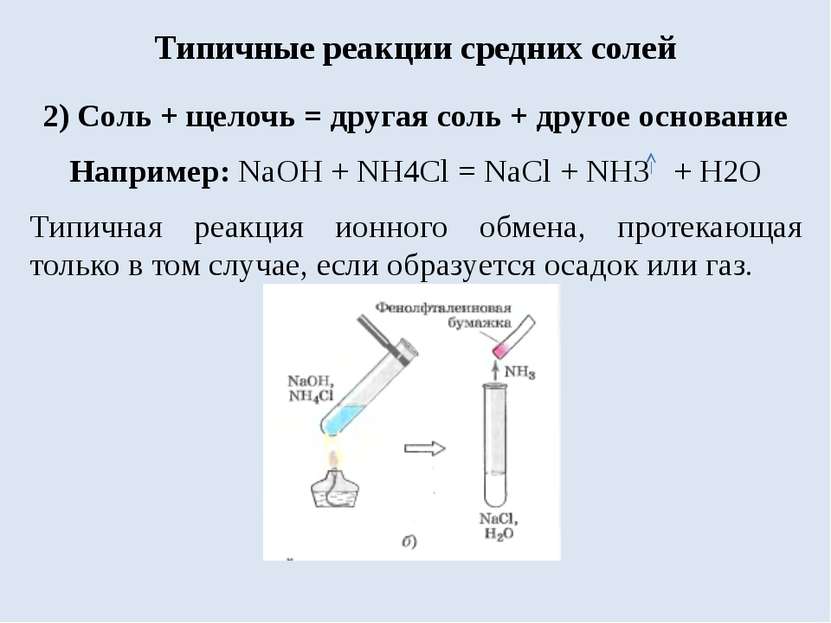
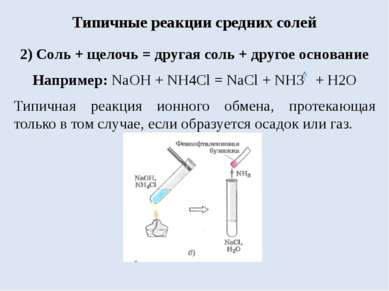 Типичные реакции средних солей 2) Соль + щелочь = другая соль + другое основание Например: NaOH + NH4Cl = NaCl + NH3 + H2O Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Типичные реакции средних солей 2) Соль + щелочь = другая соль + другое основание Например: NaOH + NH4Cl = NaCl + NH3 + H2O Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Cлайд 11
 Типичные реакции средних солей 3) Соль1 + соль2 = соль3 + соль4 Например: Na2SO4 + BaCl2 = BaSO4 +2NaCl Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок.
Типичные реакции средних солей 3) Соль1 + соль2 = соль3 + соль4 Например: Na2SO4 + BaCl2 = BaSO4 +2NaCl Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок.
Cлайд 12
 Типичные реакции средних солей 4) Соль + металл = другая соль + другой металл Например: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu Правила: а) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений; б) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми; в) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II группы ПС Д.И.Менделеева не вытесняют другие металлы из растворов солей.
Типичные реакции средних солей 4) Соль + металл = другая соль + другой металл Например: CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu Правила: а) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений; б) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми; в) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II группы ПС Д.И.Менделеева не вытесняют другие металлы из растворов солей.
Cлайд 13
 Обобщение темы Тест «Как я запомнил тему»: 1) Выберите формулу соли: а) HCl б) Ca(OH)2 в) Na2SO4 г) MgО 2) Какая из приведенных солей растворима в воде: а) AgCl б) MgS в) FePO4 г) CuSO4 3) Какая из приведенных солей бескислородная: а) CаSO4 б) KBr в) NH4NO3 г) Na2CO3
Обобщение темы Тест «Как я запомнил тему»: 1) Выберите формулу соли: а) HCl б) Ca(OH)2 в) Na2SO4 г) MgО 2) Какая из приведенных солей растворима в воде: а) AgCl б) MgS в) FePO4 г) CuSO4 3) Какая из приведенных солей бескислородная: а) CаSO4 б) KBr в) NH4NO3 г) Na2CO3
Cлайд 14
 . 4) К какому типу солей относится данная соль - AlOHCl2: а) средняя б) основная в) кислая г) ни к одной из этих 5) Какая реакция не является типичной реакцией для средних солей: а) соль + металл б) соль + кислота в) соль + оксид г) соль + щелочь
. 4) К какому типу солей относится данная соль - AlOHCl2: а) средняя б) основная в) кислая г) ни к одной из этих 5) Какая реакция не является типичной реакцией для средних солей: а) соль + металл б) соль + кислота в) соль + оксид г) соль + щелочь
Cлайд 17
 Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://ru.wikipedia.org/wiki/Фосфат железа (III) фосфат железа http://www.freetorg.ru/lead/ammiachnaya-selitra-azotno-fosforno-kalijnoe-udobrenie-npk,1506202.html аммиачная селитра http://www.freetorg.com.ua/lead/prodam-kalcij-sernokislyj,2478523.html сульфат кальция
Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://ru.wikipedia.org/wiki/Фосфат железа (III) фосфат железа http://www.freetorg.ru/lead/ammiachnaya-selitra-azotno-fosforno-kalijnoe-udobrenie-npk,1506202.html аммиачная селитра http://www.freetorg.com.ua/lead/prodam-kalcij-sernokislyj,2478523.html сульфат кальция