X
Код презентации скопируйте его
Электролиз
Скачать эту презентациюПрезентация на тему Электролиз
Скачать эту презентациюCлайд 1
 Тема «Электролиз» МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель химии высшей квалификационной категории Бабичева Валентина Николаевна.
Тема «Электролиз» МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КУЛУНДИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №1» , учитель химии высшей квалификационной категории Бабичева Валентина Николаевна.
Cлайд 2
 Как наша прожила б планета? Как люди жили бы на ней Без теплоты, магнита, света И электрических лучей? Адам Мицкевич Эпиграф урока
Как наша прожила б планета? Как люди жили бы на ней Без теплоты, магнита, света И электрических лучей? Адам Мицкевич Эпиграф урока
Cлайд 3
 Проблемный вопрос. Что произойдёт, если в раствор или расплав электролита опустить электроды, которые присоединены к источнику электрического тока?
Проблемный вопрос. Что произойдёт, если в раствор или расплав электролита опустить электроды, которые присоединены к источнику электрического тока?
Cлайд 4
 Электролиз – дословно: «лизис» – разложение, «электро» – электрическим током. Цель урока: изучить сущность и применение процесса электролиза.
Электролиз – дословно: «лизис» – разложение, «электро» – электрическим током. Цель урока: изучить сущность и применение процесса электролиза.
Cлайд 5
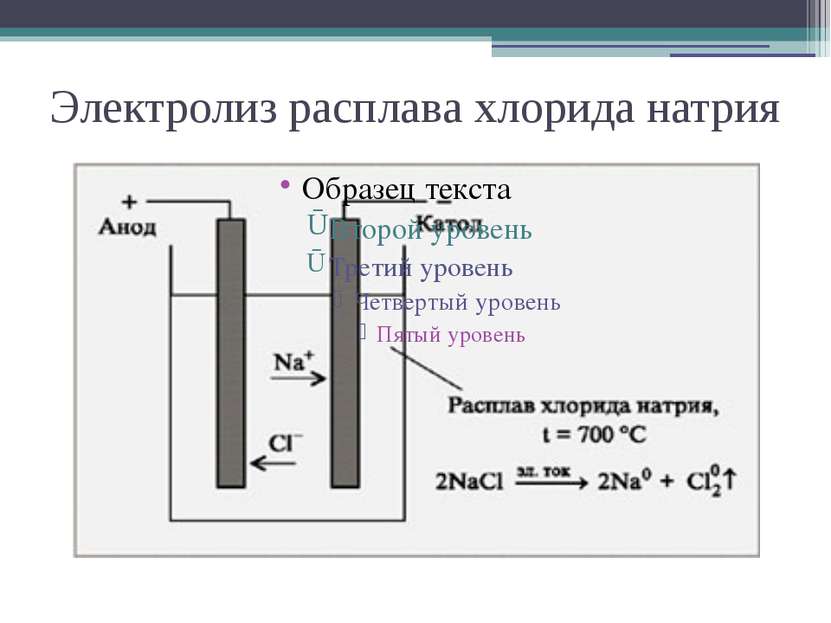
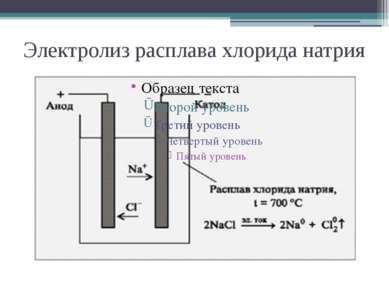
 Электролиз – это окислительно- -восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
Электролиз – это окислительно- -восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
Cлайд 6
 Электролиз План Электролиз расплава. Электролиз раствора. Сущность электролиза. Применение. Выводы.
Электролиз План Электролиз расплава. Электролиз раствора. Сущность электролиза. Применение. Выводы.
Cлайд 8
 Электролиз является окислительно – - восстановительным процессом: на катоде всегда идёт процесс восстановления, на аноде всегда идёт процесс окисления.
Электролиз является окислительно – - восстановительным процессом: на катоде всегда идёт процесс восстановления, на аноде всегда идёт процесс окисления.
Cлайд 9
 Для определения результатов электролиза водных растворов существуют следующие правила: Процесс на катоде не зависит от материала катода, а зависит от положения металла в электрохимическом ряду напряжений. ( работа с инструкцией)
Для определения результатов электролиза водных растворов существуют следующие правила: Процесс на катоде не зависит от материала катода, а зависит от положения металла в электрохимическом ряду напряжений. ( работа с инструкцией)
Cлайд 10
 Процесс на аноде зависит от материала анода и от природы аниона. Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то результаты зависят от анионов кислотных остатков. Если анод растворимый ( железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идёт окисление металла анода.
Процесс на аноде зависит от материала анода и от природы аниона. Если анод нерастворимый, т.е. инертный (уголь, графит, платина, золото), то результаты зависят от анионов кислотных остатков. Если анод растворимый ( железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза), то независимо от природы аниона всегда идёт окисление металла анода.
Cлайд 11
 Электрическая энергия Химическая энергия Электролиз Раствор NaCl Катод(-) Анод(+) H2О Расплав NaCl Катод(-) Анод(+) Na+ + e => Na0 2Cl- => Cl20 + 2e Восстановление Окисление 2H2 О + 2e => H2 + 2Na+ 2OH- 2 Cl- => Cl2 + 2e Восстановление Окисление Основные положения электродных процессов 1. На катоде: Li, K+, Ca2+, Na+, Mg2+, Al3+ Zn2+, Cr3+, Fe2+, Ni2+, Sn2+, Pb2+ Cu2+, Ag+, Hg2+, Pt2+, Au3+ H+ Не восстанавливаются, выделяется H2 Возможно выделение Me и H2 Восстанавливаются, выделяется Me 2. Анодные процессы а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается окислению Me =>Men+ +ne б) На нерастворимом аноде (графит, платина) обычно окисляются анионы S -, J-, Br-, Cl-, OH- и молекулы H20: 2J- =>J20 + 2e; 4OH- =>O2 +2H2O +4e; 2H2O =>O2 +4H+ +4e
Электрическая энергия Химическая энергия Электролиз Раствор NaCl Катод(-) Анод(+) H2О Расплав NaCl Катод(-) Анод(+) Na+ + e => Na0 2Cl- => Cl20 + 2e Восстановление Окисление 2H2 О + 2e => H2 + 2Na+ 2OH- 2 Cl- => Cl2 + 2e Восстановление Окисление Основные положения электродных процессов 1. На катоде: Li, K+, Ca2+, Na+, Mg2+, Al3+ Zn2+, Cr3+, Fe2+, Ni2+, Sn2+, Pb2+ Cu2+, Ag+, Hg2+, Pt2+, Au3+ H+ Не восстанавливаются, выделяется H2 Возможно выделение Me и H2 Восстанавливаются, выделяется Me 2. Анодные процессы а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается окислению Me =>Men+ +ne б) На нерастворимом аноде (графит, платина) обычно окисляются анионы S -, J-, Br-, Cl-, OH- и молекулы H20: 2J- =>J20 + 2e; 4OH- =>O2 +2H2O +4e; 2H2O =>O2 +4H+ +4e
Cлайд 12
 Работа с учебником (стр. 109-110) Проанализируйте процесс электролиза водного раствора сульфата натрия. Используя инструкции, запишите катодный и анодный процессы. Почему данный процесс сводится к электролизу воды?
Работа с учебником (стр. 109-110) Проанализируйте процесс электролиза водного раствора сульфата натрия. Используя инструкции, запишите катодный и анодный процессы. Почему данный процесс сводится к электролизу воды?
Cлайд 13
 Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Cлайд 14
 Внимательно наблюдайте за результатами электролиза сульфата меди. 1. Запишите катодный и анодный процессы, суммарное уравнение процесса. 2. Объясните сходство и различие процессов электролиза сульфата натрия и сульфата меди.
Внимательно наблюдайте за результатами электролиза сульфата меди. 1. Запишите катодный и анодный процессы, суммарное уравнение процесса. 2. Объясните сходство и различие процессов электролиза сульфата натрия и сульфата меди.
Cлайд 15
 Проверь себя! CuSO4 → Cu2+ + SO42- H2O Катод (-) Cu2+ SO42- Анод (+) Cu2+ + 2e = Cu0 2H2O – 4e = O2↑ + 4H+ восстановление окисление Суммарное уравнение: 2CuSO4 + 2H2O = 2Cu0 + O2↑ + 2H2SO4
Проверь себя! CuSO4 → Cu2+ + SO42- H2O Катод (-) Cu2+ SO42- Анод (+) Cu2+ + 2e = Cu0 2H2O – 4e = O2↑ + 4H+ восстановление окисление Суммарное уравнение: 2CuSO4 + 2H2O = 2Cu0 + O2↑ + 2H2SO4
Cлайд 16
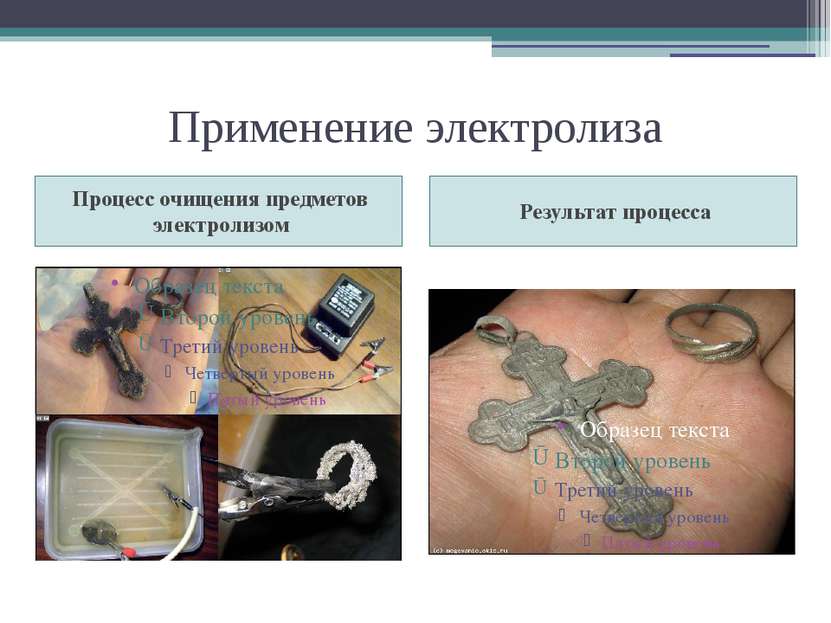
 Применение электролиза Катодные процессы Анодные процессы В гальваностегии ( никелирование, серебрение). В гальванопластике (изготовление копий). Получение чистых металлов ( медь, алюминий). Электрометаллургия расплавов. Очистка металлов, полученных при выплавке из руды, от посторонних примесей. Промышленный способ получения кислорода и водорода. Оксидирование алюминия. Электрополировка поверхностей (электроискровая обработка, электрозаточка). Электрогравировка.
Применение электролиза Катодные процессы Анодные процессы В гальваностегии ( никелирование, серебрение). В гальванопластике (изготовление копий). Получение чистых металлов ( медь, алюминий). Электрометаллургия расплавов. Очистка металлов, полученных при выплавке из руды, от посторонних примесей. Промышленный способ получения кислорода и водорода. Оксидирование алюминия. Электрополировка поверхностей (электроискровая обработка, электрозаточка). Электрогравировка.
Cлайд 17
 Гальванопластика политехнического государственного музея «Георгий Победоносец» Барельеф «Портрет Б.С.Якоби»
Гальванопластика политехнического государственного музея «Георгий Победоносец» Барельеф «Портрет Б.С.Якоби»
Cлайд 19
 Установите правильную последовательность. окислительно-восстановительные реакции если через раствор или расплав Электролиз – это протекающие на электродах пропускают электролита постоянный ток 3, 1, 4, 2, 6, 5, 7
Установите правильную последовательность. окислительно-восстановительные реакции если через раствор или расплав Электролиз – это протекающие на электродах пропускают электролита постоянный ток 3, 1, 4, 2, 6, 5, 7
Cлайд 20
 Ответьте на вопросы. 1. При электролизе к аноду движутся: а) катионы б) анионы в) все ионы г) электроны 2. При электролизе расплава хлорида меди на катоде выделится: а) медь, б) водород в) хлор г) кислород 3. На аноде выделится кислород при электролизе растворов: а) CuBr2 б) NaNO3 в) FeCl3
Ответьте на вопросы. 1. При электролизе к аноду движутся: а) катионы б) анионы в) все ионы г) электроны 2. При электролизе расплава хлорида меди на катоде выделится: а) медь, б) водород в) хлор г) кислород 3. На аноде выделится кислород при электролизе растворов: а) CuBr2 б) NaNO3 в) FeCl3
Cлайд 21
 Рефлексия. Если вы согласны с утверждениями, поставьте плюс, а если нет, то минус. 1. Я узнал много нового и интересного. 2. На все возникшие в ходе урока вопросы я получил ответы. 3. Мне было интересно и комфортно. 4. Считаю, что работал добросовестно и достиг цели урока.
Рефлексия. Если вы согласны с утверждениями, поставьте плюс, а если нет, то минус. 1. Я узнал много нового и интересного. 2. На все возникшие в ходе урока вопросы я получил ответы. 3. Мне было интересно и комфортно. 4. Считаю, что работал добросовестно и достиг цели урока.
Cлайд 22
 Домашнее задание Записи в тетради. Учебник «Химия – 10», стр. 107 - 111 (читать). Выполнить упр. 7, 21Т(письменно).
Домашнее задание Записи в тетради. Учебник «Химия – 10», стр. 107 - 111 (читать). Выполнить упр. 7, 21Т(письменно).
Cлайд 23
 Спасибо за внимание! Использованные ресурсы: http://www.reviewdetector.ru/index.php?act=Print&client=wordr&f=6&t=4456 http://energobelarus.by/index.php?section=news&new http://sc.uriit.ru/catalog/rubr/8f5d7210-86a6-11da-a72b-0800200c9a66/21364/ rus.polymus.ru›index.php… himikatus.ru›art/nvideo_neorg/elektrolzq.php
Спасибо за внимание! Использованные ресурсы: http://www.reviewdetector.ru/index.php?act=Print&client=wordr&f=6&t=4456 http://energobelarus.by/index.php?section=news&new http://sc.uriit.ru/catalog/rubr/8f5d7210-86a6-11da-a72b-0800200c9a66/21364/ rus.polymus.ru›index.php… himikatus.ru›art/nvideo_neorg/elektrolzq.php