X
Код презентации скопируйте его
Электролиз. Удивительный мир гальваники
Скачать эту презентациюПрезентация на тему Электролиз. Удивительный мир гальваники
Скачать эту презентациюCлайд 1
 Электролиз. Удивительный мир гальваники Выполнила: Степанова Анастасия Преподаватель: Степанова О.Э. МОУ СОШ «Эврика-развитие», г. Томск
Электролиз. Удивительный мир гальваники Выполнила: Степанова Анастасия Преподаватель: Степанова О.Э. МОУ СОШ «Эврика-развитие», г. Томск
Cлайд 2
 Что такое электролиз? Почему сухая соль, а также дистиллированная вода не проводят электрический ток, а если их смешать становятся проводником? Цель: изучить сущность процесса электролиза Задачи: * суть катодных и анодных процессов * примеры электролиза * применение электролиза * экспериментально проверить выполнение законов электролиза * на практике познакомиться с гальванотехникой
Что такое электролиз? Почему сухая соль, а также дистиллированная вода не проводят электрический ток, а если их смешать становятся проводником? Цель: изучить сущность процесса электролиза Задачи: * суть катодных и анодных процессов * примеры электролиза * применение электролиза * экспериментально проверить выполнение законов электролиза * на практике познакомиться с гальванотехникой
Cлайд 3
 Содержание Понятие электролиза Законы электролиза Экспериментальная проверка закона Фарадея Применение электролиза в промышленности
Содержание Понятие электролиза Законы электролиза Экспериментальная проверка закона Фарадея Применение электролиза в промышленности
Cлайд 4
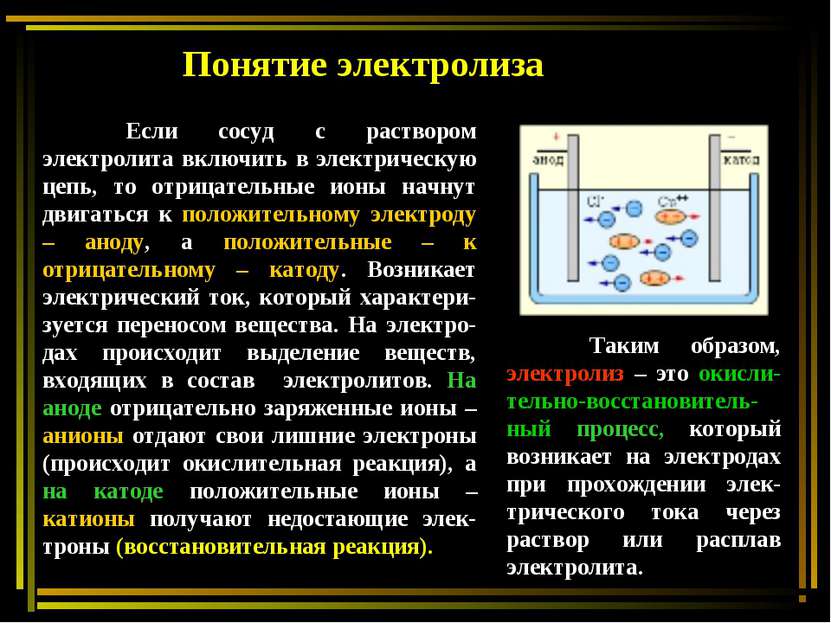
 Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду – аноду, а положительные – к отрицательному – катоду. Возникает электрический ток, который характери-зуется переносом вещества. На электро-дах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы – анионы отдают свои лишние электроны (происходит окислительная реакция), а на катоде положительные ионы – катионы получают недостающие элек-троны (восстановительная реакция). Понятие электролиза Таким образом, электролиз – это окисли-тельно-восстановитель-ный процесс, который возникает на электродах при прохождении элек-трического тока через раствор или расплав электролита.
Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду – аноду, а положительные – к отрицательному – катоду. Возникает электрический ток, который характери-зуется переносом вещества. На электро-дах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы – анионы отдают свои лишние электроны (происходит окислительная реакция), а на катоде положительные ионы – катионы получают недостающие элек-троны (восстановительная реакция). Понятие электролиза Таким образом, электролиз – это окисли-тельно-восстановитель-ный процесс, который возникает на электродах при прохождении элек-трического тока через раствор или расплав электролита.
Cлайд 5
 Явление электролиза было открыто в 1800 г. английскими учеными У. Никольсоном и А. Карлейлем, наблюдавшими выделение пузырьков кислорода на аноде и водорода на катоде при погружении электродов в воду. Законы электролиза был экспериментально установлены английским физиком М. Фарадеем в 1833 году.
Явление электролиза было открыто в 1800 г. английскими учеными У. Никольсоном и А. Карлейлем, наблюдавшими выделение пузырьков кислорода на аноде и водорода на катоде при погружении электродов в воду. Законы электролиза был экспериментально установлены английским физиком М. Фарадеем в 1833 году.
Cлайд 6
 Законы электролиза К проводникам электрического тока относятся - водные растворы солей, кислот и оснований. Вещества и растворы, которые проводят электрический ток, получили название - электролиты. Чтобы вещество проводило ток, необходимо наличие заряженных частиц (электронов, протонов, «+» или «-» ионов). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора: СuCl2 = Cu+2 + 2 Cl-1
Законы электролиза К проводникам электрического тока относятся - водные растворы солей, кислот и оснований. Вещества и растворы, которые проводят электрический ток, получили название - электролиты. Чтобы вещество проводило ток, необходимо наличие заряженных частиц (электронов, протонов, «+» или «-» ионов). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора: СuCl2 = Cu+2 + 2 Cl-1
Cлайд 7
 Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди. Диссоциация молекул сульфата меди происходит по схеме: СuSO4 = Cu+2 + SO4-2 Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить хими-чески чистую медь. Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложе-ние меди на катоде.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди. Диссоциация молекул сульфата меди происходит по схеме: СuSO4 = Cu+2 + SO4-2 Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить хими-чески чистую медь. Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложе-ние меди на катоде.
Cлайд 8
 Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит: m = k Q = k I t. Величину k называют электрохимическим эквивалентом. Электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит: m = k Q = k I t. Величину k называют электрохимическим эквивалентом. Электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
Cлайд 9
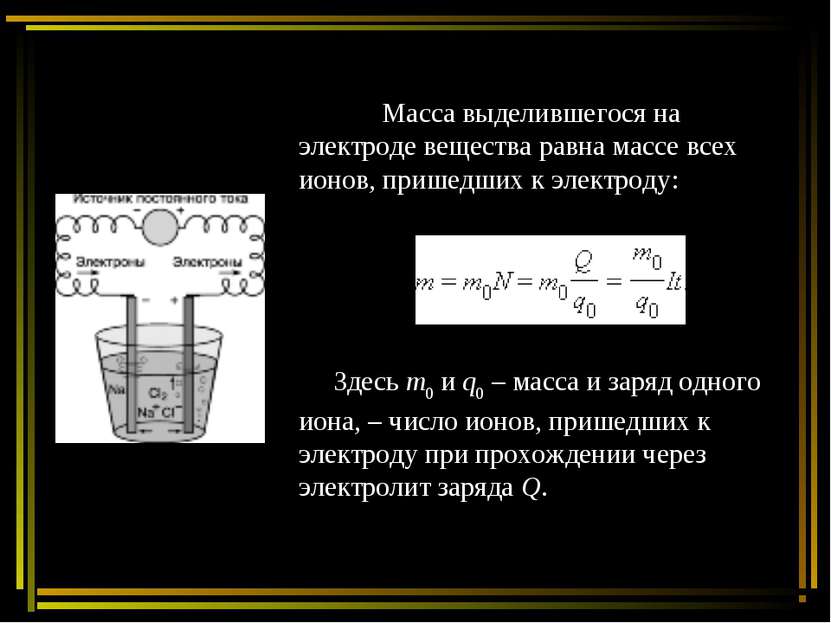
 Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду: Здесь m0 и q0 – масса и заряд одного иона, – число ионов, пришедших к электроду при прохождении через электролит заряда Q.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду: Здесь m0 и q0 – масса и заряд одного иона, – число ионов, пришедших к электроду при прохождении через электролит заряда Q.
Cлайд 10
 Закон Фарадея для электролиза приобретает вид: Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA – постоянная Фарадея. F = eNA = 96485 Кл / моль. Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид: Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA – постоянная Фарадея. F = eNA = 96485 Кл / моль. Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Cлайд 11
 Эксперимент: Выполнение закона Фарадея (на практике) Масса ключа 12,1 г. После сборки электрической цепи (см. рис) через раствор электролита пропускался ток напряжение 4 В, сила тока 1 А в течение 2 ч. Масса ключа после осаждения меди 14,3 г. Определить электрохимический коэффициент меди и сравнить с табличным значением. Дано: Δm= m1-m2=2.2г I= 1А U= 4В t=2ч= 7200с k - ? Решение: Δm= kIt k =Δm/It k= 2.2*10-3кг/(1A*7200c) k= 3.05*10-7кг/Кл Табличное значение 3.3*10-7кг/Кл Погрешность составляет: абс. 0,25*10-7кг/Кл Относительная погрешность 0,075 или 7,5% Закон Фарадея выполнился с погрешностью 7,5 %
Эксперимент: Выполнение закона Фарадея (на практике) Масса ключа 12,1 г. После сборки электрической цепи (см. рис) через раствор электролита пропускался ток напряжение 4 В, сила тока 1 А в течение 2 ч. Масса ключа после осаждения меди 14,3 г. Определить электрохимический коэффициент меди и сравнить с табличным значением. Дано: Δm= m1-m2=2.2г I= 1А U= 4В t=2ч= 7200с k - ? Решение: Δm= kIt k =Δm/It k= 2.2*10-3кг/(1A*7200c) k= 3.05*10-7кг/Кл Табличное значение 3.3*10-7кг/Кл Погрешность составляет: абс. 0,25*10-7кг/Кл Относительная погрешность 0,075 или 7,5% Закон Фарадея выполнился с погрешностью 7,5 %
Cлайд 12
 Применение электролиза Явление электролиза широко применяется в современном промышленном производстве. Электролитические процессы классифицируются следующим образом: получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.); Электролиз раствора соли активного металла и бескислородной кислоты. Путем электролиза производят Н2 и О2 из воды, С12 из водных растворов NaCl, F2 из расплава KF очистка металлов (медь, серебро и т.д., и т.п.); Электролиз с растворимым анодом. Например, Полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
Применение электролиза Явление электролиза широко применяется в современном промышленном производстве. Электролитические процессы классифицируются следующим образом: получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.); Электролиз раствора соли активного металла и бескислородной кислоты. Путем электролиза производят Н2 и О2 из воды, С12 из водных растворов NaCl, F2 из расплава KF очистка металлов (медь, серебро и т.д., и т.п.); Электролиз с растворимым анодом. Например, Полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
Cлайд 13
 обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка); получение гальванических покрытий; Часто стальной кузов автомобиля покрывают снизу тонким слоем цинка для защиты от коррозии
обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка); получение гальванических покрытий; Часто стальной кузов автомобиля покрывают снизу тонким слоем цинка для защиты от коррозии
Cлайд 14
 Гальванотехника, область прикладной химии, охватывающая процессы электролитического осаждения металлов на поверхность металлических и неметаллических изделий. Гальванотехника включает: гальваностегию — получение на поверхности изделий прочно сцепленных с ней тонких металлических покрытий и гальванопластику — получение легко отделяющихся, относительно толстых, точных копий с различных предметов, т. н. матриц. Открытие и техническая разработка гальванотехники принадлежат русскому учёному Б. С. Якоби, о чём он доложил 5 октября 1838 на заседании Петербургской Академии Наук. Он много сделал для ее внедрения в печатное и монетное дело, для изготовления художественных изделий
Гальванотехника, область прикладной химии, охватывающая процессы электролитического осаждения металлов на поверхность металлических и неметаллических изделий. Гальванотехника включает: гальваностегию — получение на поверхности изделий прочно сцепленных с ней тонких металлических покрытий и гальванопластику — получение легко отделяющихся, относительно толстых, точных копий с различных предметов, т. н. матриц. Открытие и техническая разработка гальванотехники принадлежат русскому учёному Б. С. Якоби, о чём он доложил 5 октября 1838 на заседании Петербургской Академии Наук. Он много сделал для ее внедрения в печатное и монетное дело, для изготовления художественных изделий
Cлайд 15
 Одно из первых применений гальванопластики — создание декоративной скульптуры. Техникой гальванопластики в 30—40-х гг. XIX в. в России было изготовлено значительное число скульптуры, сохранившейся до нашего времени (например, часть скульптуры на фасаде Исаакиевского собора в Санкт-Петербурге, скульптура в Екатерининском парке города Пушкина и др.). Воспроизведение скульптур в бронзе или чугуне возможно только литейным способом, к сожалению, не дающим возможности получить скульптурное произведение с абсолютной точностью: при отливке ухудшается передача мельчайших штрихов, а вместе с ними меняется манера, в которой воспроизведена лепка.
Одно из первых применений гальванопластики — создание декоративной скульптуры. Техникой гальванопластики в 30—40-х гг. XIX в. в России было изготовлено значительное число скульптуры, сохранившейся до нашего времени (например, часть скульптуры на фасаде Исаакиевского собора в Санкт-Петербурге, скульптура в Екатерининском парке города Пушкина и др.). Воспроизведение скульптур в бронзе или чугуне возможно только литейным способом, к сожалению, не дающим возможности получить скульптурное произведение с абсолютной точностью: при отливке ухудшается передача мельчайших штрихов, а вместе с ними меняется манера, в которой воспроизведена лепка.
Cлайд 16
 Гальваностегия Прежде всего необходимо тщательно очистить предмет! Очищенное изделие подвешивается в гальванической ванне, где оно будет служить в качестве катода. На 1 литр воды 250 г сульфата меди (медный купорос) 50-80 г концентрированной серной кислоты. Анодом служит медная пластинка подвешенная параллельно покрываемой детали. Напряжение должно быть 3-4 В, сила тока - 0.4 А. Температура 18-30 градусов. Чем сложнее форма детали, тем меньший ток можно применить. Положительным электродом будет медная пластинка, отрицательным - предмет, который вы хотите покрыть медью, например, железный ключ. Эксперимент
Гальваностегия Прежде всего необходимо тщательно очистить предмет! Очищенное изделие подвешивается в гальванической ванне, где оно будет служить в качестве катода. На 1 литр воды 250 г сульфата меди (медный купорос) 50-80 г концентрированной серной кислоты. Анодом служит медная пластинка подвешенная параллельно покрываемой детали. Напряжение должно быть 3-4 В, сила тока - 0.4 А. Температура 18-30 градусов. Чем сложнее форма детали, тем меньший ток можно применить. Положительным электродом будет медная пластинка, отрицательным - предмет, который вы хотите покрыть медью, например, железный ключ. Эксперимент
Cлайд 17
 Полоска меди и ключ должны быть опущены в раствор купороса, но не соприкасаться между собою. Ток будет разлагать медный купорос. Выделяющаяся из него чистая медь будет оседать на отрицательном электроде — на ключе. А в это же время взамен меди, извлеченной таким способом из раствора, на положительном электроде идет разрушительная работа: медная пластинка разъедается и пополняет медью раствор. Омеднение ключа
Полоска меди и ключ должны быть опущены в раствор купороса, но не соприкасаться между собою. Ток будет разлагать медный купорос. Выделяющаяся из него чистая медь будет оседать на отрицательном электроде — на ключе. А в это же время взамен меди, извлеченной таким способом из раствора, на положительном электроде идет разрушительная работа: медная пластинка разъедается и пополняет медью раствор. Омеднение ключа
Cлайд 18
 ИЗГОТОВЛЕНИЕ МЕТАЛЛИЧЕСКИХ ГЕРБАРИЕВ Для создания металлического гербария я взяла листья королевской бегонии, дуба и березы. К сожалению, мои эксперименты не совсем удачные, так как металлическое покрытие отстает от поверхности листа. В Интернете я нашла еще один рецепт создания металлического гербария…
ИЗГОТОВЛЕНИЕ МЕТАЛЛИЧЕСКИХ ГЕРБАРИЕВ Для создания металлического гербария я взяла листья королевской бегонии, дуба и березы. К сожалению, мои эксперименты не совсем удачные, так как металлическое покрытие отстает от поверхности листа. В Интернете я нашла еще один рецепт создания металлического гербария…
Cлайд 19
 Для создания металлических гербариев берут свежие листья и снимают с них отпечатки на восковой композиции. Для этого в формочку из плотной бумаги или в обечайку заливают подготовленную композицию и дают ей остыть почти до полного отвердевания с таким расчетом, чтобы поверхность восковой композиции была еще эластичной. Листья накладывают на поверхность воска и прижимают их стеклом. После этого снимают стекло и лист, и на восковой композиции остается четкий отпечаток листа. Таким же образом делают отпечаток с обратной стороны листа. Когда воск полностью затвердеет и станет холодным, форму с отпечатком осторожно графитируют мягкой кистью так, чтобы не повредить отпечатка. Установив проводники, на форме укрепляют груз, чтобы они не всплывали, и форму завешивают в гальванопластическую ванну РЕЦЕПТ ИЗГОТОВЛЕНИЯ МЕТАЛЛИЧЕСКИХ ГЕРБАРИЕВ
Для создания металлических гербариев берут свежие листья и снимают с них отпечатки на восковой композиции. Для этого в формочку из плотной бумаги или в обечайку заливают подготовленную композицию и дают ей остыть почти до полного отвердевания с таким расчетом, чтобы поверхность восковой композиции была еще эластичной. Листья накладывают на поверхность воска и прижимают их стеклом. После этого снимают стекло и лист, и на восковой композиции остается четкий отпечаток листа. Таким же образом делают отпечаток с обратной стороны листа. Когда воск полностью затвердеет и станет холодным, форму с отпечатком осторожно графитируют мягкой кистью так, чтобы не повредить отпечатка. Установив проводники, на форме укрепляют груз, чтобы они не всплывали, и форму завешивают в гальванопластическую ванну РЕЦЕПТ ИЗГОТОВЛЕНИЯ МЕТАЛЛИЧЕСКИХ ГЕРБАРИЕВ
Cлайд 20
 Заключение P.S. При использовании гальванотехники можно делать деньги – медные пятаки на удачу. Имея такой брелок, выпускник или студент может быть уверен - пятерка на экзамене обеспечена… Опыты с электричеством, с электролизом удивительны, занимательны. И чем больше я читаю, экспериментирую, тем больше меня захватывает эта тема…
Заключение P.S. При использовании гальванотехники можно делать деньги – медные пятаки на удачу. Имея такой брелок, выпускник или студент может быть уверен - пятерка на экзамене обеспечена… Опыты с электричеством, с электролизом удивительны, занимательны. И чем больше я читаю, экспериментирую, тем больше меня захватывает эта тема…
Cлайд 21
 Список использованной литературы Б. Донат Физика в играх М: Из-во Детская литература, 1932 г Н.В. Одноралов Гальваника дома Ленинград, 1996 г Кл.Э.Суорц Необыкновенная физика обыкновенных явлений. М; «Наука», Главная редакция физико-математический литературы, 1987 г Интернет В.А Касьянов Физика – 10. М: Дрофа, 2004 г.
Список использованной литературы Б. Донат Физика в играх М: Из-во Детская литература, 1932 г Н.В. Одноралов Гальваника дома Ленинград, 1996 г Кл.Э.Суорц Необыкновенная физика обыкновенных явлений. М; «Наука», Главная редакция физико-математический литературы, 1987 г Интернет В.А Касьянов Физика – 10. М: Дрофа, 2004 г.