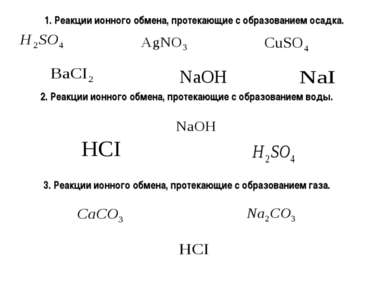
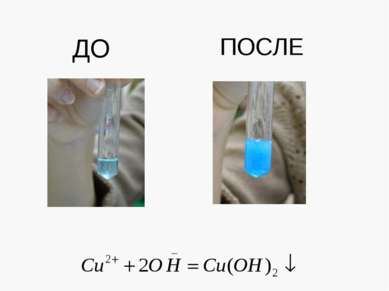
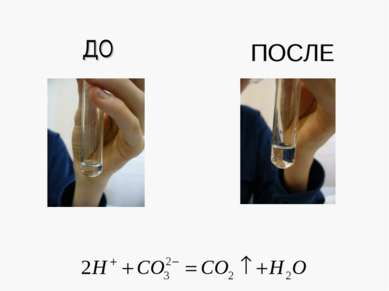
X
Код презентации скопируйте его
Теория электролитической диссоциации
Скачать эту презентациюПрезентация на тему Теория электролитической диссоциации
Скачать эту презентациюCлайд 2
 Терминология Фарадея Майкл Фарадей (1791 -1867) Ион Катион Анион Электролит Катод Анод Электролиз Диэлектрическая проницаемость 1833-1834 гг.
Терминология Фарадея Майкл Фарадей (1791 -1867) Ион Катион Анион Электролит Катод Анод Электролиз Диэлектрическая проницаемость 1833-1834 гг.
Cлайд 3
 Предыстория открытия ТЭД Рудольф Клаузиус 1857 г. Р. Клаузиус создал теорию электропроводности. Ионы образуются в растворе без воздействия тока.
Предыстория открытия ТЭД Рудольф Клаузиус 1857 г. Р. Клаузиус создал теорию электропроводности. Ионы образуются в растворе без воздействия тока.
Cлайд 4
 Теория растворов Менделеева Д.И. Менделеев (1834-1907) 1865-1887 г. цикл работ по изучению растворов Гидратная теория растворов 1865 г. докторская диссертация «О соединении спирта с водою» Изучил зависимость плотности от состава для 233 веществ H2SO4 H2SO4 H2O H2SO4 6 H2O H2SO4 150 H2O 1889 г. выступил на заседании РФХО «О диссоциации растворенных веществ в воде», опровергая идеи Аррениуса. 1887 г. «Исследование водных растворов по удельному весу»
Теория растворов Менделеева Д.И. Менделеев (1834-1907) 1865-1887 г. цикл работ по изучению растворов Гидратная теория растворов 1865 г. докторская диссертация «О соединении спирта с водою» Изучил зависимость плотности от состава для 233 веществ H2SO4 H2SO4 H2O H2SO4 6 H2O H2SO4 150 H2O 1889 г. выступил на заседании РФХО «О диссоциации растворенных веществ в воде», опровергая идеи Аррениуса. 1887 г. «Исследование водных растворов по удельному весу»
Cлайд 5
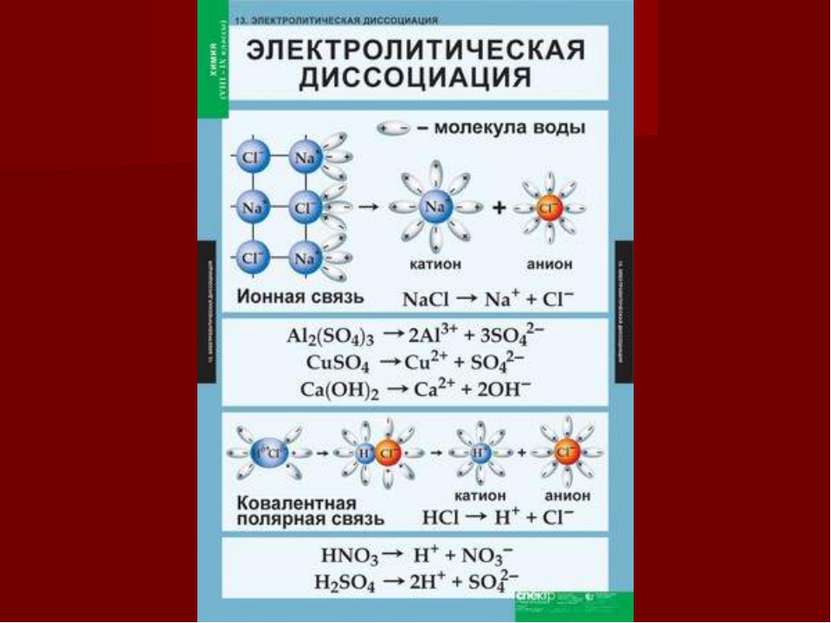
 Теория электролитической диссоциации Сванте Аррениус (1859-1927) 1883 г. – защита диссертации «Химическая теория электролитов» Электролиты в растворе распадаются на ионы под действием молекул полярного растворителя – электролитическая диссоциация Ионы существенно отличаются от атомов. В растворе ионы движутся хаотично. При пропускании через раствор электролита постоянного электрического тока ионы перемещаются направленно: катионы к катоду, анионы к аноду.
Теория электролитической диссоциации Сванте Аррениус (1859-1927) 1883 г. – защита диссертации «Химическая теория электролитов» Электролиты в растворе распадаются на ионы под действием молекул полярного растворителя – электролитическая диссоциация Ионы существенно отличаются от атомов. В растворе ионы движутся хаотично. При пропускании через раствор электролита постоянного электрического тока ионы перемещаются направленно: катионы к катоду, анионы к аноду.
Cлайд 6
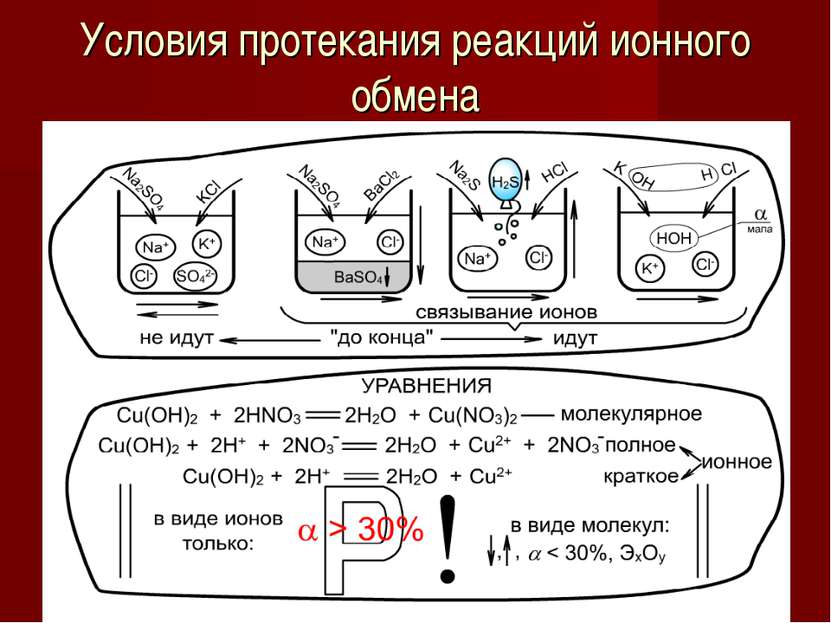
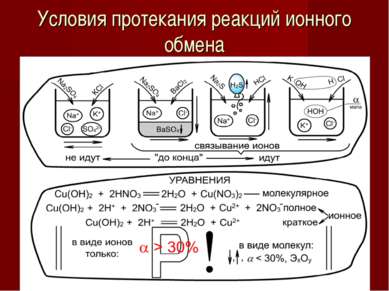
 Сильные и слабые электролиты Зависит: от природы электролита от t ° от с Соли Щелочи HCl, HBr, HI H2SO4 HNO3 HClO4, HClO3 H3PO4 HF HNO2 H2SO3 Органические кислоты, H2S H2SiO3 H2CO3 HCN Слабые, < 3% Средней силы, 3%
Сильные и слабые электролиты Зависит: от природы электролита от t ° от с Соли Щелочи HCl, HBr, HI H2SO4 HNO3 HClO4, HClO3 H3PO4 HF HNO2 H2SO3 Органические кислоты, H2S H2SiO3 H2CO3 HCN Слабые, < 3% Средней силы, 3%
Cлайд 9
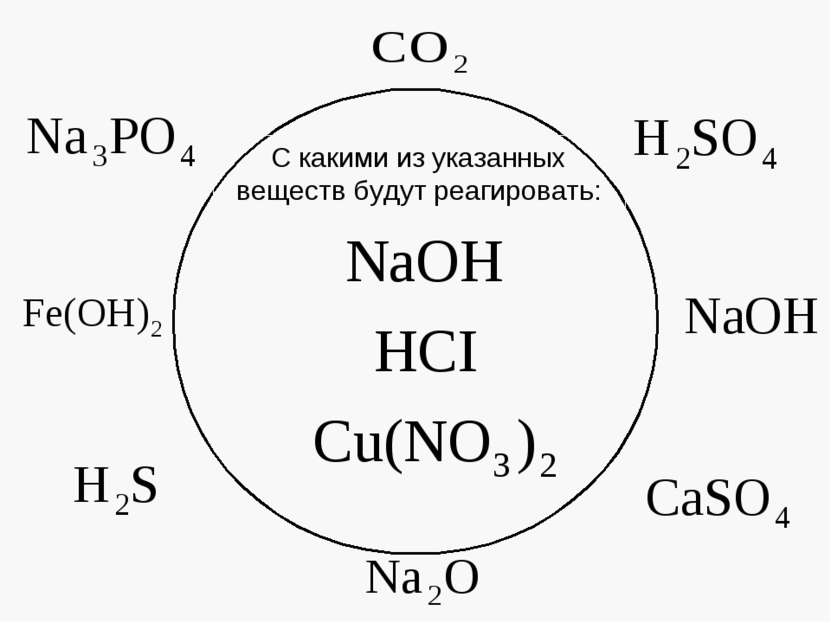
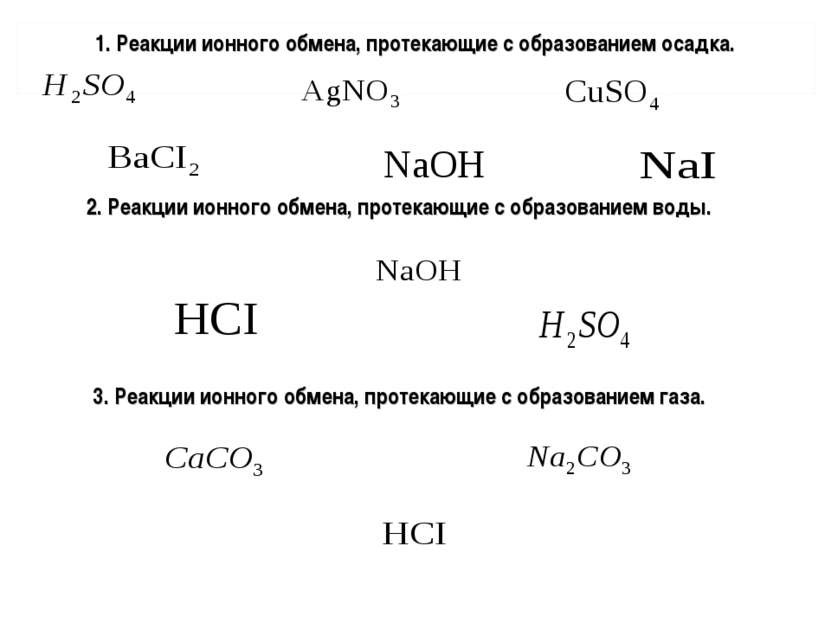
 Проверь свои знания Заряженные частицы Ионы 2. Положительно заряженные ионы 2. Катионы 3. Отрицательно заряженные ионы 3. Анионы 4. Вещества, растворы и расплавы которых проводят электрический ток 4. Электролиты 5. Вещества растворы и расплавы которых не проводят электрический ток 5. Неэлектролиты 6. Электролиты, в растворах которых все молекулы распались на ионы 6. Сильные электролиты 7. Вещества частично диссоциирующие на ионы 7. Слабые электролиты 8. Процесс распада электролитов на ионы при растворении в воде или расплавлении 8. Электролитическая диссоциация
Проверь свои знания Заряженные частицы Ионы 2. Положительно заряженные ионы 2. Катионы 3. Отрицательно заряженные ионы 3. Анионы 4. Вещества, растворы и расплавы которых проводят электрический ток 4. Электролиты 5. Вещества растворы и расплавы которых не проводят электрический ток 5. Неэлектролиты 6. Электролиты, в растворах которых все молекулы распались на ионы 6. Сильные электролиты 7. Вещества частично диссоциирующие на ионы 7. Слабые электролиты 8. Процесс распада электролитов на ионы при растворении в воде или расплавлении 8. Электролитическая диссоциация
Cлайд 13
 Правила техники безопасности (а) тушить спиртовку только колпачком; (б) запрещается зажигать одну спиртовку от другой, передавать спиртовку в зажженном виде; (в) запрещается пробовать вещества на вкус; (г) запрещается брать вещества руками; (д) запрещается выливать или высыпать остатки реактивов в склянки и банки, из которых они были взяты; (е) запрещается менять пробки и пипетки от различных банок или склянок; (ж) работать только над столом; (з) смыть водой, затем нейтрализующим веществом реактив, если он попал на кожу или одежду; (и) собирайте остатки веществ в специально предназначенную посуду
Правила техники безопасности (а) тушить спиртовку только колпачком; (б) запрещается зажигать одну спиртовку от другой, передавать спиртовку в зажженном виде; (в) запрещается пробовать вещества на вкус; (г) запрещается брать вещества руками; (д) запрещается выливать или высыпать остатки реактивов в склянки и банки, из которых они были взяты; (е) запрещается менять пробки и пипетки от различных банок или склянок; (ж) работать только над столом; (з) смыть водой, затем нейтрализующим веществом реактив, если он попал на кожу или одежду; (и) собирайте остатки веществ в специально предназначенную посуду