X
Код презентации скопируйте его
Свойства электрона
Скачать эту презентациюПрезентация на тему Свойства электрона
Скачать эту презентациюCлайд 3
 Электрон имеет двойственную природу (частица и волна). Движение электрона подчиняется законам квантовой механики. Связь между волновыми и корпускулярными свойствами электрона отражает соотношение де Бройля: l =h/mv ,где l - длина волны электрона; m - его масса; v - скорость; h = 6.62Ч10-34 ДжЧс - постоянная Планка. Свойства электрона
Электрон имеет двойственную природу (частица и волна). Движение электрона подчиняется законам квантовой механики. Связь между волновыми и корпускулярными свойствами электрона отражает соотношение де Бройля: l =h/mv ,где l - длина волны электрона; m - его масса; v - скорость; h = 6.62Ч10-34 ДжЧс - постоянная Планка. Свойства электрона
Cлайд 4
 Энергию и координаты электрона, невозможно одновременно измерить с одинаковой точностью (принцип неопределенности Гейзенберга) Часть пространства, в котором велика вероятность нахождения электрона, называют орбиталью или электронным облаком. Свойства электрона
Энергию и координаты электрона, невозможно одновременно измерить с одинаковой точностью (принцип неопределенности Гейзенберга) Часть пространства, в котором велика вероятность нахождения электрона, называют орбиталью или электронным облаком. Свойства электрона
Cлайд 7
 Квантовые числа Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. 1. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .).
Квантовые числа Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится. 1. Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .).
Cлайд 8
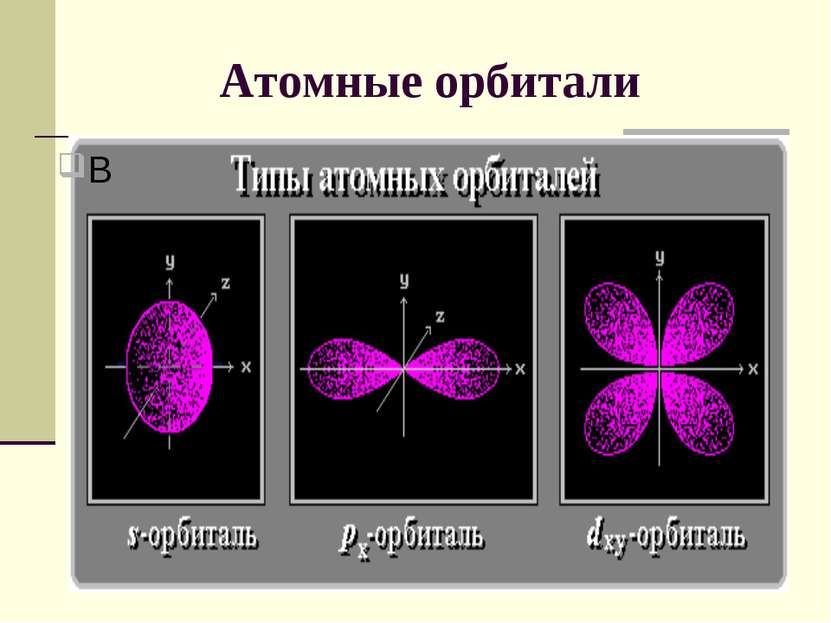
 Квантовые числа 2. Орбитальное (побочное) квантовое число l определяет форму атомной орбитали. Значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. l = 0 s-орбиталь, l = 1 - р-орбиталь, l = 2 - d-орбиталь, l = 3 - f-орбиталь
Квантовые числа 2. Орбитальное (побочное) квантовое число l определяет форму атомной орбитали. Значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. l = 0 s-орбиталь, l = 1 - р-орбиталь, l = 2 - d-орбиталь, l = 3 - f-орбиталь
Cлайд 9
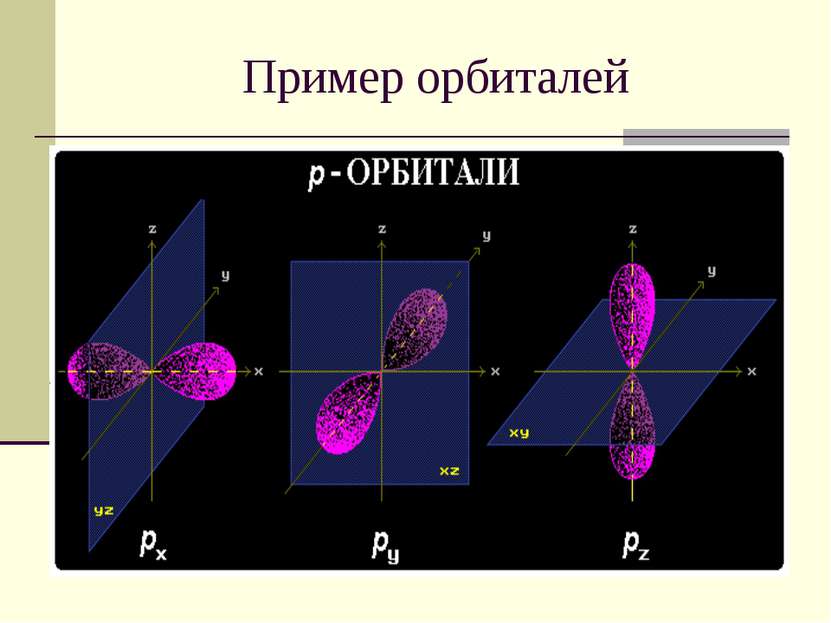
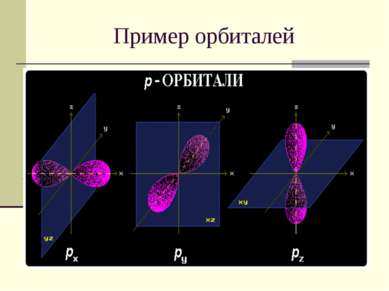
 Квантовые числа 3. Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. m = 2 l +1 Значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Квантовые числа 3. Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. m = 2 l +1 Значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Cлайд 10
 Квантовые числа 4.Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином. Для обозначения электронов с различными спинами используются символы: ↑ и ↓ .
Квантовые числа 4.Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином. Для обозначения электронов с различными спинами используются символы: ↑ и ↓ .
Cлайд 13
 Заполнение атомных орбиталей электронами При заполнении атомных орбиталей электронами соблюдаются три основные правила. Принцип Паули. Правило Хунда. Принцип устойчивости Клечковского.
Заполнение атомных орбиталей электронами При заполнении атомных орбиталей электронами соблюдаются три основные правила. Принцип Паули. Правило Хунда. Принцип устойчивости Клечковского.
Cлайд 14
 Заполнение атомных орбиталей электронами Принцип Паули: В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми
Заполнение атомных орбиталей электронами Принцип Паули: В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми
Cлайд 15
 Заполнение атомных орбиталей электронами Принцип Хунда: Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально
Заполнение атомных орбиталей электронами Принцип Хунда: Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально
Cлайд 16
 Заполнение атомных орбиталей электронами Принцип устойчивости Клечковского. АО заполняются электронами в порядке повышения их энергетических уровней. В первую очередь заполняются те орбитали, у которых min сумма n+l. При равных суммах n+l заполняются те, у которых n меньше 1s < 2s < 2p < 3s < 3p < 4s < 3d ... 4s (4+0)
Заполнение атомных орбиталей электронами Принцип устойчивости Клечковского. АО заполняются электронами в порядке повышения их энергетических уровней. В первую очередь заполняются те орбитали, у которых min сумма n+l. При равных суммах n+l заполняются те, у которых n меньше 1s < 2s < 2p < 3s < 3p < 4s < 3d ... 4s (4+0)