X
Код презентации скопируйте его
Типы химической связи
Скачать эту презентациюПрезентация на тему Типы химической связи
Скачать эту презентациюCлайд 1
 ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ Цели: Дать понятия ионной, ковалентной, металлической, водородной хим.связям; Научить определять и записывать схемы образования ионной и ковалентной связи для двухатомных молекул. МОУ лицей №18 учитель химии Калинина Л.А. .
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ Цели: Дать понятия ионной, ковалентной, металлической, водородной хим.связям; Научить определять и записывать схемы образования ионной и ковалентной связи для двухатомных молекул. МОУ лицей №18 учитель химии Калинина Л.А. .
Cлайд 2
 АТОМЫ Na0 - 1s22s22p63s1 Mg0 - 1s22s22p63s2 F0 - 1s22s22p5 Cl0 - 1s22s22p63s23p5 число протонов и электронов одинаковое количество, атом нейтрален.
АТОМЫ Na0 - 1s22s22p63s1 Mg0 - 1s22s22p63s2 F0 - 1s22s22p5 Cl0 - 1s22s22p63s23p5 число протонов и электронов одинаковое количество, атом нейтрален.
Cлайд 3
 ИОНЫ Na1+ - 1s22s22p63s0 Mg2+ - 1s22s22p63s0 F1- - 1s22s22p6 Cl1- - 1s22s22p63s23p6 Число протонов и электронов разное – это ионы.
ИОНЫ Na1+ - 1s22s22p63s0 Mg2+ - 1s22s22p63s0 F1- - 1s22s22p6 Cl1- - 1s22s22p63s23p6 Число протонов и электронов разное – это ионы.
Cлайд 4
 ИОНЫ – заряженные частицы, которые образуются в результате присоединения или отдачи электронов. Если е - отдаются – ион заряжается положительно. Если е - присоединяются – ион заряжается отрицательно.
ИОНЫ – заряженные частицы, которые образуются в результате присоединения или отдачи электронов. Если е - отдаются – ион заряжается положительно. Если е - присоединяются – ион заряжается отрицательно.
Cлайд 5
 ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ЭО атома, условная величина, характеризующая способность атома в молекуле притягивать электроны. ЭО в периоде увеличивается ЭО в группе возрастает САМЫЙ электроотрицательный элемент фтор.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ЭО атома, условная величина, характеризующая способность атома в молекуле притягивать электроны. ЭО в периоде увеличивается ЭО в группе возрастает САМЫЙ электроотрицательный элемент фтор.
Cлайд 6
 Ионная связь образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому. ИОННАЯ СВЯЗЬ, образуемая в результате электростатического притяжения. Например: Na1+ и Cl1-, Li1+ и F1- •• Na1+ + Cl1- = Na( :Cl:) • •
Ионная связь образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому. ИОННАЯ СВЯЗЬ, образуемая в результате электростатического притяжения. Например: Na1+ и Cl1-, Li1+ и F1- •• Na1+ + Cl1- = Na( :Cl:) • •
Cлайд 7
 Физические свойства веществ с ионным типом связи: твердые, тугоплавкие, не имеющие запаха, часто хорошо растворимые в воде. Вещества с ионном связью, образуют ионную кристаллическую решетку.
Физические свойства веществ с ионным типом связи: твердые, тугоплавкие, не имеющие запаха, часто хорошо растворимые в воде. Вещества с ионном связью, образуют ионную кристаллическую решетку.
Cлайд 8
 Металлическая связь возникает в результате движения свободных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами.
Металлическая связь возникает в результате движения свободных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами.
Cлайд 9
 Физические свойства. Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Образуя единое электронное облако («электронный газ»). Электроны обладают свойствами волны, они «размазаны» по всему куску металла. В этом типе связи электроны обусловливают высокую тепло- и электропроводность, металлический блеск
Физические свойства. Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Образуя единое электронное облако («электронный газ»). Электроны обладают свойствами волны, они «размазаны» по всему куску металла. В этом типе связи электроны обусловливают высокую тепло- и электропроводность, металлический блеск
Cлайд 10
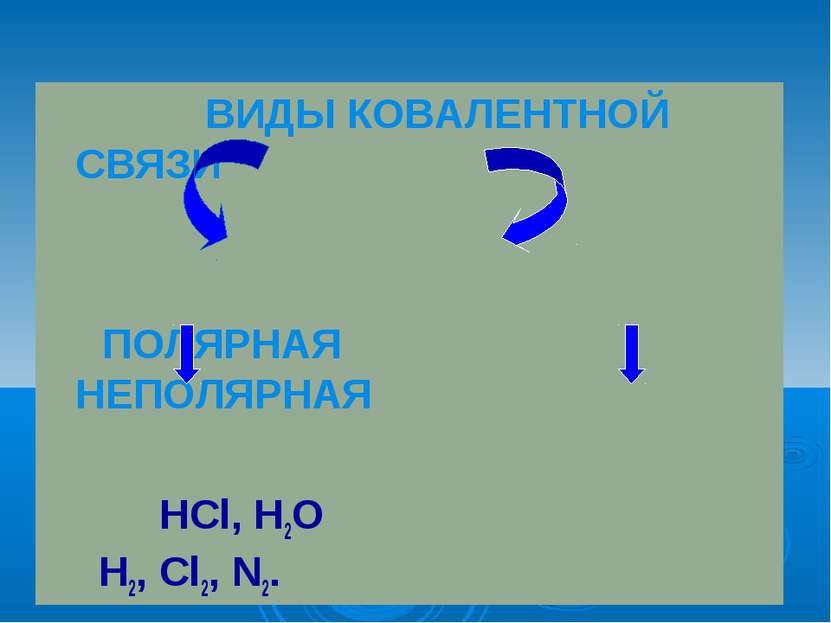
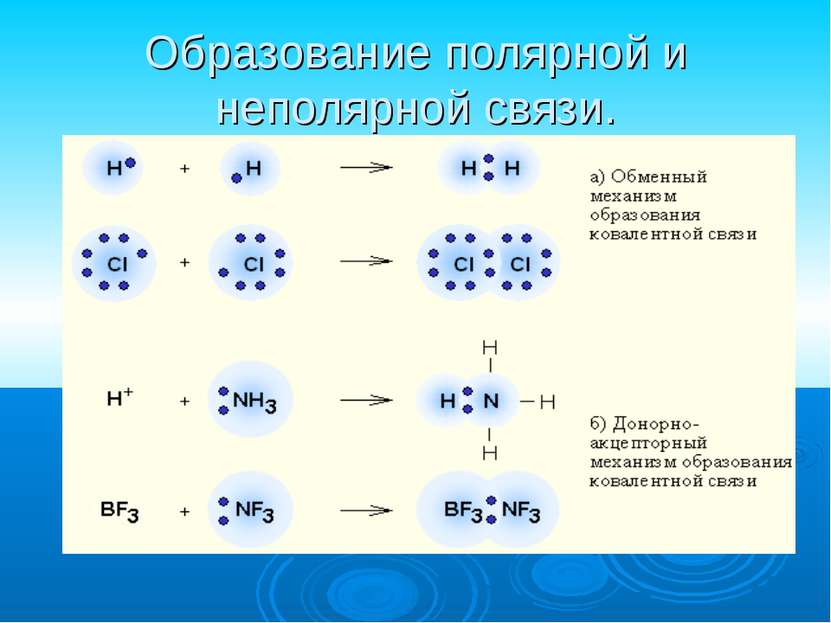
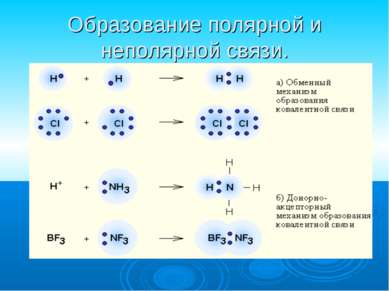
 Ковалентная связь наиболее общий вид химической связи, возникающий за счет образования общей электронной пары обменный механизм - когда каждый из взаимодействующих атомов поставляет по одному электрону донорно-акцепторный механизм - электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Ковалентная связь наиболее общий вид химической связи, возникающий за счет образования общей электронной пары обменный механизм - когда каждый из взаимодействующих атомов поставляет по одному электрону донорно-акцепторный механизм - электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Cлайд 13
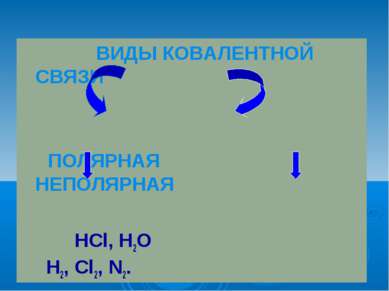
 Ковалентная полярная связь образуется между атомами различных неметаллов. Схема образования ковалентной полярной связи: •• •• H* + •Cl:=H : Cl: •• ••
Ковалентная полярная связь образуется между атомами различных неметаллов. Схема образования ковалентной полярной связи: •• •• H* + •Cl:=H : Cl: •• ••
Cлайд 14
 ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ (SiO2). Они состоят из атомов, связанных друг с другом в бесконечный трехмерный каркас. Атомный каркас обладает высокой прочностью. Кристаллы твердые, тугоплавкие, без запаха, в воде нерастворимы.
ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ (SiO2). Они состоят из атомов, связанных друг с другом в бесконечный трехмерный каркас. Атомный каркас обладает высокой прочностью. Кристаллы твердые, тугоплавкие, без запаха, в воде нерастворимы.
Cлайд 15
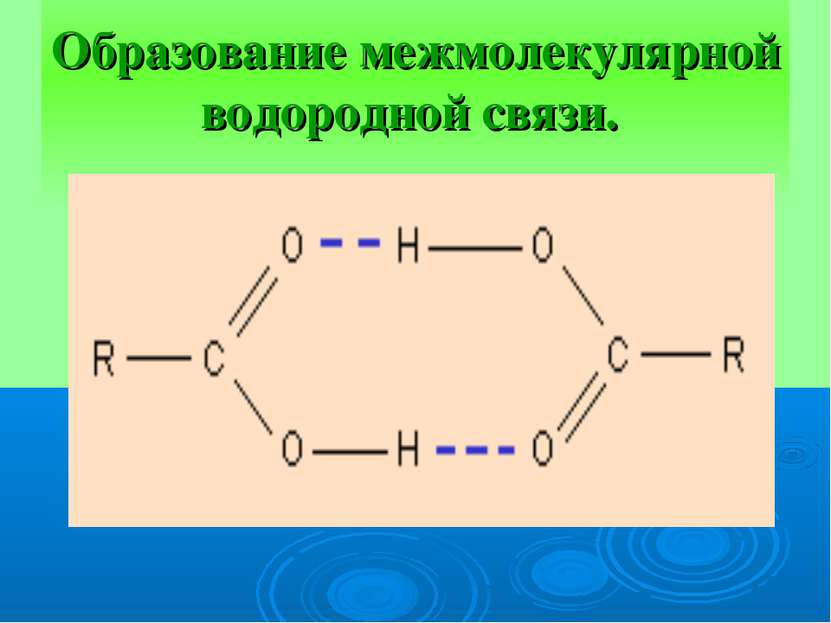
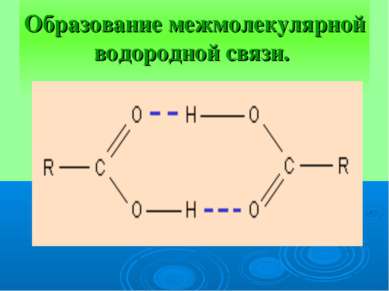
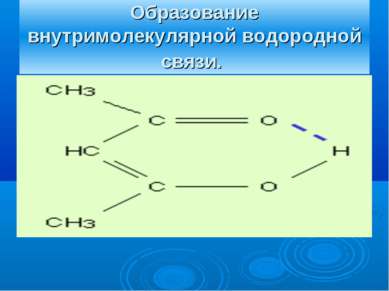
 ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ В УЗЛАХ – НАХОДЯТСЯ МОЛЕКУЛЫ. УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ СИЛАМИ. ВЕЩЕСТВА ЛЕГКОПЛАВКИ, ЧАСТО ИМЕЮТ ЗАПАХ. ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРЕДСТАВЛЯЮТ СОБОЙ ЖИДКОСТИ (ВОДА,БРОМ), ГАЗЫ (КИСЛОРОД, АЗОТ) ИЛИ ЛЕГКОПЛАВКИЕ ТВЕРДЫЕ ВЕЩЕСТВА (ИОД, СЕРА)
ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ В УЗЛАХ – НАХОДЯТСЯ МОЛЕКУЛЫ. УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ СИЛАМИ. ВЕЩЕСТВА ЛЕГКОПЛАВКИ, ЧАСТО ИМЕЮТ ЗАПАХ. ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ ПРЕДСТАВЛЯЮТ СОБОЙ ЖИДКОСТИ (ВОДА,БРОМ), ГАЗЫ (КИСЛОРОД, АЗОТ) ИЛИ ЛЕГКОПЛАВКИЕ ТВЕРДЫЕ ВЕЩЕСТВА (ИОД, СЕРА)