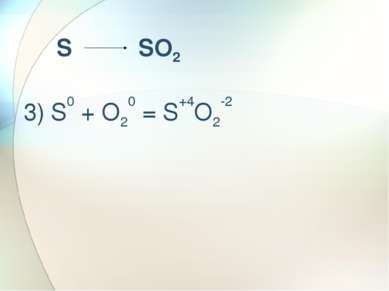X
Код презентации скопируйте его
Серная кислота
Скачать эту презентациюПрезентация на тему Серная кислота
Скачать эту презентациюCлайд 1
 Серная кислота (к рабочей тетради О.Г. Габриеляна «Химия- 9 класс» Составитель: Малышева А.А. -учитель химии высшей категории «МАОУ гимназия № 1»
Серная кислота (к рабочей тетради О.Г. Габриеляна «Химия- 9 класс» Составитель: Малышева А.А. -учитель химии высшей категории «МАОУ гимназия № 1»
Cлайд 21
 Задачи урока -изучить свойства разбавленной серной кислоты -изучить свойства концентрированной серной кислоты установить взаимосвязь свойств кислоты и областей её применения
Задачи урока -изучить свойства разбавленной серной кислоты -изучить свойства концентрированной серной кислоты установить взаимосвязь свойств кислоты и областей её применения
Cлайд 23
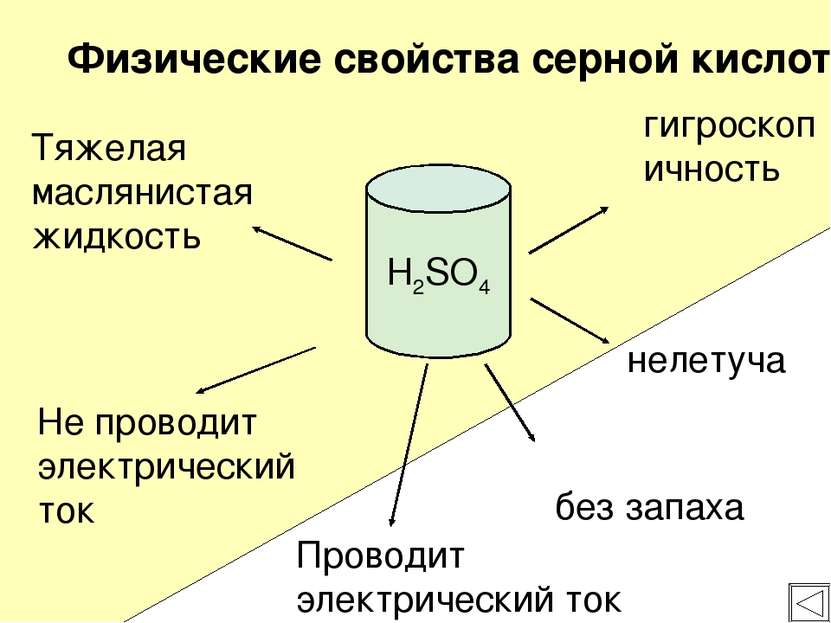
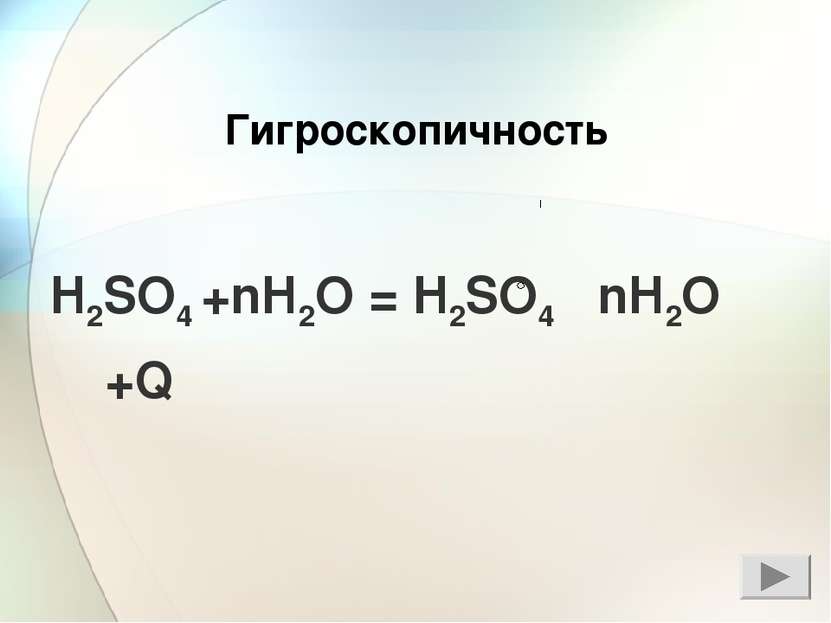
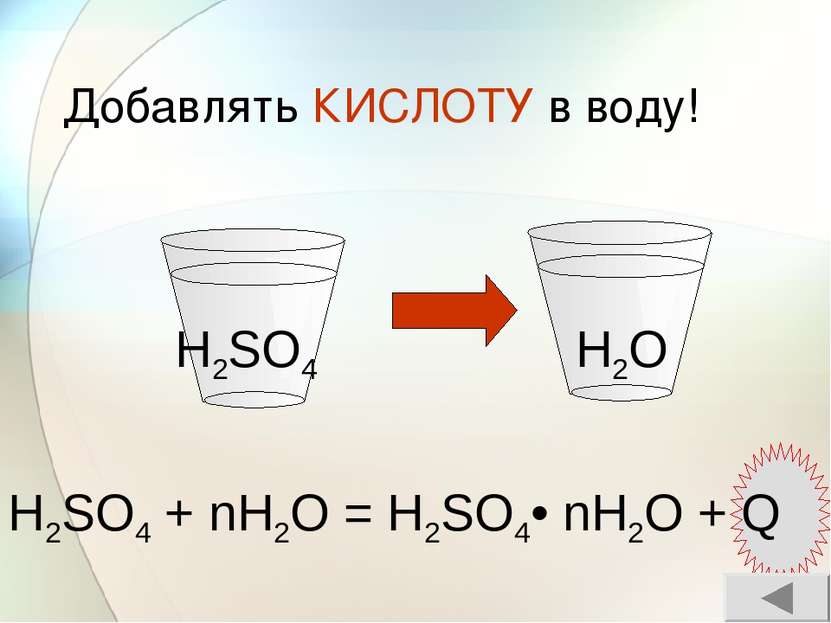
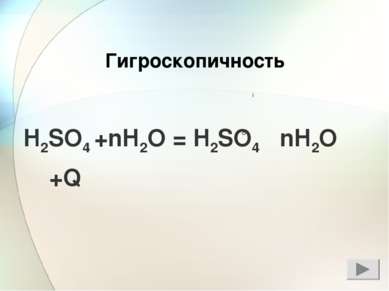
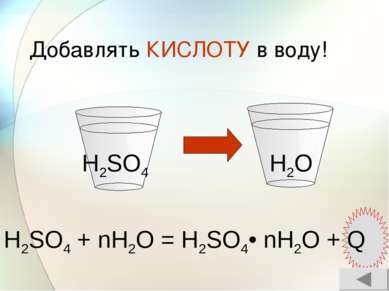
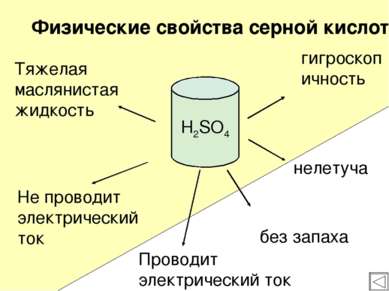 Тяжелая маслянистая жидкость без запаха Не проводит электрический ток гигроскопичность нелетуча Физические свойства серной кислоты H2SO4 Проводит электрический ток
Тяжелая маслянистая жидкость без запаха Не проводит электрический ток гигроскопичность нелетуча Физические свойства серной кислоты H2SO4 Проводит электрический ток
Cлайд 26
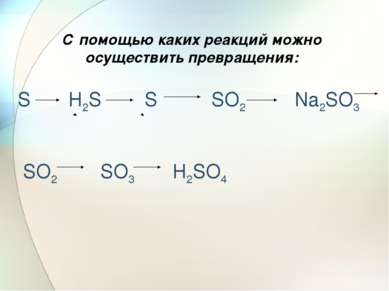
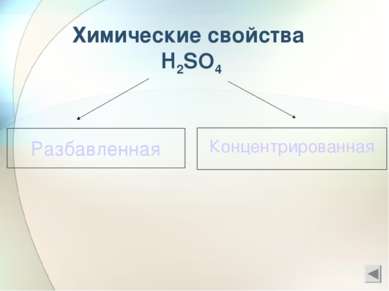
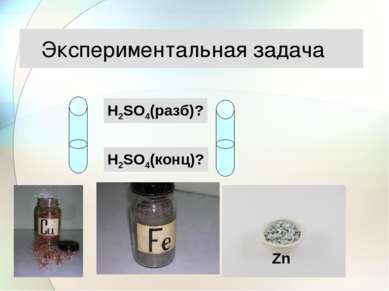
 Химические свойства разбавленной серной кислоты 1) С основаниями 2) С основными оксидами 3) С растворами солей ( качественная реакция) 4)С металлами ,стоящими в ряду активности до водорода ( исключение- свинец)
Химические свойства разбавленной серной кислоты 1) С основаниями 2) С основными оксидами 3) С растворами солей ( качественная реакция) 4)С металлами ,стоящими в ряду активности до водорода ( исключение- свинец)
Cлайд 28
 Взаимодействие разбавленной серной кислоты с основными оксидами 3H2SO4 + Fe2O3 = Fe2(SO4)3 +3H2O
Взаимодействие разбавленной серной кислоты с основными оксидами 3H2SO4 + Fe2O3 = Fe2(SO4)3 +3H2O
Cлайд 29
 Взаимодействие разбавленной серной кислоты с растворами солей H2SO4 + Na2CO3 = CO2 +H2O +Na2SO4
Взаимодействие разбавленной серной кислоты с растворами солей H2SO4 + Na2CO3 = CO2 +H2O +Na2SO4
Cлайд 30
 КАЧЕСТВЕННЫЕ РЕАКЦИИ - это реакции, с помощью которых распознают определенные химические вещества
КАЧЕСТВЕННЫЕ РЕАКЦИИ - это реакции, с помощью которых распознают определенные химические вещества
Cлайд 33
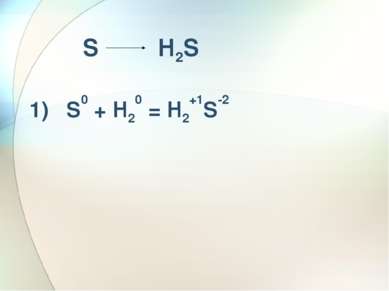
 Zn0 +H2+1SO4 = Zn+2SO4 +H20 ОКИСЛИТЕЛЬ - Н+ Взаимодействие разбавленной серной кислоты с металлами
Zn0 +H2+1SO4 = Zn+2SO4 +H20 ОКИСЛИТЕЛЬ - Н+ Взаимодействие разбавленной серной кислоты с металлами
Cлайд 35
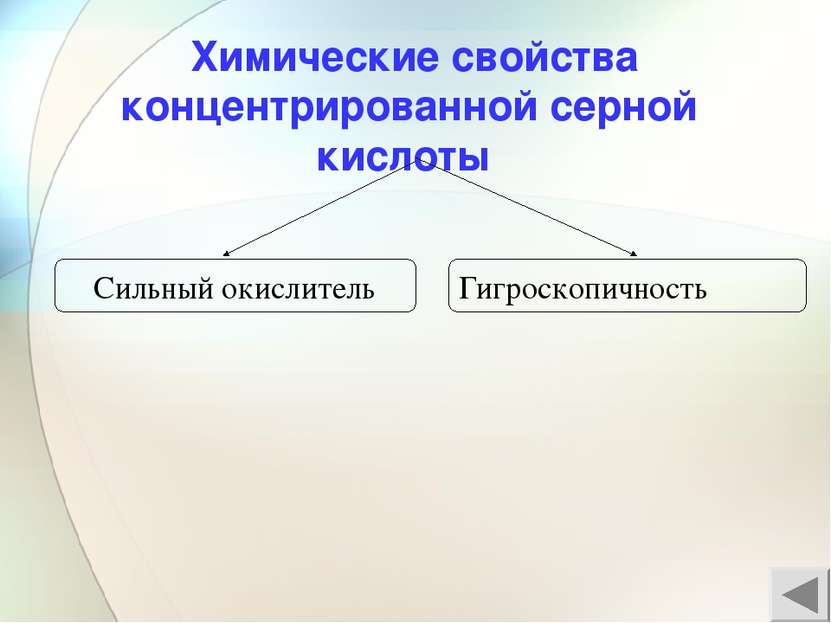
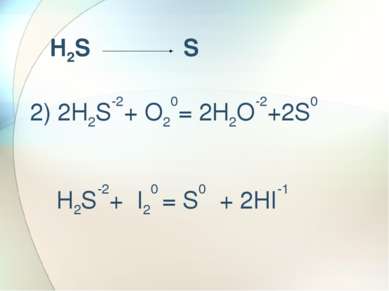
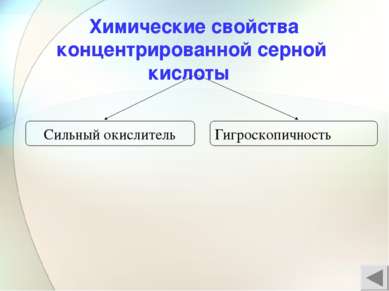
 Сильный окислитель а) H2S+6O4 + Mg0 = H2S-2 + Mg+2SO4 + Н2О б) H2S+6O4 + Zn0 = S0 + Zn+2SO4 + Н2О в) H2S+6O4 + Cu0 = S+4O2 + Cu+2SO4 + Н2О г) C0 +2H2S+6O4 = C+4O2 +2S+4O2 + 2H2O ОКИСЛИТЕЛЬ – S+6O4
Сильный окислитель а) H2S+6O4 + Mg0 = H2S-2 + Mg+2SO4 + Н2О б) H2S+6O4 + Zn0 = S0 + Zn+2SO4 + Н2О в) H2S+6O4 + Cu0 = S+4O2 + Cu+2SO4 + Н2О г) C0 +2H2S+6O4 = C+4O2 +2S+4O2 + 2H2O ОКИСЛИТЕЛЬ – S+6O4
Cлайд 36
 Обугливание сахара концентрированной серной кислотой C11H22O11 + H2SO4 = 12C + H2SO4 . 11 H2O + SO2
Обугливание сахара концентрированной серной кислотой C11H22O11 + H2SO4 = 12C + H2SO4 . 11 H2O + SO2
Cлайд 53
 ПРОВЕРЯЕМ 5H2S+6O4+ 4Mg0 = 4 Mg+2SO4 + H2S2 -+4H2O Ок-ль S+6 + 8е S-2 1 восстановл. 8 В-ль Mg0 – 2е Mg+2 4 окисление
ПРОВЕРЯЕМ 5H2S+6O4+ 4Mg0 = 4 Mg+2SO4 + H2S2 -+4H2O Ок-ль S+6 + 8е S-2 1 восстановл. 8 В-ль Mg0 – 2е Mg+2 4 окисление
Cлайд 54
 ПРОВЕРЯЕМ 4H2S+6O4 +3 Zn0 3 Zn+2SO4 + 4H2O + S0 Ок-ль S+6 +6е S0 1 восстановл. 6 В-ль Zn0 – 2е Zn+2 3 окисление
ПРОВЕРЯЕМ 4H2S+6O4 +3 Zn0 3 Zn+2SO4 + 4H2O + S0 Ок-ль S+6 +6е S0 1 восстановл. 6 В-ль Zn0 – 2е Zn+2 3 окисление