X
Код презентации скопируйте его
Серная кислота
Скачать эту презентациюПрезентация на тему Серная кислота
Скачать эту презентациюCлайд 2
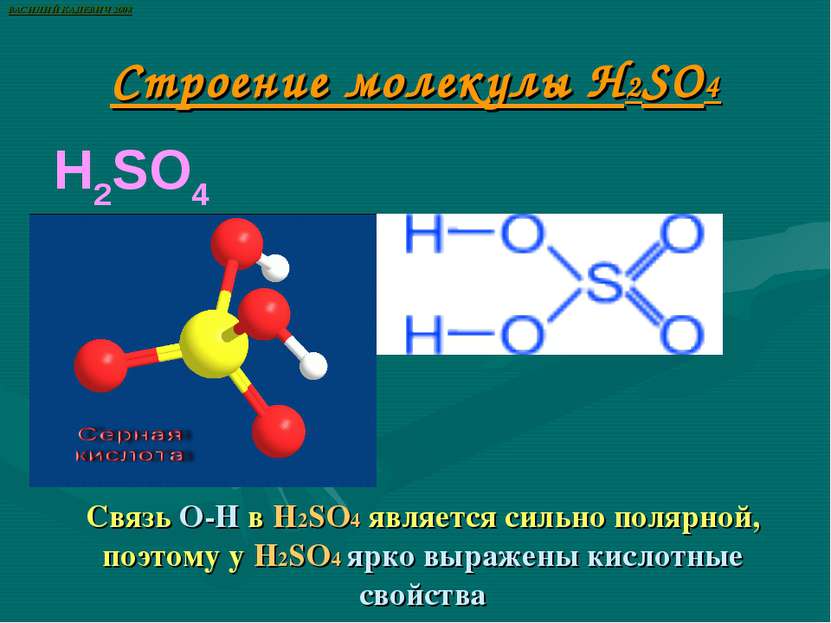
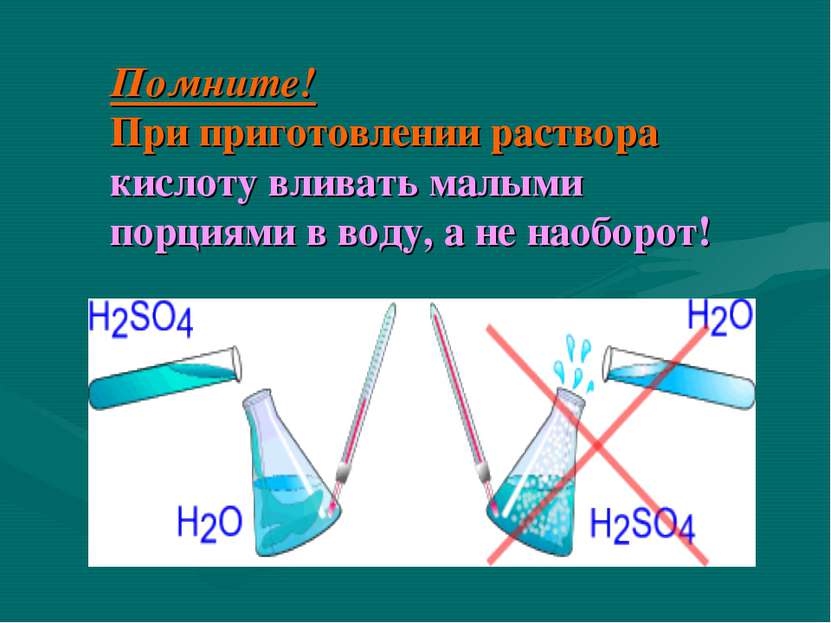
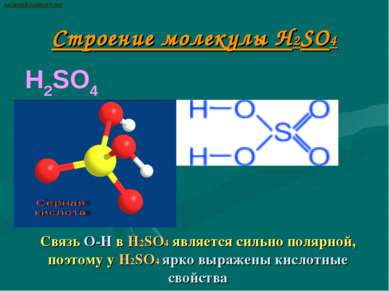 Строение молекулы H2SO4 H2SO4 Связь О-Н в H2SO4 является сильно полярной, поэтому у H2SO4 ярко выражены кислотные свойства ВАСИЛИЙ КАДЕВИЧ 2008
Строение молекулы H2SO4 H2SO4 Связь О-Н в H2SO4 является сильно полярной, поэтому у H2SO4 ярко выражены кислотные свойства ВАСИЛИЙ КАДЕВИЧ 2008
Cлайд 3
 Производство серной кислоты 1-я стадия. Печь для обжига колчедана. 4FeS2 + 11O2 => 2Fe2O3 + 8SO2 + Q 2-я стадия. Окисление сернистого газа до серного ангидрида (450°С – 500°С; катализатор V2O5): 2SO2 + O2 2SO3 3-я стадия. Поглощение серного ангидрида nSO3 + H2SO4(конц)=>(H2SO4 • nSO3)(олеум) ВАСИЛИЙ КАДЕВИЧ 2008
Производство серной кислоты 1-я стадия. Печь для обжига колчедана. 4FeS2 + 11O2 => 2Fe2O3 + 8SO2 + Q 2-я стадия. Окисление сернистого газа до серного ангидрида (450°С – 500°С; катализатор V2O5): 2SO2 + O2 2SO3 3-я стадия. Поглощение серного ангидрида nSO3 + H2SO4(конц)=>(H2SO4 • nSO3)(олеум) ВАСИЛИЙ КАДЕВИЧ 2008
Cлайд 4
 Физические свойства Тяжелая маслянистая жидкость ("купоросное масло"); p = 1,84 г/см3; Нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, Очень гигроскопична, обладает водоотнимающими свойствами ВАСИЛИЙ КАДЕВИЧ 2008
Физические свойства Тяжелая маслянистая жидкость ("купоросное масло"); p = 1,84 г/см3; Нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, Очень гигроскопична, обладает водоотнимающими свойствами ВАСИЛИЙ КАДЕВИЧ 2008
Cлайд 5
 Химические свойства H2SO4 - сильная двухосновная кислота H2SO4 H+ + HSO4- 2H+ + SO42- 1) Взаимодействие с металлами: разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода: Zn0 + H2+1SO4(разб) => Zn+2SO4 + H2 2) с основными оксидами: CuO + H2SO4 => CuSO4 + H2O CuO + 2H+ => Cu2+ + H2O ВАСИЛИЙ КАДЕВИЧ 2008
Химические свойства H2SO4 - сильная двухосновная кислота H2SO4 H+ + HSO4- 2H+ + SO42- 1) Взаимодействие с металлами: разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода: Zn0 + H2+1SO4(разб) => Zn+2SO4 + H2 2) с основными оксидами: CuO + H2SO4 => CuSO4 + H2O CuO + 2H+ => Cu2+ + H2O ВАСИЛИЙ КАДЕВИЧ 2008
Cлайд 6
 3) с основаниями: H2SO4 + 2NaOH => Na2SO4 + 2H2O H+ + OH- => H2O H2SO4 + Cu(OH)2 => CuSO4 + 2H2O 2H+ + Cu(OH)2 => Cu2+ + 2H2O 4) обменные реакции с солями: MgCO3 + H2SO4 => MgSO4 +H2O + CO2 MgCO3 + 2H+ => Mg2+ + H2O + CO2 BaCl2 + H2SO4 => BaSO4↓ + 2HCl Ba2+ + SO42- => BaSO4↓ Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов. ВАСИЛИЙ КАДЕВИЧ 2008
3) с основаниями: H2SO4 + 2NaOH => Na2SO4 + 2H2O H+ + OH- => H2O H2SO4 + Cu(OH)2 => CuSO4 + 2H2O 2H+ + Cu(OH)2 => Cu2+ + 2H2O 4) обменные реакции с солями: MgCO3 + H2SO4 => MgSO4 +H2O + CO2 MgCO3 + 2H+ => Mg2+ + H2O + CO2 BaCl2 + H2SO4 => BaSO4↓ + 2HCl Ba2+ + SO42- => BaSO4↓ Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов. ВАСИЛИЙ КАДЕВИЧ 2008
Cлайд 7
 ВАСИЛИЙ КАДЕВИЧ 2008 5) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют с Fe; Al, Cr - пассивируются): 2Ag0 + 2H2 +6SO4 => Ag2+1SO4 + S+4O2 + 2H2O 8Na0 + 5H2 +6SO4 => 4Na2+1SO4 + H2S-2 + 4H2O Чем более активен металл, тем более полно восстанавливается сера
ВАСИЛИЙ КАДЕВИЧ 2008 5) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют с Fe; Al, Cr - пассивируются): 2Ag0 + 2H2 +6SO4 => Ag2+1SO4 + S+4O2 + 2H2O 8Na0 + 5H2 +6SO4 => 4Na2+1SO4 + H2S-2 + 4H2O Чем более активен металл, тем более полно восстанавливается сера
Cлайд 8
 6) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2): С0 + 2H2S+6O4(конц) => C+4O2 + 2S+4O2 + 2H2O S0 + 2H2S+6O4(конц) => 3S+4O2 + 2H2O 2P0 + 5H2S+6O4(конц) => 5S+4O2 + 2H3P+5O4 + 2H2O ВАСИЛИЙ КАДЕВИЧ 2008
6) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2): С0 + 2H2S+6O4(конц) => C+4O2 + 2S+4O2 + 2H2O S0 + 2H2S+6O4(конц) => 3S+4O2 + 2H2O 2P0 + 5H2S+6O4(конц) => 5S+4O2 + 2H3P+5O4 + 2H2O ВАСИЛИЙ КАДЕВИЧ 2008
Cлайд 9
 6) Гигроскопичность серной кислоты Концентрированная серная кислота жадно набирает воду отовсюду, образуя гидраты, и способна для этого даже разрушать молекулы. Древесина состоит из множества органических веществ, среди которых – целлюлоза (C6H7O2(OH)3)n . Концентрированная серная кислота разрушает органические молекулы, отнимая водород и кислород – составляющие воды. Разрушение органических молекул сопровождается выделением свободного углерода. Поэтому лучинка при соприкосновении с концентрированной серной кислотой чернеет, обугливается. Кислота ведет себя, как обезвоживающий агент. ВАСИЛИЙ КАДЕВИЧ 2008
6) Гигроскопичность серной кислоты Концентрированная серная кислота жадно набирает воду отовсюду, образуя гидраты, и способна для этого даже разрушать молекулы. Древесина состоит из множества органических веществ, среди которых – целлюлоза (C6H7O2(OH)3)n . Концентрированная серная кислота разрушает органические молекулы, отнимая водород и кислород – составляющие воды. Разрушение органических молекул сопровождается выделением свободного углерода. Поэтому лучинка при соприкосновении с концентрированной серной кислотой чернеет, обугливается. Кислота ведет себя, как обезвоживающий агент. ВАСИЛИЙ КАДЕВИЧ 2008
Cлайд 13
 В природе встречается 180 минералов сульфатов, и на их долю приходится ~0,5 % массы земной коры. Их даже много и в морской воде, особенно в лагунах по берегам морей. Много сульфатов и в горячих водных растворах, просачивающихся из глубин Земли.
В природе встречается 180 минералов сульфатов, и на их долю приходится ~0,5 % массы земной коры. Их даже много и в морской воде, особенно в лагунах по берегам морей. Много сульфатов и в горячих водных растворах, просачивающихся из глубин Земли.
Cлайд 15
 Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения, произошедшего незаметно для людей. Тот, кто сумел достичь его подножия, просто обязан подняться на кромку кратера. Зрелище, которое открывается глазам, незабываемо: двухсотметровый провал кратера, дымящееся зеленое озеро, буйство красок на внутренних стенках. В ясную ветреную погоду можно спуститься в кратер. Это обитель «подземных духов» Это одно из чудес камчатской природы
Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения, произошедшего незаметно для людей. Тот, кто сумел достичь его подножия, просто обязан подняться на кромку кратера. Зрелище, которое открывается глазам, незабываемо: двухсотметровый провал кратера, дымящееся зеленое озеро, буйство красок на внутренних стенках. В ясную ветреную погоду можно спуститься в кратер. Это обитель «подземных духов» Это одно из чудес камчатской природы
Cлайд 16
 Серная кислота – очень активная жидкость, особенно концентрированная, которая реагирует со многими неорганическими веществами, также она легко действует на органические соединения: обугливает бумагу, сахар, древесину, т.е. соединения, которые содержат в себе углерод. Хранят ее в стеклянной таре, а перевозят в стальных цистернах
Серная кислота – очень активная жидкость, особенно концентрированная, которая реагирует со многими неорганическими веществами, также она легко действует на органические соединения: обугливает бумагу, сахар, древесину, т.е. соединения, которые содержат в себе углерод. Хранят ее в стеклянной таре, а перевозят в стальных цистернах
Cлайд 17
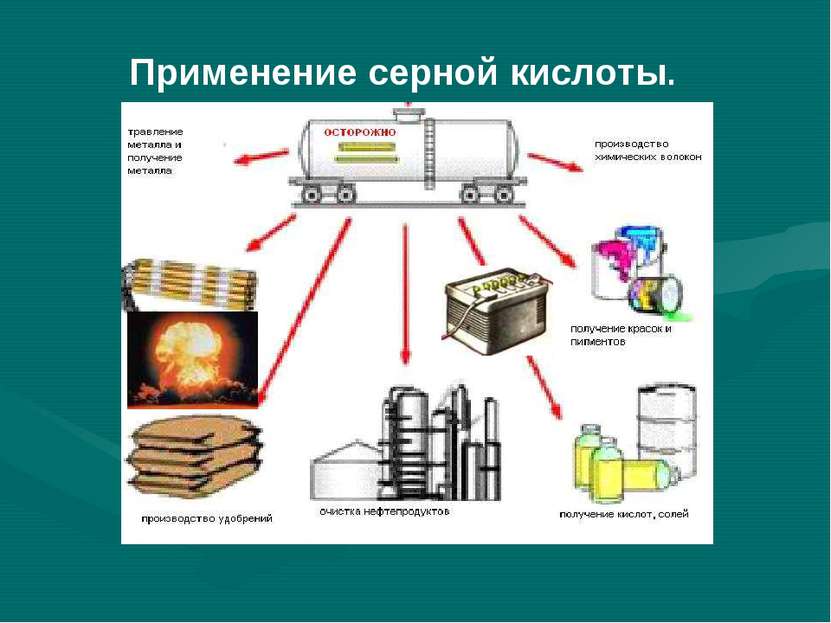
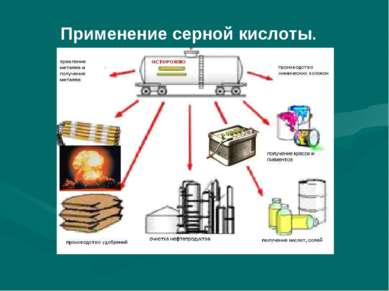
 ВАСИЛИЙ КАДЕВИЧ 2008 Применение H2SO4 В производстве пластмассы В производстве синтетического волокна В средствах защиты растений В моющих средствах В лекарствах В красителях и пигментах В производстве взрывчатых веществ Электролит в аккумуляторах В очистке нефтепродуктов В получении солей и кислот В металлургии В минеральных удобрениях
ВАСИЛИЙ КАДЕВИЧ 2008 Применение H2SO4 В производстве пластмассы В производстве синтетического волокна В средствах защиты растений В моющих средствах В лекарствах В красителях и пигментах В производстве взрывчатых веществ Электролит в аккумуляторах В очистке нефтепродуктов В получении солей и кислот В металлургии В минеральных удобрениях
Cлайд 22
 СОЛИ СЕРНОЙ КИСЛОТЫ CaSO4• 2H2O - гипс CaSO4• 0,5H2O - алебастр CuSO4• 5H2O – медный купорос Na2SO4• 10H2O – мирабилит (глауберова соль) MgSO4• 7H2O – горькая соль К2SO4• Al2(SO4)3 • 24H2O – алюмокалиевые квасцы
СОЛИ СЕРНОЙ КИСЛОТЫ CaSO4• 2H2O - гипс CaSO4• 0,5H2O - алебастр CuSO4• 5H2O – медный купорос Na2SO4• 10H2O – мирабилит (глауберова соль) MgSO4• 7H2O – горькая соль К2SO4• Al2(SO4)3 • 24H2O – алюмокалиевые квасцы
Cлайд 23
 Домашнее задание Составьте инструкцию по правилам обращения с серной кислотой • для лаборанта кабинета химии; • для автолюбителя, который собирается приготовить раствор серной кислоты в качестве электролита для аккумулятора своего авто; • для хозяйки, которая в магазине «Хозтовары» покупает концентрированную серную кислоту для и планирует почистить ею ванну, чайник от известкового налета. Изучить § 34, упражнения 3,8,10 стр. 223 .
Домашнее задание Составьте инструкцию по правилам обращения с серной кислотой • для лаборанта кабинета химии; • для автолюбителя, который собирается приготовить раствор серной кислоты в качестве электролита для аккумулятора своего авто; • для хозяйки, которая в магазине «Хозтовары» покупает концентрированную серную кислоту для и планирует почистить ею ванну, чайник от известкового налета. Изучить § 34, упражнения 3,8,10 стр. 223 .
Cлайд 24
 Лабораторный опыт № 7 Исследование химических свойств раствора серной кислоты ВНИМАНИЕ ! При работе с кислотой будьте осторожны. При попадании на руки тщательно вымойте их водой, при необходимости - нейтрализуйте раствором соды.
Лабораторный опыт № 7 Исследование химических свойств раствора серной кислоты ВНИМАНИЕ ! При работе с кислотой будьте осторожны. При попадании на руки тщательно вымойте их водой, при необходимости - нейтрализуйте раствором соды.
Cлайд 25
 В пробирках в виде растворов представлены вещества: NaCl, NaBr, NaI, NaF, H2SO4, Na2CO3, Na2SO4, NaOH Предложите план идентификации данных веществ. Укажите качественную реакцию на серную кислоту и ее соли
В пробирках в виде растворов представлены вещества: NaCl, NaBr, NaI, NaF, H2SO4, Na2CO3, Na2SO4, NaOH Предложите план идентификации данных веществ. Укажите качественную реакцию на серную кислоту и ее соли
Cлайд 26
 Если эти утверждения верны на Ваш взгляд, то напротив них поставьте знак «+», а если нет, то знак «-» 1. Свойства концентрированной серной кислоты обусловлены тем, что степень окисления серы в ней равна +6 2. Концентрированная серная кислота является восстановителем. 3. Концентрированную серную кислоту нельзя перевозить в стальных цистернах, т.к. в состав стали входит железо 4. Концентрированная серная кислота не взаимодействует с металлами, стоящими после водорода. 5. Концентрированная серная кислота взаимодействует с неметаллами 6. Концентрированная серная кислота диссоциирует практически полностью с образованием ионов водорода и сульфат-ионов. 7. Продукты восстановления серы в серной кислоте могут быть со степенями окисления +4, -2. 8. Алюминий в концентрированной серной кислоте разрушается. 9. На органические вещества концентрированная серная кислота не действует 10. Концентрированная серная кислота может вытеснять другие кислоты из их солей
Если эти утверждения верны на Ваш взгляд, то напротив них поставьте знак «+», а если нет, то знак «-» 1. Свойства концентрированной серной кислоты обусловлены тем, что степень окисления серы в ней равна +6 2. Концентрированная серная кислота является восстановителем. 3. Концентрированную серную кислоту нельзя перевозить в стальных цистернах, т.к. в состав стали входит железо 4. Концентрированная серная кислота не взаимодействует с металлами, стоящими после водорода. 5. Концентрированная серная кислота взаимодействует с неметаллами 6. Концентрированная серная кислота диссоциирует практически полностью с образованием ионов водорода и сульфат-ионов. 7. Продукты восстановления серы в серной кислоте могут быть со степенями окисления +4, -2. 8. Алюминий в концентрированной серной кислоте разрушается. 9. На органические вещества концентрированная серная кислота не действует 10. Концентрированная серная кислота может вытеснять другие кислоты из их солей