X
Код презентации скопируйте его
Водород — химический элемент и простое вещество
Скачать эту презентациюПрезентация на тему Водород — химический элемент и простое вещество
Скачать эту презентациюCлайд 1
 Эпитеты: наипервейший, вездесущий, всемогущий и невидимый Анаграмма Первый слог вещества, которое имеет три агрегатных состояния. Второй слог – первая нота. Третий слог – указывает родство. Тема урока? Генри Кавендиш
Эпитеты: наипервейший, вездесущий, всемогущий и невидимый Анаграмма Первый слог вещества, которое имеет три агрегатных состояния. Второй слог – первая нота. Третий слог – указывает родство. Тема урока? Генри Кавендиш
Cлайд 3
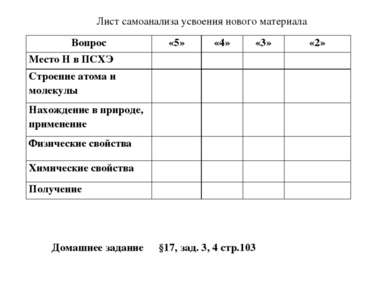
 Составление плана работы Посмотрите структуру параграфа № 17 (с.98-103) и дополните план изучения водорода: 1. Водород – химический элемент: а) положение в ПСХЭ Д.И. Менделеева, б) строение атома. 2. Водород – простое вещество: а) строение молекулы, б) физические свойства, в) химические свойства, г) получение и применение и водорода
Составление плана работы Посмотрите структуру параграфа № 17 (с.98-103) и дополните план изучения водорода: 1. Водород – химический элемент: а) положение в ПСХЭ Д.И. Менделеева, б) строение атома. 2. Водород – простое вещество: а) строение молекулы, б) физические свойства, в) химические свойства, г) получение и применение и водорода
Cлайд 4
 Положение водорода в ПСХЭ Д. И. Менделеева Чтобы определить положение водорода в ПСХЭ, воспользуемся динамической таблицей периодической системы элементов, расположенной по электронному адресу: Ссылка № 1 Открытая техническая библиотека CNCexpert.ru (воспользуемся динамической таблицей периодической системы элементов) http://cncexpert.ru/chemistry/periodic-table.php
Положение водорода в ПСХЭ Д. И. Менделеева Чтобы определить положение водорода в ПСХЭ, воспользуемся динамической таблицей периодической системы элементов, расположенной по электронному адресу: Ссылка № 1 Открытая техническая библиотека CNCexpert.ru (воспользуемся динамической таблицей периодической системы элементов) http://cncexpert.ru/chemistry/periodic-table.php
Cлайд 5
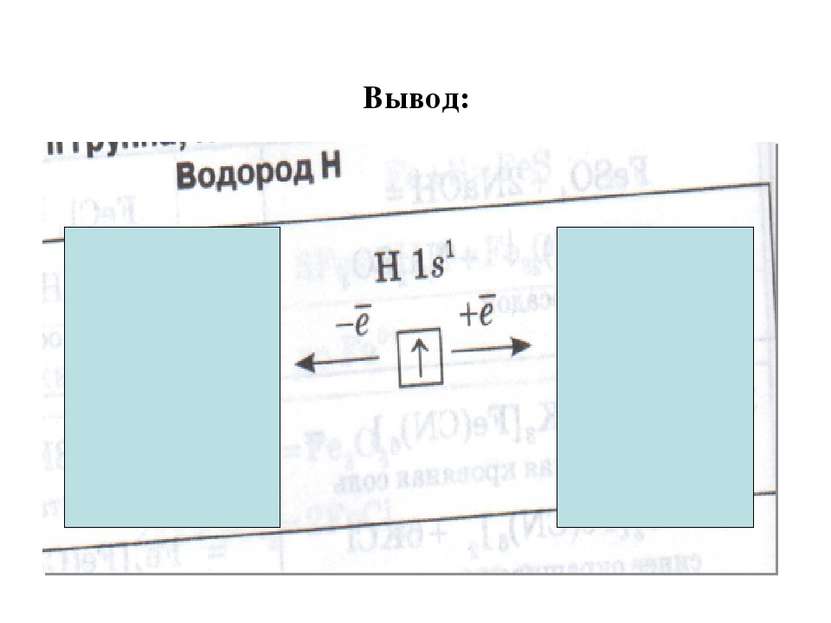
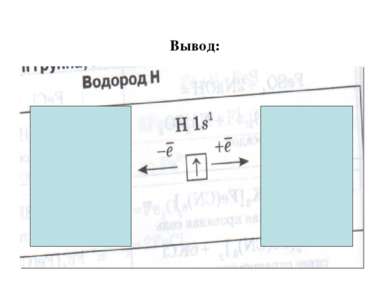
 Вывод: водород- единственный элемент, для которого химики отводят в периодической системе 2 места – да каких! Его записывают в 2 резко противоположные группы химических элементов: - в главной подгруппе 1 группы – подгруппе щелочные металлы в главной подгруппе 7 группы- подгруппе галогены. Возникает вопрос. Почему? Прежде чем сформулировать ответ, посмотрите фрагмент «Модель атома водорода». Для этого перейдите по ссылке № 2 ЦОРы http://school-collection.edu.ru/catalog/search/?text=%E2%EE%E4%EE%F0%EE%E4&tg= В строке найти введите водород, откройте документ № 7 «Модель атома водорода» При затруднении ответить, обратитесь дополнительно к учебнику стр.98
Вывод: водород- единственный элемент, для которого химики отводят в периодической системе 2 места – да каких! Его записывают в 2 резко противоположные группы химических элементов: - в главной подгруппе 1 группы – подгруппе щелочные металлы в главной подгруппе 7 группы- подгруппе галогены. Возникает вопрос. Почему? Прежде чем сформулировать ответ, посмотрите фрагмент «Модель атома водорода». Для этого перейдите по ссылке № 2 ЦОРы http://school-collection.edu.ru/catalog/search/?text=%E2%EE%E4%EE%F0%EE%E4&tg= В строке найти введите водород, откройте документ № 7 «Модель атома водорода» При затруднении ответить, обратитесь дополнительно к учебнику стр.98
Cлайд 7
 Строение молекулы водорода Пользуясь информацией из интернет-энциклопедии Википедия (ссылка № 3) опишите строение молекулы водорода и сделайте в тетради её рисунок Вывод: молекула двухатомна, образована за счет ковалентной неполярной химической связи.
Строение молекулы водорода Пользуясь информацией из интернет-энциклопедии Википедия (ссылка № 3) опишите строение молекулы водорода и сделайте в тетради её рисунок Вывод: молекула двухатомна, образована за счет ковалентной неполярной химической связи.
Cлайд 8
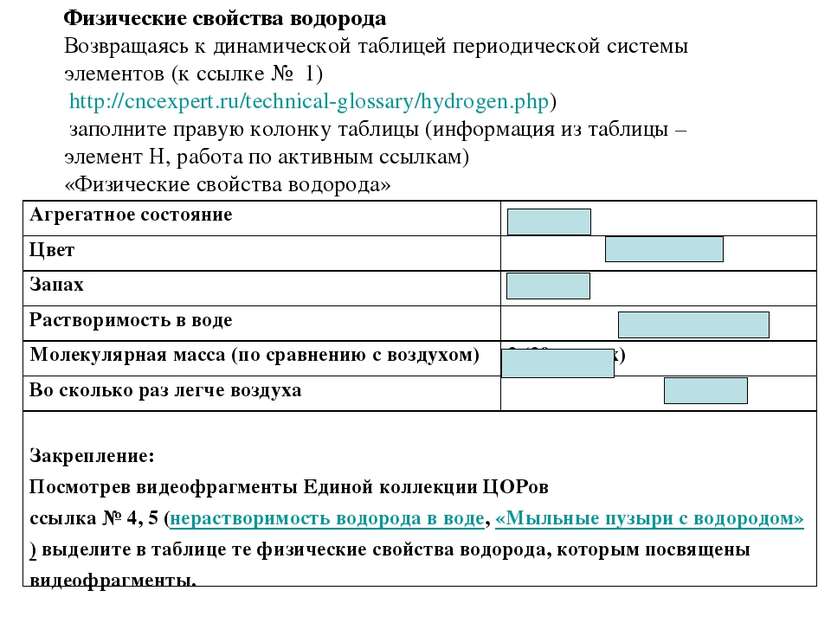
 Физические свойства водорода Возвращаясь к динамической таблицей периодической системы элементов (к ссылке № 1) http://cncexpert.ru/technical-glossary/hydrogen.php) заполните правую колонку таблицы (информация из таблицы – элемент Н, работа по активным ссылкам) «Физические свойства водорода» Агрегатное состояние газ Цвет бесцветный Запах нет Растворимость в воде малорастворим Молекулярная масса (по сравнению с воздухом) 2 (29-воздух) Во сколько раз легче воздуха 14 Закрепление: Посмотрев видеофрагменты Единой коллекции ЦОРов ссылка № 4, 5 (нерастворимость водорода в воде, «Мыльные пузыри с водородом») выделите в таблице те физические свойства водорода, которым посвящены видеофрагменты.
Физические свойства водорода Возвращаясь к динамической таблицей периодической системы элементов (к ссылке № 1) http://cncexpert.ru/technical-glossary/hydrogen.php) заполните правую колонку таблицы (информация из таблицы – элемент Н, работа по активным ссылкам) «Физические свойства водорода» Агрегатное состояние газ Цвет бесцветный Запах нет Растворимость в воде малорастворим Молекулярная масса (по сравнению с воздухом) 2 (29-воздух) Во сколько раз легче воздуха 14 Закрепление: Посмотрев видеофрагменты Единой коллекции ЦОРов ссылка № 4, 5 (нерастворимость водорода в воде, «Мыльные пузыри с водородом») выделите в таблице те физические свойства водорода, которым посвящены видеофрагменты.
Cлайд 9
 Химические свойства водорода Как восстановитель Как окислитель H2-2e=2H+ H2+2e=2H- 2H2 + O2 = 2H2O ссылка № 6 http://school-collection.iv-edu.ru/dlrstore/36fbfc5d-cb25-31b9-808b-36c1e8086a0a/index.htm H2 + 2Na = 2NaH 3H2 + N2 = 2NH3 H2 + Ca = CaH2 H2 + Cl2 = 2HCl В результате образуются гидриды-твердые, солеподобные соединения CuO + H2 = Cu + H2O ссылка № 7 Сhttp://files.school-collection.edu.ru/dlrstore/6350fa30-2229-9816-a557-cfd1f53489ed/index.htm
Химические свойства водорода Как восстановитель Как окислитель H2-2e=2H+ H2+2e=2H- 2H2 + O2 = 2H2O ссылка № 6 http://school-collection.iv-edu.ru/dlrstore/36fbfc5d-cb25-31b9-808b-36c1e8086a0a/index.htm H2 + 2Na = 2NaH 3H2 + N2 = 2NH3 H2 + Ca = CaH2 H2 + Cl2 = 2HCl В результате образуются гидриды-твердые, солеподобные соединения CuO + H2 = Cu + H2O ссылка № 7 Сhttp://files.school-collection.edu.ru/dlrstore/6350fa30-2229-9816-a557-cfd1f53489ed/index.htm
Cлайд 10
 Получение водорода В лаборатории Прочитав инструкцию и посмотрев видеоопыт ссылка № 8 "Получение, собирание, распознавание водорода", проведите самостоятельно этот лабораторный опыт (соблюдая ТБ!), запишите уравнение реакции, где расставите коэффициенты методом электронного баланса и выявите, чем будет являться водород окислителем или восстановителем Zn + 2HCl = ZnCl2 + H2↑
Получение водорода В лаборатории Прочитав инструкцию и посмотрев видеоопыт ссылка № 8 "Получение, собирание, распознавание водорода", проведите самостоятельно этот лабораторный опыт (соблюдая ТБ!), запишите уравнение реакции, где расставите коэффициенты методом электронного баланса и выявите, чем будет являться водород окислителем или восстановителем Zn + 2HCl = ZnCl2 + H2↑
Cлайд 11
 В промышленности Задание по группам: каждой группе необходимо дописать уравнение реакции получения водорода, где расставить коэффициенты методом электронного баланса и выявить, чем будет являться водород окислителем или восстановителем, когда вы это сделаете один учащийся от группы выйдет и закончит УХР на доске 1.Электролиз водных растворов солей: 2NaCl + 2H2O → H2 + 2NaOH + Cl2 2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C: H2O + C ⇔ H2 + CO 3.Из природного газа. Конверсия с водяным паром: CH4 + H2O ⇔ CO + 3H2 (1000°C) Каталитическое окисление кислородом: 2CH4 + O2 ⇔ 2CO + 4H2
В промышленности Задание по группам: каждой группе необходимо дописать уравнение реакции получения водорода, где расставить коэффициенты методом электронного баланса и выявить, чем будет являться водород окислителем или восстановителем, когда вы это сделаете один учащийся от группы выйдет и закончит УХР на доске 1.Электролиз водных растворов солей: 2NaCl + 2H2O → H2 + 2NaOH + Cl2 2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C: H2O + C ⇔ H2 + CO 3.Из природного газа. Конверсия с водяным паром: CH4 + H2O ⇔ CO + 3H2 (1000°C) Каталитическое окисление кислородом: 2CH4 + O2 ⇔ 2CO + 4H2
Cлайд 12
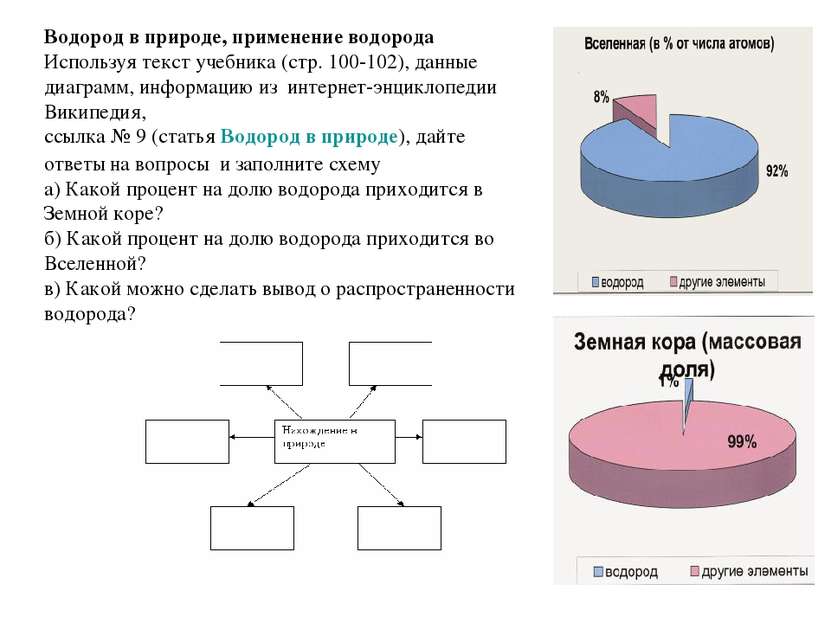
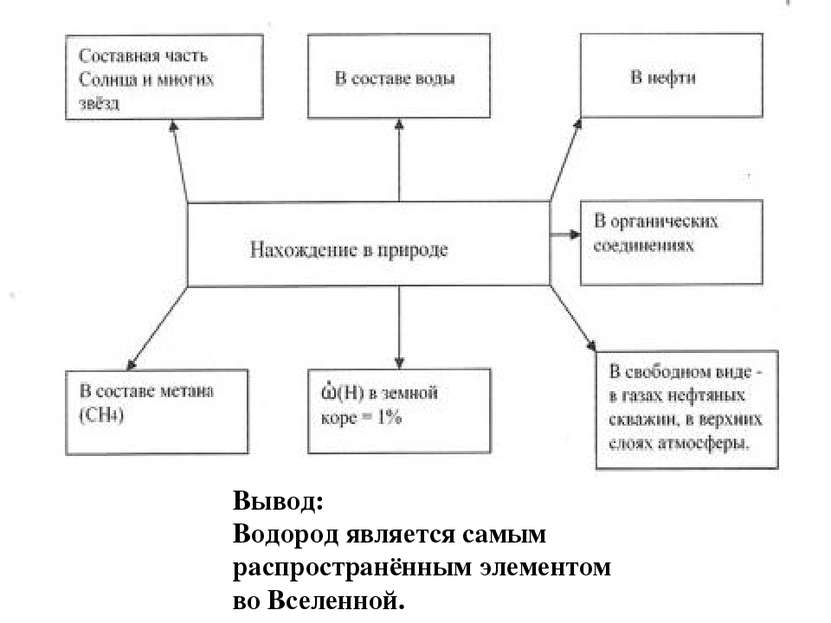
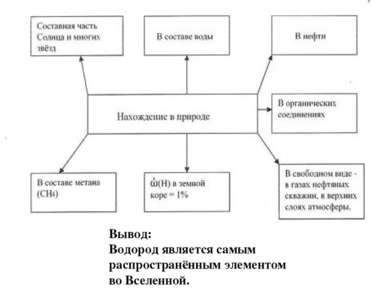
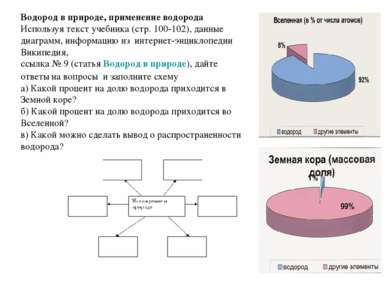 Водород в природе, применение водорода Используя текст учебника (стр. 100-102), данные диаграмм, информацию из интернет-энциклопедии Википедия, ссылка № 9 (статья Водород в природе), дайте ответы на вопросы и заполните схему а) Какой процент на долю водорода приходится в Земной коре? б) Какой процент на долю водорода приходится во Вселенной? в) Какой можно сделать вывод о распространенности водорода?
Водород в природе, применение водорода Используя текст учебника (стр. 100-102), данные диаграмм, информацию из интернет-энциклопедии Википедия, ссылка № 9 (статья Водород в природе), дайте ответы на вопросы и заполните схему а) Какой процент на долю водорода приходится в Земной коре? б) Какой процент на долю водорода приходится во Вселенной? в) Какой можно сделать вывод о распространенности водорода?
Cлайд 14
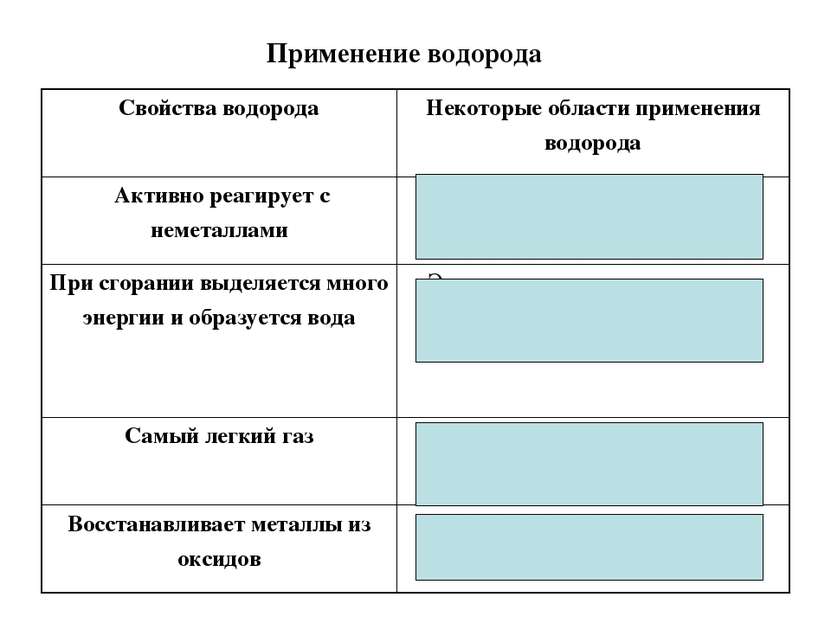
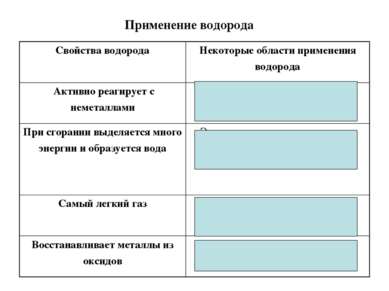 Применение водорода Свойства водорода Некоторые области применения водорода Активно реагирует с неметаллами Производство аммиака, соляной кислоты, органических веществ При сгорании выделяется много энергии и образуется вода Энергетическая промышленность Самый легкий газ Наполнение воздушных шаров и аэростатотов Восстанавливает металлы из оксидов Получение металлов
Применение водорода Свойства водорода Некоторые области применения водорода Активно реагирует с неметаллами Производство аммиака, соляной кислоты, органических веществ При сгорании выделяется много энергии и образуется вода Энергетическая промышленность Самый легкий газ Наполнение воздушных шаров и аэростатотов Восстанавливает металлы из оксидов Получение металлов
Cлайд 15
 Прочитав информацию на слайде презентации ответьте на вопрос: Какое свойство водорода делает его опасным для наполнения аэростатов? Если шар объёмом 22,4 м3 наполнить водородом, то в воздухе он может поднять груз массой 27 кг. В первой половине XX века началось строительство летательных аппаратов большой грузоподъёмности - дирижаблей, которые наполняли водородом. Однако водород - взрывоопасный газ, и в 1930-е гг. с дирижаблями произошло несколько крупных аварий. После этого строительство дирижаблей с водородом во всём мире на многие годы прекратилось.
Прочитав информацию на слайде презентации ответьте на вопрос: Какое свойство водорода делает его опасным для наполнения аэростатов? Если шар объёмом 22,4 м3 наполнить водородом, то в воздухе он может поднять груз массой 27 кг. В первой половине XX века началось строительство летательных аппаратов большой грузоподъёмности - дирижаблей, которые наполняли водородом. Однако водород - взрывоопасный газ, и в 1930-е гг. с дирижаблями произошло несколько крупных аварий. После этого строительство дирижаблей с водородом во всём мире на многие годы прекратилось.