X
Код презентации скопируйте его
Химический элемент - водород
Скачать эту презентациюПрезентация на тему Химический элемент - водород
Скачать эту презентациюCлайд 1
 Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна
Тема урока: «Химический элемент - водород» Подготовила: Михно Валерия 9 «В» класс Учитель: Назаренко Любовь Дмитриевна
Cлайд 2
 Краткая характеристика элемента H 1 1,00794 1s1 Водород Водоро д — первый элемент периодической системы элементов. Широко распространён в природе. Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в ряде металлов: железе, никеле, палладии, платине.
Краткая характеристика элемента H 1 1,00794 1s1 Водород Водоро д — первый элемент периодической системы элементов. Широко распространён в природе. Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в ряде металлов: железе, никеле, палладии, платине.
Cлайд 3
 Происхождение названия Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — «вода» и γενναω — «рождаю») — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с ломоносовским «кислородом».
Происхождение названия Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — «вода» и γενναω — «рождаю») — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с ломоносовским «кислородом».
Cлайд 4
 Распространенность Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре
Распространенность Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре
Cлайд 5
 Химические свойства Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия: Н2 = 2Н − 432 кДж Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция: Ca + Н2 = СаН2 и с единственным неметаллом — фтором, образуя фтороводород: F2 + H2 = 2HF С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении: О2 + 2Н2 = 2Н2О Он может «отнимать» кислород от некоторых оксидов, например: CuO + Н2 = Cu + Н2
Химические свойства Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия: Н2 = 2Н − 432 кДж Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция: Ca + Н2 = СаН2 и с единственным неметаллом — фтором, образуя фтороводород: F2 + H2 = 2HF С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении: О2 + 2Н2 = 2Н2О Он может «отнимать» кислород от некоторых оксидов, например: CuO + Н2 = Cu + Н2
Cлайд 6
 Записанное уравнение отражает восстановительные свойства водорода. N2 + 3H2 → 2NH3 С галогенами образует галогеноводороды: F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету. С сажей взаимодействует при сильном нагревании:
Записанное уравнение отражает восстановительные свойства водорода. N2 + 3H2 → 2NH3 С галогенами образует галогеноводороды: F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету. С сажей взаимодействует при сильном нагревании:
Cлайд 7
 Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2Na + H2 → 2NaH Взаимодействие с оксидами металлов Оксиды восстанавливаются до металлов: CuO + H2 → Cu + H2O
Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2Na + H2 → 2NaH Взаимодействие с оксидами металлов Оксиды восстанавливаются до металлов: CuO + H2 → Cu + H2O
Cлайд 8
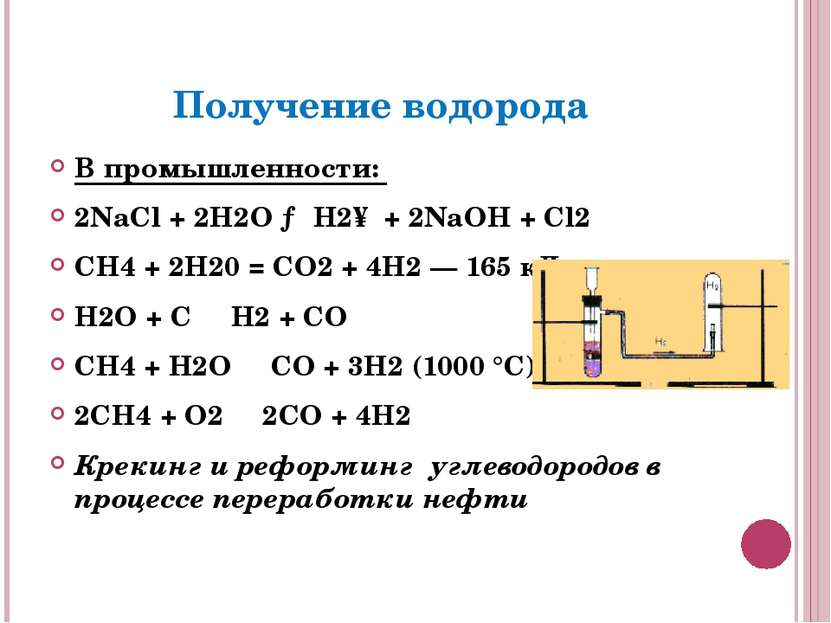
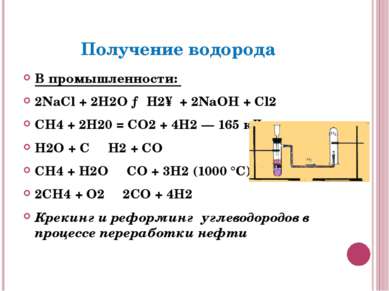 Получение водорода В промышленности: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж H2O + C ⇄ H2 + CO CH4 + H2O ⇄ CO + 3H2 (1000 °C) 2CH4 + O2 ⇄ 2CO + 4H2 Крекинг и реформинг углеводородов в процессе переработки нефти
Получение водорода В промышленности: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж H2O + C ⇄ H2 + CO CH4 + H2O ⇄ CO + 3H2 (1000 °C) 2CH4 + O2 ⇄ 2CO + 4H2 Крекинг и реформинг углеводородов в процессе переработки нефти