X
Код презентации скопируйте его
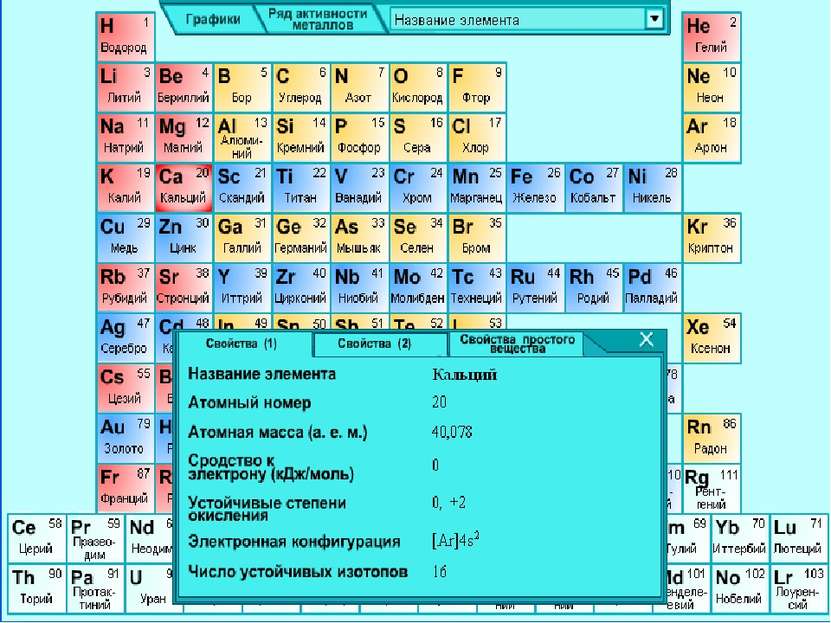
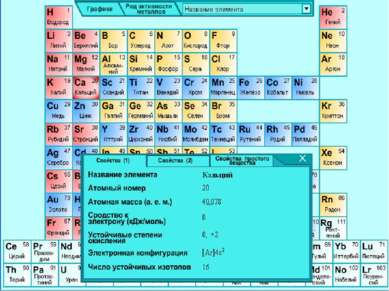
КАЛЬЦИЙ
Скачать эту презентациюПрезентация на тему КАЛЬЦИЙ
Скачать эту презентациюCлайд 2
 Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca 48Ca, из которых наиболее распространен 40Ca (96, 97%).
Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca 48Ca, из которых наиболее распространен 40Ca (96, 97%).
Cлайд 4
 Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием. История и происхождение названия
Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погруженная в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием. История и происхождение названия
Cлайд 5
 В биосфере происходит исключительно резкая дифференциация Ca, связанная главным образом с "карбонатным равновесием": при взаимодействии углекислого газа с карбонатом СаСО3 образуется растворимый бикарбонат Ca(HCO3)2: CaCO3 + H2O + CO2 = Ca(HCO3)2
В биосфере происходит исключительно резкая дифференциация Ca, связанная главным образом с "карбонатным равновесием": при взаимодействии углекислого газа с карбонатом СаСО3 образуется растворимый бикарбонат Ca(HCO3)2: CaCO3 + H2O + CO2 = Ca(HCO3)2
Cлайд 6
 Эта реакция обратима и является основой перераспределения Ca. При высоком содержании CO2 в водах Ca находится в растворе, а при низком содержании CO2 в осадок выпадает минерал кальцит CaCO3, образуя мощные залежи известняка, мела, мрамора.
Эта реакция обратима и является основой перераспределения Ca. При высоком содержании CO2 в водах Ca находится в растворе, а при низком содержании CO2 в осадок выпадает минерал кальцит CaCO3, образуя мощные залежи известняка, мела, мрамора.
Cлайд 14
 Бетон – важнейший строительный материал наших дней, одной из составных частей которого является кальций.
Бетон – важнейший строительный материал наших дней, одной из составных частей которого является кальций.
Cлайд 15
 ФИЗИЧЕСКИЕ СВОЙСТВА 1.Имеет металлическую кристаллическую решётку. 2.Атомный радиус - 1,97. 3.Ионный радиус Са2+- 1,04. 4.Плотность – 1,54 г/см3. 5.Теплопроводность – 125,6 Вт/м * К. 6.Удельная теплоёмкость – 623,9 дж/кг * К
ФИЗИЧЕСКИЕ СВОЙСТВА 1.Имеет металлическую кристаллическую решётку. 2.Атомный радиус - 1,97. 3.Ионный радиус Са2+- 1,04. 4.Плотность – 1,54 г/см3. 5.Теплопроводность – 125,6 Вт/м * К. 6.Удельная теплоёмкость – 623,9 дж/кг * К
Cлайд 16
 Химические свойства Кальций в результате реакции отдает 2 электрона, т.е. окисляется: Ca2+ – 2е → Caо электронная формула: 1s2 2s2 2p6 3s2 3p6 4s2
Химические свойства Кальций в результате реакции отдает 2 электрона, т.е. окисляется: Ca2+ – 2е → Caо электронная формула: 1s2 2s2 2p6 3s2 3p6 4s2
Cлайд 17
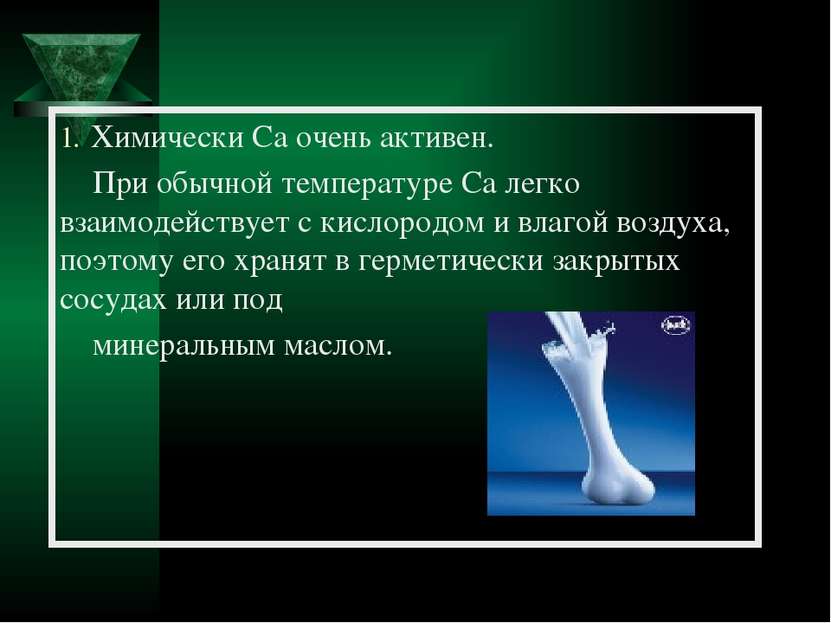
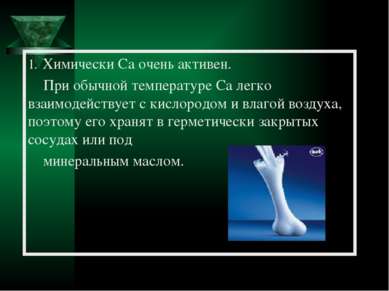 Химически Ca очень активен. При обычной температуре Ca легко взаимодействует с кислородом и влагой воздуха, поэтому его хранят в герметически закрытых сосудах или под минеральным маслом.
Химически Ca очень активен. При обычной температуре Ca легко взаимодействует с кислородом и влагой воздуха, поэтому его хранят в герметически закрытых сосудах или под минеральным маслом.
Cлайд 18
 Взаимодействие с простыми веществами – неметаллами С углеродом Ca + 2 C = CaC2 карбид кальция С фтором реагирует на холоду: Са+|F2 = CaF2 C хлором и бромом при температуре свыше 400°C: Са+Сl2 =CaCl2 Са+Br2 =CaBr2 При нагревании на воздухе или в кислороде воспламеняется, давая основной оксид CaO 2Са + O2 = 2 СаO Известны также пероксиды Ca - CaO2
Взаимодействие с простыми веществами – неметаллами С углеродом Ca + 2 C = CaC2 карбид кальция С фтором реагирует на холоду: Са+|F2 = CaF2 C хлором и бромом при температуре свыше 400°C: Са+Сl2 =CaCl2 Са+Br2 =CaBr2 При нагревании на воздухе или в кислороде воспламеняется, давая основной оксид CaO 2Са + O2 = 2 СаO Известны также пероксиды Ca - CaO2
Cлайд 19
 Трудно вступают в реакцию с азотом и фосфором: ЗСа + N2 = Са3N2 (нитрид магния) ЗСа + 2Р = Са3Р2 (фосфид кальция) Взаимодействуя с сухим водородом при 300-400 °C, Ca образует гидрид CaH2 - ионное соединение, в котором водород является анионом. Са + Н2 = СаН2 (гидрид кальция)
Трудно вступают в реакцию с азотом и фосфором: ЗСа + N2 = Са3N2 (нитрид магния) ЗСа + 2Р = Са3Р2 (фосфид кальция) Взаимодействуя с сухим водородом при 300-400 °C, Ca образует гидрид CaH2 - ионное соединение, в котором водород является анионом. Са + Н2 = СаН2 (гидрид кальция)
Cлайд 20
 2. Взаимодействие со сложными веществами: с водой, с образованием водорода. Ca + H2O = Ca(OH)2 + H2 с кислотами: (кроме концентрированной HNO3) Ca + H2SO4 = CaSO4 + H2
2. Взаимодействие со сложными веществами: с водой, с образованием водорода. Ca + H2O = Ca(OH)2 + H2 с кислотами: (кроме концентрированной HNO3) Ca + H2SO4 = CaSO4 + H2
Cлайд 21
 Получение и применение. В промышленности кальций получают электролизом расплава CaCl2 Са Cl2 = Са+ Cl2 В виде чистого металла Ca применяют как восстановитель U, Th, Cr, V, Zr и некоторых редкоземельных металлов из их соединений. Его используют также для раскисления сталей и других сплавов, для удаления серы из нефтепродуктов, для обезвоживания органических жидкостей, для очистки аргона от примеси азота и в качестве поглотителя газов в электровакуумных приборах.
Получение и применение. В промышленности кальций получают электролизом расплава CaCl2 Са Cl2 = Са+ Cl2 В виде чистого металла Ca применяют как восстановитель U, Th, Cr, V, Zr и некоторых редкоземельных металлов из их соединений. Его используют также для раскисления сталей и других сплавов, для удаления серы из нефтепродуктов, для обезвоживания органических жидкостей, для очистки аргона от примеси азота и в качестве поглотителя газов в электровакуумных приборах.
Cлайд 22
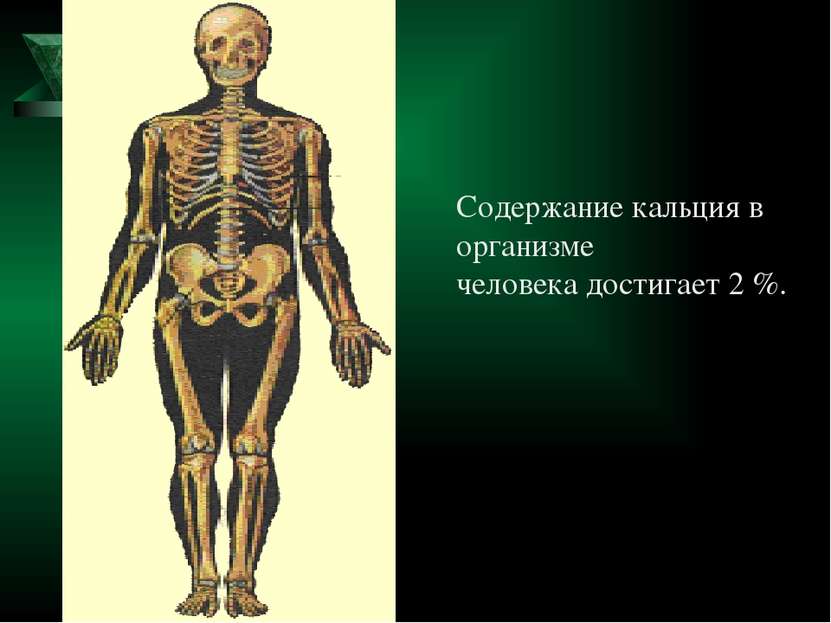
 Ca - один из биогенных элементов, необходимых для нормального протекания жизненных процессов. Он присутствует во всех тканях и жидкостях животных и растений. Лишь редкие организмы могут развиваться в среде, лишенной Ca. У некоторых организмов содержание Ca достигает 38%; у человека - 1,4-2%. Кальций в организме
Ca - один из биогенных элементов, необходимых для нормального протекания жизненных процессов. Он присутствует во всех тканях и жидкостях животных и растений. Лишь редкие организмы могут развиваться в среде, лишенной Ca. У некоторых организмов содержание Ca достигает 38%; у человека - 1,4-2%. Кальций в организме
Cлайд 23
 В пище и воде кальция достаточно, но он плохо усваивается организмом. Кальций и магний в организме уравновешивают друг друга - при уменьшении количества магния исчезает кальций и наоборот. Поэтому их надо принимать вместе. Их называют физиологическими антагонистами. Кальций необходим для здоровых зубов и костей, для нормального функционирования клеток, нервной системы и сокращения мускулов, для сворачивания крови, для иммунной защиты. Например, при мускульных усилиях организму нужны эти два минерала в правильной пропорции для сокращения и расслабления мышц. Магний, который гораздо легче усваивается, удерживает кальций в костях, не даёт ему уходить из организма. Приём магния может более эффективно сохранить кальций в костях, чем приём таблеток минерального кальция
В пище и воде кальция достаточно, но он плохо усваивается организмом. Кальций и магний в организме уравновешивают друг друга - при уменьшении количества магния исчезает кальций и наоборот. Поэтому их надо принимать вместе. Их называют физиологическими антагонистами. Кальций необходим для здоровых зубов и костей, для нормального функционирования клеток, нервной системы и сокращения мускулов, для сворачивания крови, для иммунной защиты. Например, при мускульных усилиях организму нужны эти два минерала в правильной пропорции для сокращения и расслабления мышц. Магний, который гораздо легче усваивается, удерживает кальций в костях, не даёт ему уходить из организма. Приём магния может более эффективно сохранить кальций в костях, чем приём таблеток минерального кальция
Cлайд 24
 Содержание Ca в крови человека и высших животных регулируется гормонами паращитовидных и щитовидной желез. Важнейшую роль в этих процессах играет витамин D. Всасывание Ca происходит в переднем отделе тонкого кишечника. Усвоение Ca ухудшается при снижении кислотности в кишечнике и зависит от соотношения Ca, P и жира в пище. Оптимальные соотношения Са / Р в коровьем молоке около 1,3 (в картофеле 0,15, в бобах 0,13, в мясе 0,016). При избытке в пище P или щавелевой кислоты всасывание Ca ухудшается. Желчные кислоты ускоряют его всасывание. Оптимальные соотношения Са / жир в пище человека 0,04-0,08 г Ca на 1 г жира. Выделение Ca происходит главным образом через кишечник. Млекопитающие в период лактации теряют много Ca с молоком. При нарушениях фосфорно-кальциевого обмена у молодых животных и детей развивается рахит, у взрослых животных - изменение состава и строения скелета (остеомаляция).
Содержание Ca в крови человека и высших животных регулируется гормонами паращитовидных и щитовидной желез. Важнейшую роль в этих процессах играет витамин D. Всасывание Ca происходит в переднем отделе тонкого кишечника. Усвоение Ca ухудшается при снижении кислотности в кишечнике и зависит от соотношения Ca, P и жира в пище. Оптимальные соотношения Са / Р в коровьем молоке около 1,3 (в картофеле 0,15, в бобах 0,13, в мясе 0,016). При избытке в пище P или щавелевой кислоты всасывание Ca ухудшается. Желчные кислоты ускоряют его всасывание. Оптимальные соотношения Са / жир в пище человека 0,04-0,08 г Ca на 1 г жира. Выделение Ca происходит главным образом через кишечник. Млекопитающие в период лактации теряют много Ca с молоком. При нарушениях фосфорно-кальциевого обмена у молодых животных и детей развивается рахит, у взрослых животных - изменение состава и строения скелета (остеомаляция).