X
Код презентации скопируйте его
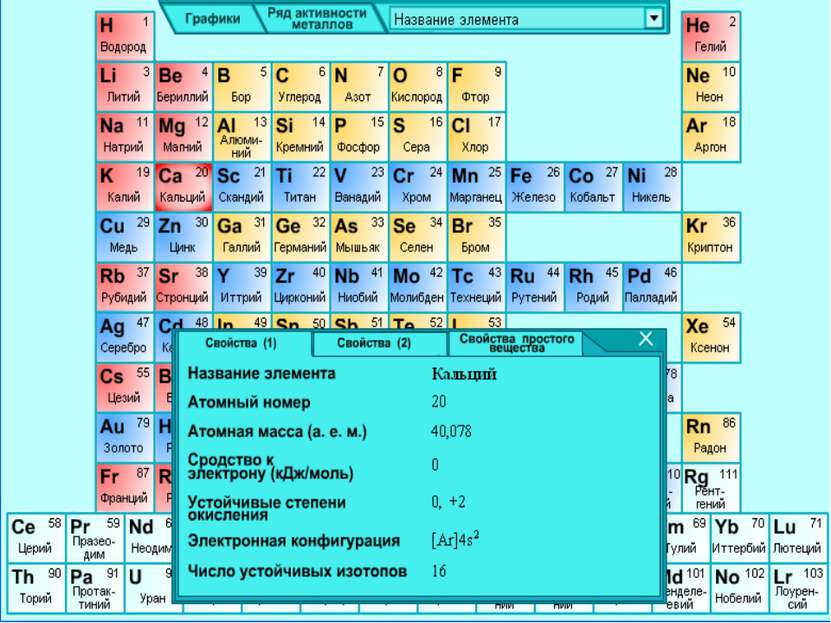
Кальций
Скачать эту презентациюПрезентация на тему Кальций
Скачать эту презентациюCлайд 2
 ПЛАН: 1. КАЛЬЦИЙ – КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ 2. НЕМНОГО ОБ ИСТОРИИ… 3. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. 4. ФИЗИЧЕСКИЕ СВОЙСТВА.. 5. ХИМИЧЕСКИЕ СВОЙСТВА. 6. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ.
ПЛАН: 1. КАЛЬЦИЙ – КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ 2. НЕМНОГО ОБ ИСТОРИИ… 3. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. 4. ФИЗИЧЕСКИЕ СВОЙСТВА.. 5. ХИМИЧЕСКИЕ СВОЙСТВА. 6. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ.
Cлайд 3
 В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко обрабатываемые камни, в первую очередь мел и мрамор. От этого слова и произошло название элемента №20.
В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко обрабатываемые камни, в первую очередь мел и мрамор. От этого слова и произошло название элемента №20.
Cлайд 4
 Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca 48Ca, из которых наиболее распространен 40Ca (96, 97%).
Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca 48Ca, из которых наиболее распространен 40Ca (96, 97%).
Cлайд 6
 Вильгельм Бунзен Немецкий химик. Разработал ряд методов исследования химических веществ. Получил посредством электролиза кальций, марганец, магний и другие металлы. 1811-1899 гг.
Вильгельм Бунзен Немецкий химик. Разработал ряд методов исследования химических веществ. Получил посредством электролиза кальций, марганец, магний и другие металлы. 1811-1899 гг.
Cлайд 7
 В биосфере происходит исключительно резкая дифференциация Ca, связанная главным образом с "карбонатным равновесием": при взаимодействии углекислого газа с карбонатом СаСО3 образуется растворимый бикарбонат Ca(HCO3)2: CaCO3 + H2O + CO2 = Ca(HCO3)2
В биосфере происходит исключительно резкая дифференциация Ca, связанная главным образом с "карбонатным равновесием": при взаимодействии углекислого газа с карбонатом СаСО3 образуется растворимый бикарбонат Ca(HCO3)2: CaCO3 + H2O + CO2 = Ca(HCO3)2
Cлайд 8
 Эта реакция обратима и является основой перераспределения Ca. При высоком содержании CO2 в водах Ca находится в растворе, а при низком содержании CO2 в осадок выпадает минерал кальцит CaCO3, образуя мощные залежи известняка, мела, мрамора.
Эта реакция обратима и является основой перераспределения Ca. При высоком содержании CO2 в водах Ca находится в растворе, а при низком содержании CO2 в осадок выпадает минерал кальцит CaCO3, образуя мощные залежи известняка, мела, мрамора.
Cлайд 11
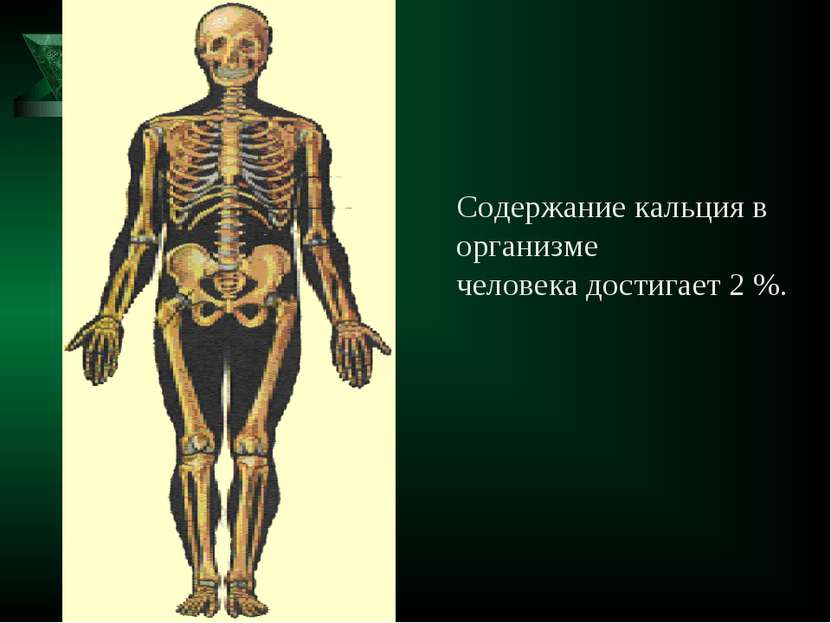
 Реки приносят в океан много кальция (0,04%), который концентрируется в скелетах организмов.
Реки приносят в океан много кальция (0,04%), который концентрируется в скелетах организмов.
Cлайд 17
 Бетон – важнейший строительный материал наших дней, одной из составных частей которого является кальций.
Бетон – важнейший строительный материал наших дней, одной из составных частей которого является кальций.
Cлайд 18
 ФИЗИЧЕСКИЕ СВОЙСТВА 1.Имеет металлическую кристаллическую решётку. 2.Атомный радиус - 1,97. 3.Ионный радиус Са2+- 1,04. 4.Плотность – 1,54 г/см3. 5.Теплопроводность – 125,6 Вт/м * К. 6.Удельная теплоёмкость – 623,9 дж/кг * К
ФИЗИЧЕСКИЕ СВОЙСТВА 1.Имеет металлическую кристаллическую решётку. 2.Атомный радиус - 1,97. 3.Ионный радиус Са2+- 1,04. 4.Плотность – 1,54 г/см3. 5.Теплопроводность – 125,6 Вт/м * К. 6.Удельная теплоёмкость – 623,9 дж/кг * К
Cлайд 19
 Химические свойства Кальций в результате реакции отдает 2 электрона, т.е. окисляется: Ca2+ – 2е → Caо электронная формула: 1s2 2s2 2p6 3s2 3p6 4s2
Химические свойства Кальций в результате реакции отдает 2 электрона, т.е. окисляется: Ca2+ – 2е → Caо электронная формула: 1s2 2s2 2p6 3s2 3p6 4s2
Cлайд 21
 Кальций взаимодействие с простыми веществами – неметаллами. Ca + 2 C = CaC2 карбид кальция 2. взаимодействие со сложными веществами: 2.1. с водой, с образованием водорода. Ca + H2O = Ca(OH)2 + H2 2.2.с кислотами: (кроме концентрированной HNO3) Ca + H2SO4 = CaSO4 + H2
Кальций взаимодействие с простыми веществами – неметаллами. Ca + 2 C = CaC2 карбид кальция 2. взаимодействие со сложными веществами: 2.1. с водой, с образованием водорода. Ca + H2O = Ca(OH)2 + H2 2.2.с кислотами: (кроме концентрированной HNO3) Ca + H2SO4 = CaSO4 + H2
Cлайд 24
 Получение и применение. В промышленности кальций получают двумя способами: 1.Нагреванием брикетированной смеси СаО и порошка Al при 1200˚С в вакууме 0,01-0,02 мм.рт.ст.Выделяющиеся по реакции:6CaO+2Al=3CaO*l2O3+3Ca пары кальция конденсируются на холодной поверхности; 2.Электролизом расплава CaCl2 и KCl с жидким медно-кальциевым катодом приготовляют сплав Cu-Ca(65%Ca),из которого Ca отгоняют при температуре 950-1000˚С в вакууме 0,1-0,001 мм.рт.ст.
Получение и применение. В промышленности кальций получают двумя способами: 1.Нагреванием брикетированной смеси СаО и порошка Al при 1200˚С в вакууме 0,01-0,02 мм.рт.ст.Выделяющиеся по реакции:6CaO+2Al=3CaO*l2O3+3Ca пары кальция конденсируются на холодной поверхности; 2.Электролизом расплава CaCl2 и KCl с жидким медно-кальциевым катодом приготовляют сплав Cu-Ca(65%Ca),из которого Ca отгоняют при температуре 950-1000˚С в вакууме 0,1-0,001 мм.рт.ст.