X
Код презентации скопируйте его
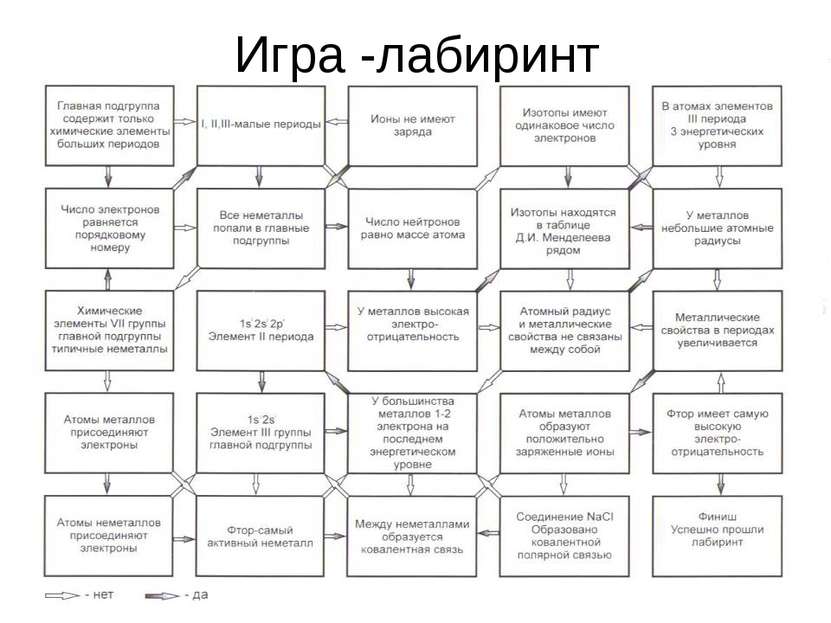
Атомы химических элементов
Скачать эту презентациюПрезентация на тему Атомы химических элементов
Скачать эту презентациюCлайд 1
 Тема урока Атомы химических элементов Задачи урока: повторить, обобщить и закрепить знания о строении атомов химических элементов и химической связи
Тема урока Атомы химических элементов Задачи урока: повторить, обобщить и закрепить знания о строении атомов химических элементов и химической связи
Cлайд 2
 Задание 1: найдите в каждом ряду один химический элемент, который отличается от остальных по положению в периодической системе химических элементов Д. И. Менделеева объяснить причину своего выбора. а) H He Ne Ar в) Fe Co Ni Ar б) H Li Be B г) F Cl Mn Br
Задание 1: найдите в каждом ряду один химический элемент, который отличается от остальных по положению в периодической системе химических элементов Д. И. Менделеева объяснить причину своего выбора. а) H He Ne Ar в) Fe Co Ni Ar б) H Li Be B г) F Cl Mn Br
Cлайд 3
 Задание 1: найдите в каждом ряду один химический элемент, который отличается от остальных по положению в периодической системе химических элементов Д. И. Менделеева объяснить причину своего выбора. а) H He Ne Ar в) Fe Co Ni Ar б) H Li Be B г) F Cl Mn Br
Задание 1: найдите в каждом ряду один химический элемент, который отличается от остальных по положению в периодической системе химических элементов Д. И. Менделеева объяснить причину своего выбора. а) H He Ne Ar в) Fe Co Ni Ar б) H Li Be B г) F Cl Mn Br
Cлайд 4
 Задание: определите, какие величины, характеризующие строение атома и положение химического элемента в периодической таблице Д. И. Менделеева, численно равны между собой. Буквы, соответствующие правильным ответам, образуют название химического элемента, обнаруженного в 1868 г. в солнечном спектре Строение атома Положение химического элемента в таблице периодической системы Д. И. Менделеева порядковый номер номер периода номер группы Заряд ядра Г Д Ж Число электронов в атоме Е З К Число протонов в ядре Л М Н Число нейтронов в ядре атома Ю У С Число электронов в наружном О П И слое атома Число электронных слоев Ч Й Я (энергетических уровней) в атоме
Задание: определите, какие величины, характеризующие строение атома и положение химического элемента в периодической таблице Д. И. Менделеева, численно равны между собой. Буквы, соответствующие правильным ответам, образуют название химического элемента, обнаруженного в 1868 г. в солнечном спектре Строение атома Положение химического элемента в таблице периодической системы Д. И. Менделеева порядковый номер номер периода номер группы Заряд ядра Г Д Ж Число электронов в атоме Е З К Число протонов в ядре Л М Н Число нейтронов в ядре атома Ю У С Число электронов в наружном О П И слое атома Число электронных слоев Ч Й Я (энергетических уровней) в атоме
Cлайд 5
 Заполните графы в таблице в соответствии с приведенными данными. Сумма цифр третьего, четвертого и пятого столбцов равна относительной молекулярной массе азотной кислоты (HNO3). Название химического Электронные Порядковый Номер Номер элемента формулы номер периода группы 4 1s2 2s2 2p3 2 4 1s2 2s2 2p6 3s23p6
Заполните графы в таблице в соответствии с приведенными данными. Сумма цифр третьего, четвертого и пятого столбцов равна относительной молекулярной массе азотной кислоты (HNO3). Название химического Электронные Порядковый Номер Номер элемента формулы номер периода группы 4 1s2 2s2 2p3 2 4 1s2 2s2 2p6 3s23p6
Cлайд 6
 Заполните графы в таблице в соответствии с приведенными данными. Сумма цифр третьего, четвертого и пятого столбцов равна относительной молекулярной массе азотной кислоты (HNO3). Название химического Электронные Порядковый Номер Номер элемента формулы номер периода группы Be 1s2 2s2 4 2 2 N 1s2 2s2 2p3 7 2 5 C 1s2 2s2 2p2 6 2 4 Ar 1s2 2s2 2p6 3s2 3p6 18 3 8
Заполните графы в таблице в соответствии с приведенными данными. Сумма цифр третьего, четвертого и пятого столбцов равна относительной молекулярной массе азотной кислоты (HNO3). Название химического Электронные Порядковый Номер Номер элемента формулы номер периода группы Be 1s2 2s2 4 2 2 N 1s2 2s2 2p3 7 2 5 C 1s2 2s2 2p2 6 2 4 Ar 1s2 2s2 2p6 3s2 3p6 18 3 8
Cлайд 7
 Какие суждения о строении и свойствах атомов, приведенные в левом столбце, соответствуют понятиям из правого столбца: 1) Атомные радиусы уменьшаются с увеличением зарядов ядер атомов. 2) Атомные радиусы увеличиваются с увеличением зарядов ядер атомов. 3) Одинаковое число электронов на внешних энергетических уровнях атомов. 4) Металлические свойства ослабевают с увеличением заряда ядер атомов. 5) Металлические свойства усиливаются с увеличением заряда ядер. а) главная подгруппа б) группа в) период
Какие суждения о строении и свойствах атомов, приведенные в левом столбце, соответствуют понятиям из правого столбца: 1) Атомные радиусы уменьшаются с увеличением зарядов ядер атомов. 2) Атомные радиусы увеличиваются с увеличением зарядов ядер атомов. 3) Одинаковое число электронов на внешних энергетических уровнях атомов. 4) Металлические свойства ослабевают с увеличением заряда ядер атомов. 5) Металлические свойства усиливаются с увеличением заряда ядер. а) главная подгруппа б) группа в) период
Cлайд 8
 Какие из попарно приведенных свойств не взаимосвязаны между собой: а) большие значения атомного радиуса и электроотрицательности; б) небольшое значение атомного радиуса и сильно выраженные неметаллические свойства; в) большое значение атомного радиуса и сильно выраженные металлические свойства; г) небольшое значение электроотрицательности и большое значение атомного радиуса; д) небольшое значение электроотрицательности и слабо выраженные металлические свойства?
Какие из попарно приведенных свойств не взаимосвязаны между собой: а) большие значения атомного радиуса и электроотрицательности; б) небольшое значение атомного радиуса и сильно выраженные неметаллические свойства; в) большое значение атомного радиуса и сильно выраженные металлические свойства; г) небольшое значение электроотрицательности и большое значение атомного радиуса; д) небольшое значение электроотрицательности и слабо выраженные металлические свойства?
Cлайд 9
 Определите в каком ряду пары атомов расположены в порядке последовательного увеличения смещения общей электронной пары: а) F – F, H – F , Na – F б) F – F, Na – F, H – F в) Na – F, F – F, H – F г) H – F, F – F, Na – F д) Na – F, H – F, F – F.
Определите в каком ряду пары атомов расположены в порядке последовательного увеличения смещения общей электронной пары: а) F – F, H – F , Na – F б) F – F, Na – F, H – F в) Na – F, F – F, H – F г) H – F, F – F, Na – F д) Na – F, H – F, F – F.
Cлайд 10
 В каком из рядов соединения расположены в порядке увеличения полярности связи: а) CH4, HF, HCl, H2O, NH3 б) HCl, CH4, NH3, HF, H2O в) CH4, HCl, NH3, H2O, HF г) HCl, CH4, H2O, NH3, HF д) HF, CH4, HCl, NH3, H2O.
В каком из рядов соединения расположены в порядке увеличения полярности связи: а) CH4, HF, HCl, H2O, NH3 б) HCl, CH4, NH3, HF, H2O в) CH4, HCl, NH3, H2O, HF г) HCl, CH4, H2O, NH3, HF д) HF, CH4, HCl, NH3, H2O.