X
Код презентации скопируйте его
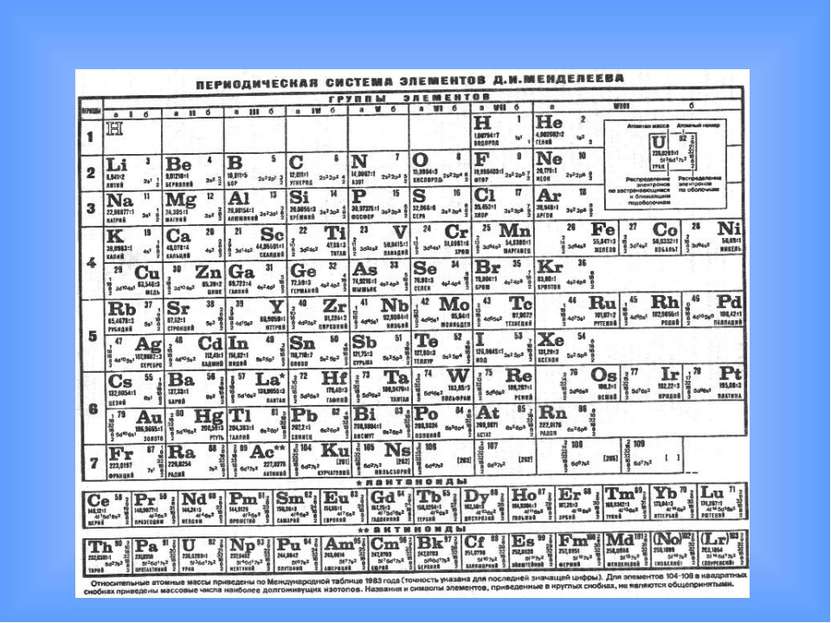
Периодический закон и Периодическая система химических элементов Д.И.Менделеева
Скачать эту презентациюПрезентация на тему Периодический закон и Периодическая система химических элементов Д.И.Менделеева
Скачать эту презентациюCлайд 1
 Периодический закон и Периодическая система химических элементов Д.И.Менделеева “Мощь и сила науки во множестве фактов, цель в обобщении этого множества и возведении их к началам… Собрание фактов и гипотез – это ещё не наука; оно есть только преддверие её, мимо которого нельзя прямо войти в святилище науки. На этих преддвериях надпись – наблюдения, предложения, опыт”. Д.И. Менделеев
Периодический закон и Периодическая система химических элементов Д.И.Менделеева “Мощь и сила науки во множестве фактов, цель в обобщении этого множества и возведении их к началам… Собрание фактов и гипотез – это ещё не наука; оно есть только преддверие её, мимо которого нельзя прямо войти в святилище науки. На этих преддвериях надпись – наблюдения, предложения, опыт”. Д.И. Менделеев
Cлайд 2
 Первые попытки систематизации элементов В 1829 г немецкий химик Иоган Вольфганг Дёберейнер сформулировал закон триад. Cl – 35.5 Br – 80 I – 125 P – 31 As – 75 Sb – 122 S – 32 Se – 79 Te – 129 Ca – 41 Sr – 88 Ba – 137 Li – 7 Na – 23 K – 39
Первые попытки систематизации элементов В 1829 г немецкий химик Иоган Вольфганг Дёберейнер сформулировал закон триад. Cl – 35.5 Br – 80 I – 125 P – 31 As – 75 Sb – 122 S – 32 Se – 79 Te – 129 Ca – 41 Sr – 88 Ba – 137 Li – 7 Na – 23 K – 39
Cлайд 3
 Разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
Разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
Cлайд 4
 Первые попытки систематизации элементов В 1843 г Леопольд Гмелин привёл таблицу химически сходных элементов, расставленных по группам в порядке возрастания "соединительных масс". Вне групп элементов, вверху таблицы, Гмелин поместил три "базисных" элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причём под кислородом расположены группы металлоидов (по терминологии Берцелиуса), т.е. электроотрицательных элементов; электроположительные и электроотрицательные свойства групп элементов плавно изменялись сверху вниз.
Первые попытки систематизации элементов В 1843 г Леопольд Гмелин привёл таблицу химически сходных элементов, расставленных по группам в порядке возрастания "соединительных масс". Вне групп элементов, вверху таблицы, Гмелин поместил три "базисных" элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причём под кислородом расположены группы металлоидов (по терминологии Берцелиуса), т.е. электроотрицательных элементов; электроположительные и электроотрицательные свойства групп элементов плавно изменялись сверху вниз.
Cлайд 5
 Часть таблицы Леопольда Гмелина Н = 1 Cl = 35,5 K = 39 О = 8 N = 14 Ag = 108 S = 16 C = 6 Pb = 103,5
Часть таблицы Леопольда Гмелина Н = 1 Cl = 35,5 K = 39 О = 8 N = 14 Ag = 108 S = 16 C = 6 Pb = 103,5
Cлайд 6
 Первые попытки систематизации элементов Джон Александр Рейна Ньюлендс в1864 г. опубликовал таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест.
Первые попытки систематизации элементов Джон Александр Рейна Ньюлендс в1864 г. опубликовал таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест.
Cлайд 7
 Таблица Ньюлендса № № № № № № № № H 1 F 8 Cl 15 Co Ni 22 Br 29 Pd 36 I 43 Pt Ir 50 Li 2 Na 9 K 16 Cu 23 Rb 30 Ag 37 Cs 44 Tl 51 Be 3 Mg 10 Ca 17 Zn 24 Sr 31 Cd 38 Ba V 45 Pb 52 B 4 Al 11 Cr 18 Y 25 Ce La 32 U 39 Ta 46 Th 53 C 5 Si 12 Ti 19 In 26 Zr 33 Sn 40 W 47 Hg 54 N 6 P 13 Mn 20 As 27 Di Mo 34 Sb 41 Nb 48 Bi 55 O 7 S 14 Fe 21 Se 28 Rh Ru 35 Te 42 Au 49 Os 56
Таблица Ньюлендса № № № № № № № № H 1 F 8 Cl 15 Co Ni 22 Br 29 Pd 36 I 43 Pt Ir 50 Li 2 Na 9 K 16 Cu 23 Rb 30 Ag 37 Cs 44 Tl 51 Be 3 Mg 10 Ca 17 Zn 24 Sr 31 Cd 38 Ba V 45 Pb 52 B 4 Al 11 Cr 18 Y 25 Ce La 32 U 39 Ta 46 Th 53 C 5 Si 12 Ti 19 In 26 Zr 33 Sn 40 W 47 Hg 54 N 6 P 13 Mn 20 As 27 Di Mo 34 Sb 41 Nb 48 Bi 55 O 7 S 14 Fe 21 Se 28 Rh Ru 35 Te 42 Au 49 Os 56
Cлайд 8
 Первые попытки систематизации элементов В 1864 году Уильям Одлинг, пересмотрев предложенную им в 1857 г. систематику элементов, основанную на эквивалентных весах, предложил следующую таблицу, не сопровождаемую какими-либо пояснениями.
Первые попытки систематизации элементов В 1864 году Уильям Одлинг, пересмотрев предложенную им в 1857 г. систематику элементов, основанную на эквивалентных весах, предложил следующую таблицу, не сопровождаемую какими-либо пояснениями.
Cлайд 9
 Таблица Одлинга Триплетные группы H 1 Mo 96 W 184 Au 196.5 Pd 106.5 Pt 197 Li 7 Na 23 - Ag 108 G 9 Mg 24 Zn 65 Cd 112 Hg 200 B 11 Al 27.5 - - Tl 203 C 12 Si 28 - Sn 118 Pb 207 N 14 P 31 As 75 Sb 122 Bi 210 O 16 S 32 Se 79.5 Te 129 F 19 Cl 35 Br 80 J 127 K 39 Rb 85 Cs 133 Ca 40 Sr 87.5 Ba 137 Ti 40 Zr 89.5 - Th 231 Cr 52.5 V 138 Mn 55 и др. (Fe,Ni,Co,Cu)
Таблица Одлинга Триплетные группы H 1 Mo 96 W 184 Au 196.5 Pd 106.5 Pt 197 Li 7 Na 23 - Ag 108 G 9 Mg 24 Zn 65 Cd 112 Hg 200 B 11 Al 27.5 - - Tl 203 C 12 Si 28 - Sn 118 Pb 207 N 14 P 31 As 75 Sb 122 Bi 210 O 16 S 32 Se 79.5 Te 129 F 19 Cl 35 Br 80 J 127 K 39 Rb 85 Cs 133 Ca 40 Sr 87.5 Ba 137 Ti 40 Zr 89.5 - Th 231 Cr 52.5 V 138 Mn 55 и др. (Fe,Ni,Co,Cu)
Cлайд 10
 В 1870 г. Юлиус Лотар Мейер опубликовал свою первую таблицу, в которую включены 42 элемента (из 63), размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов. Первые попытки систематизации элементов
В 1870 г. Юлиус Лотар Мейер опубликовал свою первую таблицу, в которую включены 42 элемента (из 63), размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов. Первые попытки систематизации элементов
Cлайд 11
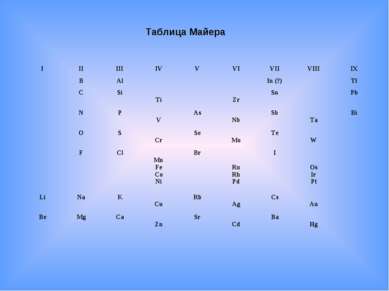 Таблица Майера I II III IV V VI VII VIII IX B Al In (?) Tl C Si Ti Zr Sn Pb N P V As Nb Sb Ta Bi O S Cr Se Mo Te W F Cl Mn Fe Co Ni Br Ru Rh Pd I Os Ir Pt Li Na K Cu Rb Ag Cs Au Be Mg Ca Zn Sr Cd Ba Hg
Таблица Майера I II III IV V VI VII VIII IX B Al In (?) Tl C Si Ti Zr Sn Pb N P V As Nb Sb Ta Bi O S Cr Se Mo Te W F Cl Mn Fe Co Ni Br Ru Rh Pd I Os Ir Pt Li Na K Cu Rb Ag Cs Au Be Mg Ca Zn Sr Cd Ba Hg
Cлайд 12
 В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях. В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях. В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
Cлайд 13
 Первая таблица Д.И.Менделеева, 1869 г H = 1 Ti = 50 V = 51 Cr = 52 Mn = 55 Fe = 56 Co = Ni = 59 Cu = 63.4 Zr = 90 Nb = 94 Mo = 96 Rh = 104.4 Ru = 104.4 Pd = 106.6 Ag = 108 ? = 180 Ta = 182 W = 186 Pt = 197.4 Ir = 198 Os = 199 Hg = 200 Be = 9.4 Mg = 24 Zn = 65.2 Cd = 112 B = 11 Al = 27.4 ? = 68 Ur = 116 Au = 197 C = 12 Si = 28 ? = 70 Sn = 118 N = 14 P = 31 As = 75 Sb = 122 Bi = 210 O = 16 S = 32 Se = 79.4 Te = 128? F = 19 Cl = 35.5 Br = 80 J = 127 Li = 7 Na = 23 K = 39 Ca = 40 ? = 45 ?Er = 56 ?Yt = 60 ?In = 75.6 Rb = 85.4 Sr = 87.6 Ce = 92 La = 94 Di = 95 Th = 118? Cs = 133 Ba = 137 Tl = 204 Pb = 207
Первая таблица Д.И.Менделеева, 1869 г H = 1 Ti = 50 V = 51 Cr = 52 Mn = 55 Fe = 56 Co = Ni = 59 Cu = 63.4 Zr = 90 Nb = 94 Mo = 96 Rh = 104.4 Ru = 104.4 Pd = 106.6 Ag = 108 ? = 180 Ta = 182 W = 186 Pt = 197.4 Ir = 198 Os = 199 Hg = 200 Be = 9.4 Mg = 24 Zn = 65.2 Cd = 112 B = 11 Al = 27.4 ? = 68 Ur = 116 Au = 197 C = 12 Si = 28 ? = 70 Sn = 118 N = 14 P = 31 As = 75 Sb = 122 Bi = 210 O = 16 S = 32 Se = 79.4 Te = 128? F = 19 Cl = 35.5 Br = 80 J = 127 Li = 7 Na = 23 K = 39 Ca = 40 ? = 45 ?Er = 56 ?Yt = 60 ?In = 75.6 Rb = 85.4 Sr = 87.6 Ce = 92 La = 94 Di = 95 Th = 118? Cs = 133 Ba = 137 Tl = 204 Pb = 207
Cлайд 14
 В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов и применение её к указанию свойств неоткрытых элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций). Расположение в периодической таблице элементов, известных в 1870 г. Зелёным цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д. И. Менделеев
В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов и применение её к указанию свойств неоткрытых элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций). Расположение в периодической таблице элементов, известных в 1870 г. Зелёным цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д. И. Менделеев
Cлайд 15
 В 1871 г. Менделеев в итоговой статье "Периодическая законность химических элементов" дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид.
В 1871 г. Менделеев в итоговой статье "Периодическая законность химических элементов" дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид.
Cлайд 16
 Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная) «длинная» (длиннопериодная) «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная) «длинная» (длиннопериодная) «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Cлайд 17
![Периодическая система элементов[2] IA IIA IIIB IVB VB VIB VIIB ---- VIIIB -... Периодическая система элементов[2] IA IIA IIIB IVB VB VIB VIIB ---- VIIIB -...](https://bigslide.ru/images/4/3496/389/img16.jpg) Периодическая система элементов[2] IA IIA IIIB IVB VB VIB VIIB ---- VIIIB ---- IB IIB IIIA IVA VA VIA VIIA VIIIA 1 1 H 2 He 2 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 3 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr 5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo (43) Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe 6 55 Cs 56 Ba * 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po (85) At 86 Rn 7 87 Fr 88 Ra ** (104) Rf (105) Db (106) Sg (107) Bh (108) Hs (109) Mt (110) Ds (111) Rg (112) Cp (113) Uut (114) Uuq (115) Uup (116) Uuh (117) Uus (118) Uuo 8 (119) Uue (120) Ubn Лантаноиды * 57 La 58 Ce 59 Pr 60 Nd (61) Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu Актиноиды ** 89 Ac 90 Th 91 Pa 92 U (93) Np (94) Pu (95) Am (96) Cm (97) Bk (98) Cf (99) Es (100) Fm (101) Md (102) No (103) Lr
Периодическая система элементов[2] IA IIA IIIB IVB VB VIB VIIB ---- VIIIB ---- IB IIB IIIA IVA VA VIA VIIA VIIIA 1 1 H 2 He 2 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 3 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr 5 37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo (43) Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe 6 55 Cs 56 Ba * 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po (85) At 86 Rn 7 87 Fr 88 Ra ** (104) Rf (105) Db (106) Sg (107) Bh (108) Hs (109) Mt (110) Ds (111) Rg (112) Cp (113) Uut (114) Uuq (115) Uup (116) Uuh (117) Uus (118) Uuo 8 (119) Uue (120) Ubn Лантаноиды * 57 La 58 Ce 59 Pr 60 Nd (61) Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu Актиноиды ** 89 Ac 90 Th 91 Pa 92 U (93) Np (94) Pu (95) Am (96) Cm (97) Bk (98) Cf (99) Es (100) Fm (101) Md (102) No (103) Lr
Cлайд 19
 Вторая формулировка Периодического закона Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Вторая формулировка Периодического закона Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер.
Cлайд 20
 Третья формулировка Периодического закона Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от периодичности в изменении конфигураций внешних электронных слове атомов химических элементов.
Третья формулировка Периодического закона Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от периодичности в изменении конфигураций внешних электронных слове атомов химических элементов.
Cлайд 21
 Немецкий химик Леопольд Гмелин родился в Гёттингене в семье известного химика и врача Иоганна Фридриха Гмелина. Учился в Тюбингенском и Гёттингенском университетах; в 1812 получил степень доктора медицины. С 1813 по 1851 работал в Гейдельбергском университете; с 1817 — профессор медицины и химии.
Немецкий химик Леопольд Гмелин родился в Гёттингене в семье известного химика и врача Иоганна Фридриха Гмелина. Учился в Тюбингенском и Гёттингенском университетах; в 1812 получил степень доктора медицины. С 1813 по 1851 работал в Гейдельбергском университете; с 1817 — профессор медицины и химии.
Cлайд 22
 Джон Александр Рейна Ньюлендс родился в Лондоне 26 ноября 1837 г. Отец, шотландский священник Уильям Ньюлендс, не хотевший, чтобы сын пошёл по его стопам, подготовил его к поступлению в в химический колледж. Мать, Мэри Сара Рейна, итальянка, привила сыну любовь к музыке. Получив образование в колледже, он в 1857 г. Ньюлендс становится ассистентом химика в Королевском сельскохозяйственном обществе. Однако под влиянием матери Ньюлендс уезжает на её родину, в Италию, где набирало силу освободительное движение во главе с Джузеппе Гарибальди. Там в начале 1860 г. Ньюлендс познакомился со Станислао Канниццаро – одним из реформаторов атомно-молекулярного учения. Общение с Канниццаро, по-видимому, привлекло внимание Ньюлендса к проблеме атомных весов элементов.
Джон Александр Рейна Ньюлендс родился в Лондоне 26 ноября 1837 г. Отец, шотландский священник Уильям Ньюлендс, не хотевший, чтобы сын пошёл по его стопам, подготовил его к поступлению в в химический колледж. Мать, Мэри Сара Рейна, итальянка, привила сыну любовь к музыке. Получив образование в колледже, он в 1857 г. Ньюлендс становится ассистентом химика в Королевском сельскохозяйственном обществе. Однако под влиянием матери Ньюлендс уезжает на её родину, в Италию, где набирало силу освободительное движение во главе с Джузеппе Гарибальди. Там в начале 1860 г. Ньюлендс познакомился со Станислао Канниццаро – одним из реформаторов атомно-молекулярного учения. Общение с Канниццаро, по-видимому, привлекло внимание Ньюлендса к проблеме атомных весов элементов.
Cлайд 23
 Английский химик Уильям Одлинг родился в Саутуорке, близ Лондона. В 1846-1850 гг. он получил медицинское образование в медицинской школе при госпитале Св. Варфоломея в Лондоне. В 1850 г. изучал химию в Париже у Шарля Жерара. С 1868 г. – профессор Королевского института, с 1872 г. – Оксфордского университета. Член Лондонского королевского общества с 1859 г., его почётный Секретарь (1856-1869), Вице-президент (1869-1872) и Президент (1873-1875).
Английский химик Уильям Одлинг родился в Саутуорке, близ Лондона. В 1846-1850 гг. он получил медицинское образование в медицинской школе при госпитале Св. Варфоломея в Лондоне. В 1850 г. изучал химию в Париже у Шарля Жерара. С 1868 г. – профессор Королевского института, с 1872 г. – Оксфордского университета. Член Лондонского королевского общества с 1859 г., его почётный Секретарь (1856-1869), Вице-президент (1869-1872) и Президент (1873-1875).
Cлайд 24
 Юлиус Лотар Мейер родился 19 августа 1830 года в семье врача в маленьком городке Фареле в провинции Ольденбург. Обладая слабым здоровьем, среднюю школу он смог закончить только к двадцати одному году. После школы по примеру своего отца Мейер стал изучать медицину, и в 1854 году получил степень доктора в Вюрцбургском университете.
Юлиус Лотар Мейер родился 19 августа 1830 года в семье врача в маленьком городке Фареле в провинции Ольденбург. Обладая слабым здоровьем, среднюю школу он смог закончить только к двадцати одному году. После школы по примеру своего отца Мейер стал изучать медицину, и в 1854 году получил степень доктора в Вюрцбургском университете.

















![Периодическая система элементов[2] IA IIA IIIB IVB VB VIB VIIB ---- VIIIB -... Периодическая система элементов[2] IA IIA IIIB IVB VB VIB VIIB ---- VIIIB -...](https://bigslide.ru/images/4/3496/831/img16.jpg)