X
Код презентации скопируйте его
Щелочные металлы
Скачать эту презентациюПрезентация на тему Щелочные металлы
Скачать эту презентациюCлайд 2
 Щелочны е мета ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, и унуненний Uue. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Щелочны е мета ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, и унуненний Uue. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Cлайд 4
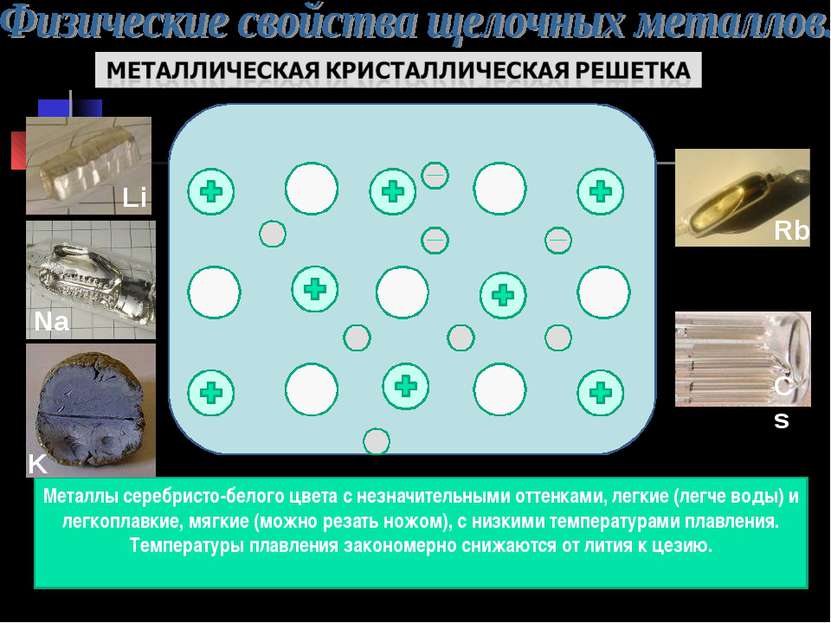
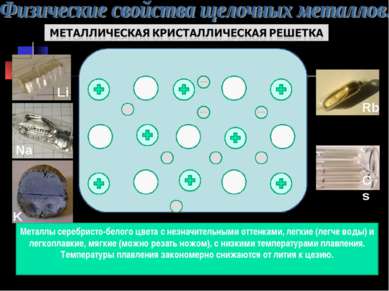 Металлы серебристо-белого цвета с незначительными оттенками, легкие (легче воды) и легкоплавкие, мягкие (можно резать ножом), с низкими температурами плавления. Температуры плавления закономерно снижаются от лития к цезию.
Металлы серебристо-белого цвета с незначительными оттенками, легкие (легче воды) и легкоплавкие, мягкие (можно резать ножом), с низкими температурами плавления. Температуры плавления закономерно снижаются от лития к цезию.
Cлайд 5
 Х И М И Ч Е С К И Е С В О Й С Т В А Щелочные металлы активно взаимодействуют почти со всеми неметаллами 2М0 + Н20 = 2М+1Н-1 (гидрид) 2М0 + Cl20 = 2M+1Cl-1 (хлорид) 2М0 + S0 = M+12S (сульфид) С кислородом натрий и калий образуют не оксиды, а пероксиды: 2М0 + О20 = М+12О 12 пероксид
Х И М И Ч Е С К И Е С В О Й С Т В А Щелочные металлы активно взаимодействуют почти со всеми неметаллами 2М0 + Н20 = 2М+1Н-1 (гидрид) 2М0 + Cl20 = 2M+1Cl-1 (хлорид) 2М0 + S0 = M+12S (сульфид) С кислородом натрий и калий образуют не оксиды, а пероксиды: 2М0 + О20 = М+12О 12 пероксид
Cлайд 6
 Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода: 2М0 + 2Н2О = 2М+1ОН + Н2 Скорость взаимодействия щелочного металла с водой увеличивается от лития к цезию. Кусочек металлического натрия реагирует с водой в присутствии фенолфталеина
Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода: 2М0 + 2Н2О = 2М+1ОН + Н2 Скорость взаимодействия щелочного металла с водой увеличивается от лития к цезию. Кусочек металлического натрия реагирует с водой в присутствии фенолфталеина
Cлайд 7
 Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки. Li+ - карминово-красный K+ - фиолетовый Cs+ - фиолетово-синий Na+ - желтый Rb + - красный
Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки. Li+ - карминово-красный K+ - фиолетовый Cs+ - фиолетово-синий Na+ - желтый Rb + - красный
Cлайд 8
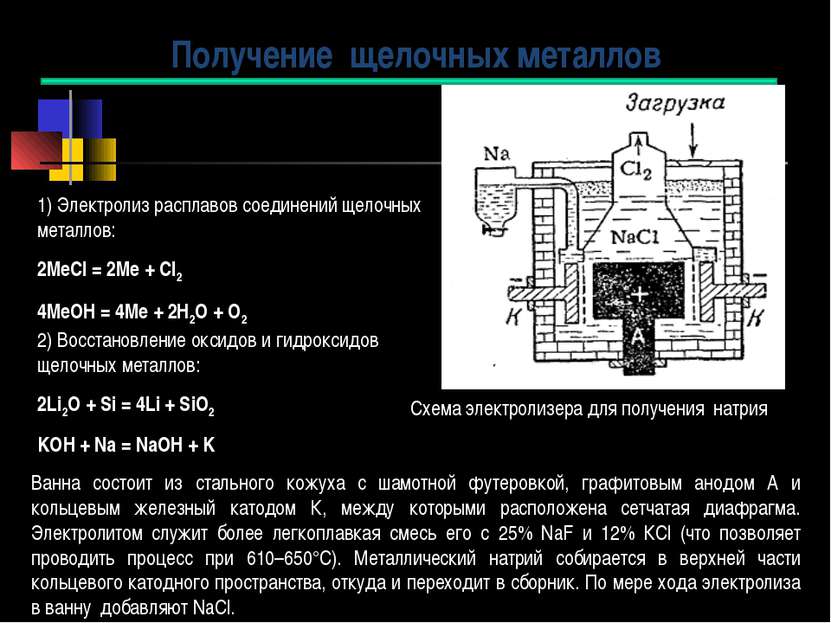
 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О + О2 2) Восстановление оксидов и гидроксидов щелочных металлов: 2Li2O + Si = 4Li + SiO2 KOH + Na = NаOH + K Получение щелочных металлов Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют NaCl. Схема электролизера для получения натрия
1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О + О2 2) Восстановление оксидов и гидроксидов щелочных металлов: 2Li2O + Si = 4Li + SiO2 KOH + Na = NаOH + K Получение щелочных металлов Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют NaCl. Схема электролизера для получения натрия
Cлайд 9
 Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Ли тий / Lithium (Li) Внешний вид простого вещества Мягкий металл серебристо-белого цвета. Электронная конфигурация [He] 2s1 Степень окисления 1 Плотность 0,534 г/см³ Температура плавления 453,69 K Температура кипения 1613 K
Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Ли тий / Lithium (Li) Внешний вид простого вещества Мягкий металл серебристо-белого цвета. Электронная конфигурация [He] 2s1 Степень окисления 1 Плотность 0,534 г/см³ Температура плавления 453,69 K Температура кипения 1613 K
Cлайд 10
 Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите. Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь впервые была найдена в "царстве минералов" (камней); название это произведено от греч.- камень. Металлический Литий впервые получен в 1818 г. Г. Дэви путем злектролиза щелочи. В 1855 г. Бунзен и Маттессен разработали промышленный способ получения металлического лития злектролизом хлорида лития. Арфведсон Юхан Август (12 .01.1792 г. – 28 .10.1841 г.) История открытия лития
Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите. Берцелиус предложил назвать ее литионом (Lithion), поскольку эта щелочь впервые была найдена в "царстве минералов" (камней); название это произведено от греч.- камень. Металлический Литий впервые получен в 1818 г. Г. Дэви путем злектролиза щелочи. В 1855 г. Бунзен и Маттессен разработали промышленный способ получения металлического лития злектролизом хлорида лития. Арфведсон Юхан Август (12 .01.1792 г. – 28 .10.1841 г.) История открытия лития
Cлайд 11
![Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бес... Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бес...](https://bigslide.ru/images/40/39666/389/img10.jpg) Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бесцветный, красный, желтый, зеленый Плотность 3,1—3,2 г/см3 Твердость 6,5
Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бесцветный, красный, желтый, зеленый Плотность 3,1—3,2 г/см3 Твердость 6,5
Cлайд 12
 Получение В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси): 2LiCl=> 2Li + Cl2 В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Получение В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси): 2LiCl=> 2Li + Cl2 В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Cлайд 13
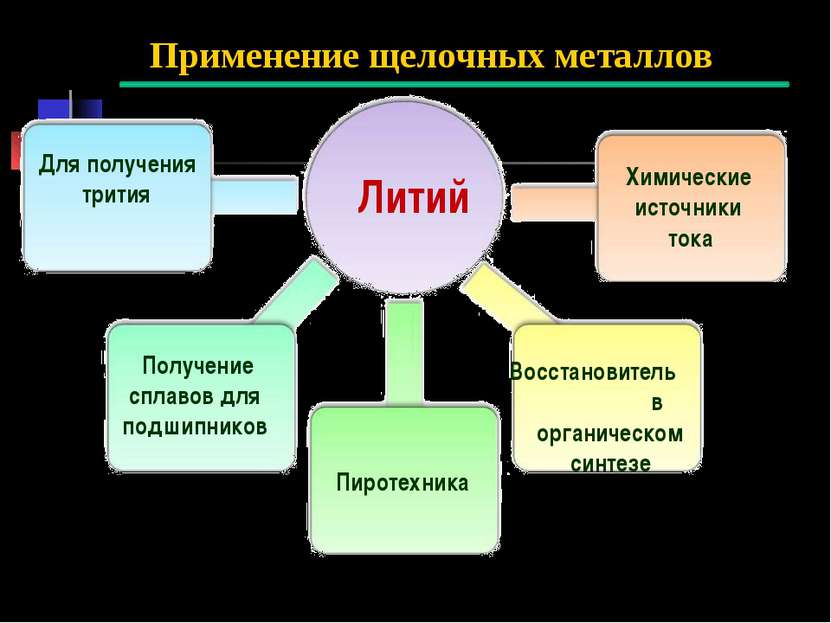
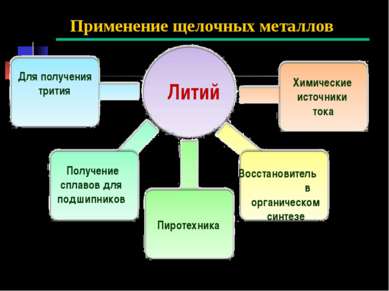 Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические источники тока Пиротехника
Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические источники тока Пиротехника
Cлайд 14
 Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Натрий/Natrium (Na) Внешний вид простого вещества Мягкий металл серебристо-белого цвета. Электронная конфигурация [He] 2s1 Степень окисления +1 Плотность 0,534 г/см³ Температура плавления 453,69 K Температура кипения 1613 K
Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Натрий/Natrium (Na) Внешний вид простого вещества Мягкий металл серебристо-белого цвета. Электронная конфигурация [He] 2s1 Степень окисления +1 Плотность 0,534 г/см³ Температура плавления 453,69 K Температура кипения 1613 K
Cлайд 15
 Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В 1807 г. Г.Дэви путем электролиза слегка увлажненных твердых щелочей получил свободный металл - натрий, назвав его содий (Sodium). В следующем году Гильберт предложил именовать новый металл натронием (Natronium); Берцелиус сократил последнее название до "натрий" (Natrium). Гемфри Дэви (17.12.1778 г – 29.05.1829 г) История открытия натрия
Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В 1807 г. Г.Дэви путем электролиза слегка увлажненных твердых щелочей получил свободный металл - натрий, назвав его содий (Sodium). В следующем году Гильберт предложил именовать новый металл натронием (Natronium); Берцелиус сократил последнее название до "натрий" (Natrium). Гемфри Дэви (17.12.1778 г – 29.05.1829 г) История открытия натрия
Cлайд 16
 Галит Фотография Описание минерала Химический состав NaСl Цвет Бесцветный, красный, желтый, синий Плотность 2,2—2,3г/см3 Твердость 2,5 Вкус Солёный
Галит Фотография Описание минерала Химический состав NaСl Цвет Бесцветный, красный, желтый, синий Плотность 2,2—2,3г/см3 Твердость 2,5 Вкус Солёный
Cлайд 17
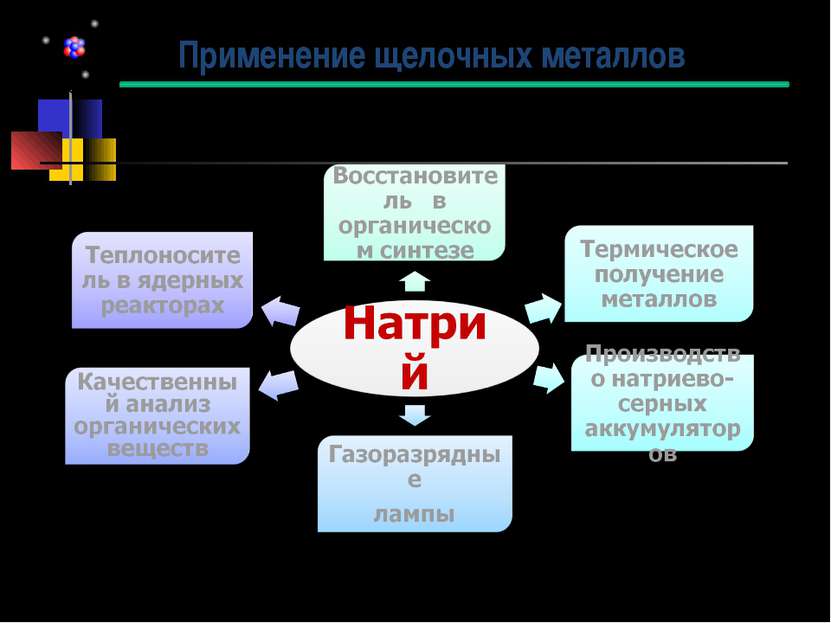
 Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью. Первым промышленным способом получения натрия стала карботермическая реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля) : Na2CO3 + 2C => 2Na + 3CO Аналогично, могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий. С появлением электроэнергетики стал более практичен другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия. В настоящее время электролиз — основной способ получения натрия. Натрий также можно получить циркониетермическим методом, а также термическим разложением азида натрия. Получение
Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью. Первым промышленным способом получения натрия стала карботермическая реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля) : Na2CO3 + 2C => 2Na + 3CO Аналогично, могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий. С появлением электроэнергетики стал более практичен другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия. В настоящее время электролиз — основной способ получения натрия. Натрий также можно получить циркониетермическим методом, а также термическим разложением азида натрия. Получение
Cлайд 19
 Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Калий / Kalium (K) Внешний вид простого вещества Серебристо-белый мягкий металл Электронная конфигурация [Ar] 3d10 4s1 Степень окисления 1 Плотность 0,856 г/см³ Температура плавления 336,8 К Температура кипения 1047 К
Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Калий / Kalium (K) Внешний вид простого вещества Серебристо-белый мягкий металл Электронная конфигурация [Ar] 3d10 4s1 Степень окисления 1 Плотность 0,856 г/см³ Температура плавления 336,8 К Температура кипения 1047 К
Cлайд 20
 Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви, производивший электролиз твердого, слегка увлажненного едкого кали. Дэви именовал новый металл потассием (Potassium), но это название не прижилось. Крестным отцом металла оказался Гильберт, известный издатель журнала "Annalen deг Physik", предложивший название "калий"; оно было принято в Германии и России. История открытия калия Гемфри Дэви (17.12.1778 г – 29.05.1829 г)
Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви, производивший электролиз твердого, слегка увлажненного едкого кали. Дэви именовал новый металл потассием (Potassium), но это название не прижилось. Крестным отцом металла оказался Гильберт, известный издатель журнала "Annalen deг Physik", предложивший название "калий"; оно было принято в Германии и России. История открытия калия Гемфри Дэви (17.12.1778 г – 29.05.1829 г)
Cлайд 21
 Сильвин Фотография Описание минерала Химический состав КСl Цвет Бесцветный, молочно-белый, темно-красный, розовый Плотность 1,97-1,99 г/см3 Твердость 1,5 Вкус Едкий
Сильвин Фотография Описание минерала Химический состав КСl Цвет Бесцветный, молочно-белый, темно-красный, розовый Плотность 1,97-1,99 г/см3 Твердость 1,5 Вкус Едкий
Cлайд 22
 Получение Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор: При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород: Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов). Важное промышленное значение имеют и методы термохимического восстановления: и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.
Получение Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор: При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород: Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов). Важное промышленное значение имеют и методы термохимического восстановления: и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.
Cлайд 23
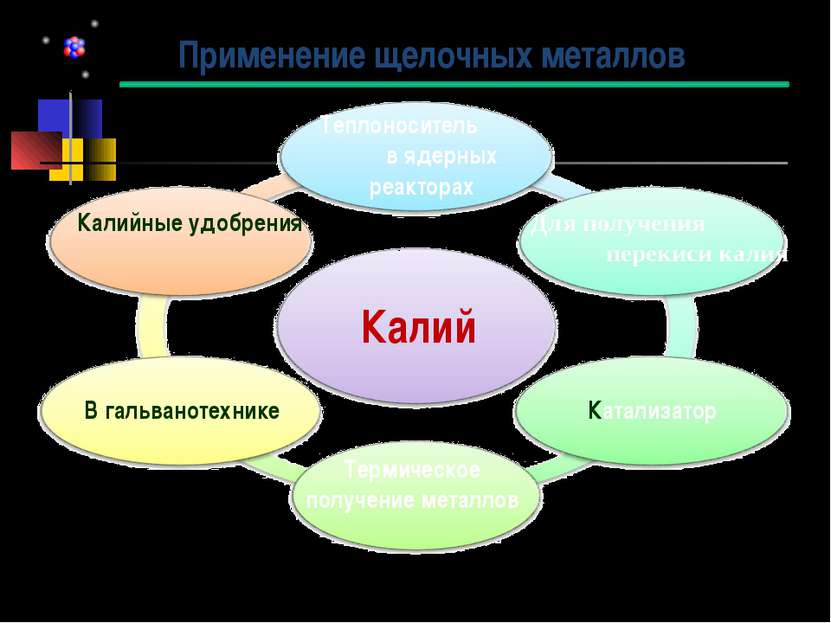
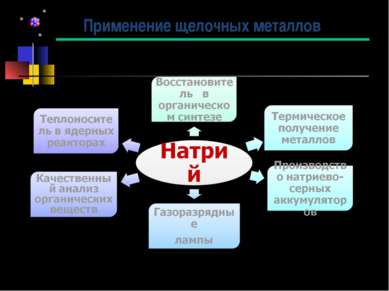
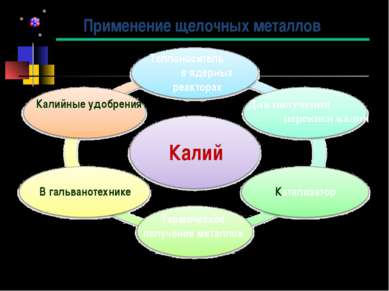 Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Для получения перекиси калия Катализатор Термическое получение металлов Теплоноситель в ядерных реакторах
Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Для получения перекиси калия Катализатор Термическое получение металлов Теплоноситель в ядерных реакторах
Cлайд 24
 Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Руби дий / Rubidium (Rb) Внешний вид простого вещества Серебристо-белый мягкий металл Электронная конфигурация [Kr] 5s1 Степень окисления 1 Плотность 1,532 г/см³ Температура плавления 312,2 К Температура кипения 961 К
Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Руби дий / Rubidium (Rb) Внешний вид простого вещества Серебристо-белый мягкий металл Электронная конфигурация [Kr] 5s1 Степень окисления 1 Плотность 1,532 г/см³ Температура плавления 312,2 К Температура кипения 961 К
Cлайд 25
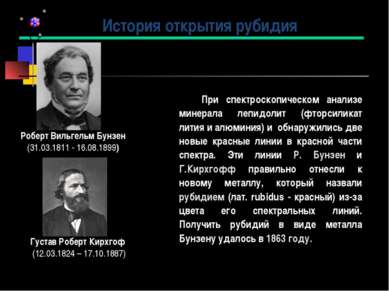 При спектроскопическом анализе минерала лепидолит (фторсиликат лития и алюминия) и обнаружились две новые красные линии в красной части спектра. Эти линии Р. Бунзен и Г.Кирхгофф правильно отнесли к новому металлу, который назвали рубидием (лат. rubidus - красный) из-за цвета его спектральных линий. Получить рубидий в виде металла Бунзену удалось в 1863 году. История открытия рубидия Роберт Вильгельм Бунзен (31.03.1811 - 16.08.1899) Густав Роберт Кирхгоф (12.03.1824 – 17.10.1887)
При спектроскопическом анализе минерала лепидолит (фторсиликат лития и алюминия) и обнаружились две новые красные линии в красной части спектра. Эти линии Р. Бунзен и Г.Кирхгофф правильно отнесли к новому металлу, который назвали рубидием (лат. rubidus - красный) из-за цвета его спектральных линий. Получить рубидий в виде металла Бунзену удалось в 1863 году. История открытия рубидия Роберт Вильгельм Бунзен (31.03.1811 - 16.08.1899) Густав Роберт Кирхгоф (12.03.1824 – 17.10.1887)
Cлайд 26
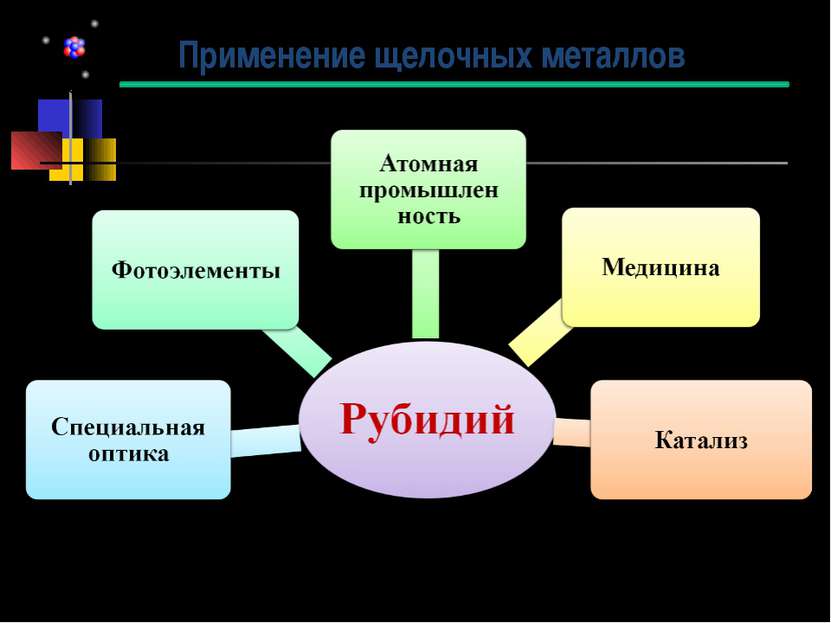
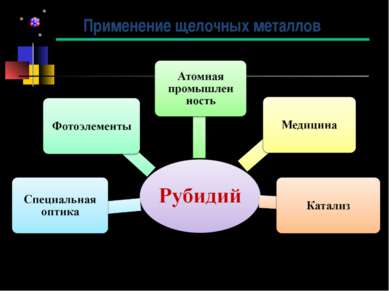
 Получение Большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения лития в виде карбоната или гидроксида рубидий осаждают из маточных растворов в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов RbAl(SO4)2·12H2O, KAl(SO4)2·12H2O, CsAl(SO4)2·12H2O. Смесь разделяют многократной перекристаллизацией. Рубидий также выделяют и из отработанного электролита, получающегося при получении магния из карналлита. Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозёма из нефелина. Для извлечения рубидия используют методы экстракции и ионообменной хроматографии. Соединения рубидия высокой чистоты получают с использованием полигалогенидов. Значительную часть производимого рубидия выделяют в ходе получения лития, поэтому появление большого интереса к литию для использования его в термоядерных процессах в 1950-х привело к увеличению добычи лития, а, следовательно, и рубидия. Именно поэтому соединения рубидия стали более доступными.
Получение Большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения лития в виде карбоната или гидроксида рубидий осаждают из маточных растворов в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов RbAl(SO4)2·12H2O, KAl(SO4)2·12H2O, CsAl(SO4)2·12H2O. Смесь разделяют многократной перекристаллизацией. Рубидий также выделяют и из отработанного электролита, получающегося при получении магния из карналлита. Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозёма из нефелина. Для извлечения рубидия используют методы экстракции и ионообменной хроматографии. Соединения рубидия высокой чистоты получают с использованием полигалогенидов. Значительную часть производимого рубидия выделяют в ходе получения лития, поэтому появление большого интереса к литию для использования его в термоядерных процессах в 1950-х привело к увеличению добычи лития, а, следовательно, и рубидия. Именно поэтому соединения рубидия стали более доступными.
Cлайд 28
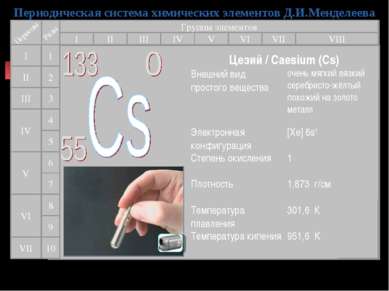 Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Цезий / Caesium (Cs) Внешний вид простого вещества очень мягкий вязкий серебристо-жёлтый похожий на золото металл Электронная конфигурация [Xe] 6s1 Степень окисления 1 Плотность 1,873 г/см Температура плавления 301,6 К Температура кипения 951,6 К
Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Цезий / Caesium (Cs) Внешний вид простого вещества очень мягкий вязкий серебристо-жёлтый похожий на золото металл Электронная конфигурация [Xe] 6s1 Степень окисления 1 Плотность 1,873 г/см Температура плавления 301,6 К Температура кипения 951,6 К
Cлайд 29
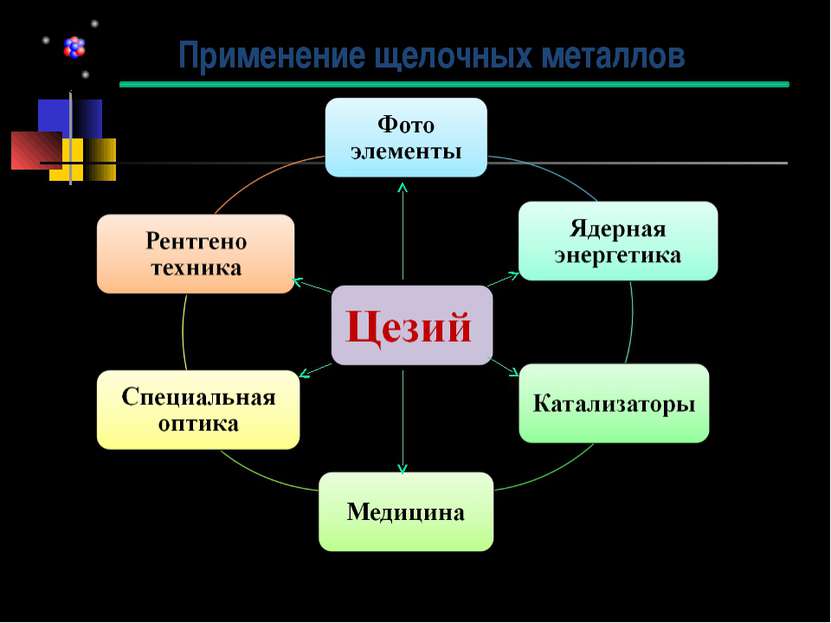
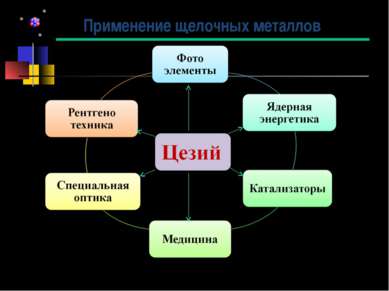
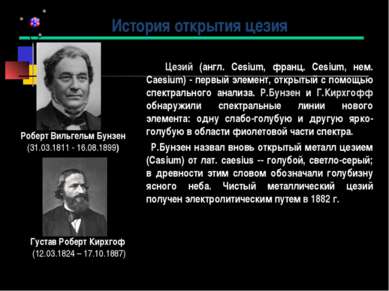 Цезий (англ. Cesium, франц. Cesium, нем. Caesium) - первый элемент, открытый с помощью спектрального анализа. Р.Бунзен и Г.Кирхгофф обнаружили спектральные линии нового элемента: одну слабо-голубую и другую ярко-голубую в области фиолетовой части спектра. Р.Бунзен назвал вновь открытый металл цезием (Casium) от лат. caesius -- голубой, светло-серый; в древности этим словом обозначали голубизну ясного неба. Чистый металлический цезий получен электролитическим путем в 1882 г. История открытия цезия Роберт Вильгельм Бунзен (31.03.1811 - 16.08.1899) Густав Роберт Кирхгоф (12.03.1824 – 17.10.1887)
Цезий (англ. Cesium, франц. Cesium, нем. Caesium) - первый элемент, открытый с помощью спектрального анализа. Р.Бунзен и Г.Кирхгофф обнаружили спектральные линии нового элемента: одну слабо-голубую и другую ярко-голубую в области фиолетовой части спектра. Р.Бунзен назвал вновь открытый металл цезием (Casium) от лат. caesius -- голубой, светло-серый; в древности этим словом обозначали голубизну ясного неба. Чистый металлический цезий получен электролитическим путем в 1882 г. История открытия цезия Роберт Вильгельм Бунзен (31.03.1811 - 16.08.1899) Густав Роберт Кирхгоф (12.03.1824 – 17.10.1887)
Cлайд 30
 Получение Основными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF4]. Кроме того, в виде примесей цезий входит в ряд алюмосиликатов: лепидолит, флогопит, биотит, амазонит, петалит, берилл, циннвальдит, лейцит, карналлит. В качестве промышленного сырья используются поллуцит и лепидолит. При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Первое включает обработку исходного минерала подогретой соляной кислотой, добавление хлорида сурьмы SbCl3 для осаждения соединения Cs3[Sb2Cl9] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl. При втором — минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO4)2 · 12H2O. В России после распада СССР промышленная добыча поллуцита не велась, хотя в Вороньей тундре под Мурманском ещё в советское время были обнаружены колоссальные запасы минерала. К тому времени, когда российская промышленность смогла встать на ноги, выяснилось, что лицензию на разработку этого месторождения купила Канадская. В настоящее время переработка и извлечение солей цезия из поллуцита ведется в Новосибирске на ЗАО «Завод редких металлов». Существует несколько лабораторных методов получения цезия. Он может быть получен: нагревом в вакууме смеси хромата или дихромата цезия с цирконием; разложением азида цезия в вакууме; нагревом смеси хлорида цезия и специально подготовленного кальция. Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
Получение Основными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF4]. Кроме того, в виде примесей цезий входит в ряд алюмосиликатов: лепидолит, флогопит, биотит, амазонит, петалит, берилл, циннвальдит, лейцит, карналлит. В качестве промышленного сырья используются поллуцит и лепидолит. При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Первое включает обработку исходного минерала подогретой соляной кислотой, добавление хлорида сурьмы SbCl3 для осаждения соединения Cs3[Sb2Cl9] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl. При втором — минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO4)2 · 12H2O. В России после распада СССР промышленная добыча поллуцита не велась, хотя в Вороньей тундре под Мурманском ещё в советское время были обнаружены колоссальные запасы минерала. К тому времени, когда российская промышленность смогла встать на ноги, выяснилось, что лицензию на разработку этого месторождения купила Канадская. В настоящее время переработка и извлечение солей цезия из поллуцита ведется в Новосибирске на ЗАО «Завод редких металлов». Существует несколько лабораторных методов получения цезия. Он может быть получен: нагревом в вакууме смеси хромата или дихромата цезия с цирконием; разложением азида цезия в вакууме; нагревом смеси хлорида цезия и специально подготовленного кальция. Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
Cлайд 32
 Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Франций / Francium (Fr) Внешний вид простого вещества радиоактивный щелочной металл Электронная конфигурация [Rn] 7s1 Степень окисления 1 Плотность 1,87 г/см Температура плавления 300 К Температура кипения 950 К
Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 Франций / Francium (Fr) Внешний вид простого вещества радиоактивный щелочной металл Электронная конфигурация [Rn] 7s1 Степень окисления 1 Плотность 1,87 г/см Температура плавления 300 К Температура кипения 950 К
Cлайд 33
 Этот элемент был предсказан Д.И.Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г. Маргаритой Пере, сотрудницей Института радия в Париже с порядковым номером Z = 87 и периодом полураспада 21 мин. Она же дала ему в 1964 г. название в честь своей родины – франций. . Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций. ПЕРЕ (Perey) Маргарита (19.10.1909 - 13.05.1975) История открытия франция
Этот элемент был предсказан Д.И.Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г. Маргаритой Пере, сотрудницей Института радия в Париже с порядковым номером Z = 87 и периодом полураспада 21 мин. Она же дала ему в 1964 г. название в честь своей родины – франций. . Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций. ПЕРЕ (Perey) Маргарита (19.10.1909 - 13.05.1975) История открытия франция
Cлайд 34
 Получение Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций. Наиболее распространённый способ получения франция путём ядерной реакции: Интересно, что в данной реакции используется золото. С помощью этой реакции могут быть синтезированы изотопы с массовыми числами 209, 210 и 211. Однако все эти изотопы распадаются быстро (период полураспада 210Fr и 211Fr — три минуты, а 209Fr — 50 секунд).
Получение Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций. Наиболее распространённый способ получения франция путём ядерной реакции: Интересно, что в данной реакции используется золото. С помощью этой реакции могут быть синтезированы изотопы с массовыми числами 209, 210 и 211. Однако все эти изотопы распадаются быстро (период полураспада 210Fr и 211Fr — три минуты, а 209Fr — 50 секунд).









![Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бес... Сподуменн Фотография Описание минерала Химический состав LiAl[Si2O6] Цвет Бес...](https://bigslide.ru/images/40/39666/831/img10.jpg)