X
Код презентации скопируйте его
Соли: свойства, получение, применение (8 класс)
Скачать эту презентациюПрезентация на тему Соли: свойства, получение, применение (8 класс)
Скачать эту презентациюCлайд 1
 Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа № 21» г. Мурманск Соли: свойства, получение, применение 8 класс. УМК О. С. Габриелян Автор Булакова С. В., учитель химии
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа № 21» г. Мурманск Соли: свойства, получение, применение 8 класс. УМК О. С. Габриелян Автор Булакова С. В., учитель химии
Cлайд 2
 4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные оксиды)? Проверка домашнего задания Проверка дз
4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что такое основания? 5. Что такое основные оксиды, (кислотные оксиды)? Проверка домашнего задания Проверка дз
Cлайд 3
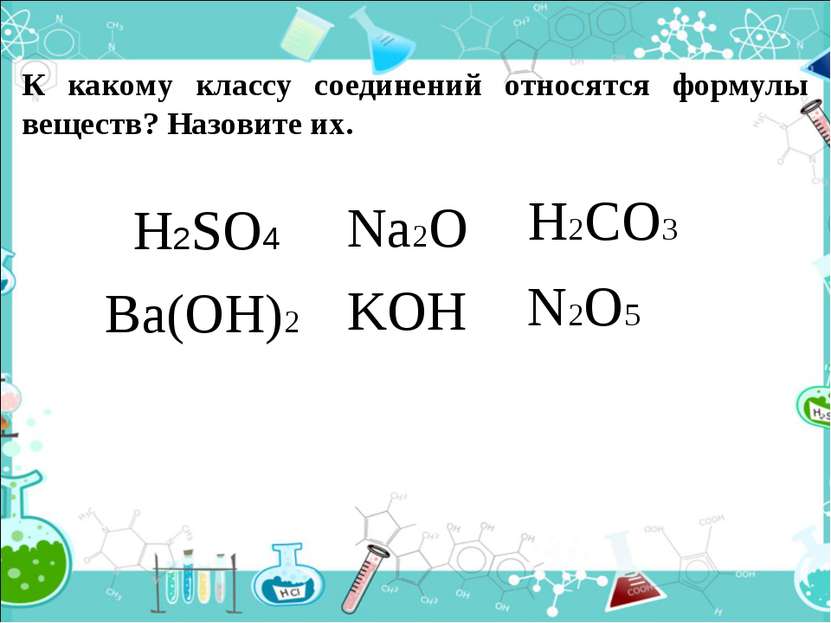
 К какому классу соединений относятся формулы веществ? Назовите их. H2SO4 Na2O Ba(OH)2 H2CO3 N2O5 KOH СЛАЙД 3.
К какому классу соединений относятся формулы веществ? Назовите их. H2SO4 Na2O Ba(OH)2 H2CO3 N2O5 KOH СЛАЙД 3.
Cлайд 4
 О каком веществе идёт речь? У травоядных животных потребность в этом веществе велика. В тех странах, где этого вещества мало, люди прибегали к различным способам чтобы ... Меланезийцы каждое утро пили морскую воду, в Новой Зеландии пищу запивали морской водой, в Северной Америке индейские племена высушивали морскую капусту и добавляли её в пищу.
О каком веществе идёт речь? У травоядных животных потребность в этом веществе велика. В тех странах, где этого вещества мало, люди прибегали к различным способам чтобы ... Меланезийцы каждое утро пили морскую воду, в Новой Зеландии пищу запивали морской водой, в Северной Америке индейские племена высушивали морскую капусту и добавляли её в пищу.
Cлайд 5
 • научить составлять формулы солей и давать им названия; • узнать классификацию, свойства солей, способы получения и применение солей. Цели урока:
• научить составлять формулы солей и давать им названия; • узнать классификацию, свойства солей, способы получения и применение солей. Цели урока:
Cлайд 6
 Задачи: Научить находить среди неорганических веществ формулы солей; составлять формулы солей; называть соли.
Задачи: Научить находить среди неорганических веществ формулы солей; составлять формулы солей; называть соли.
Cлайд 7
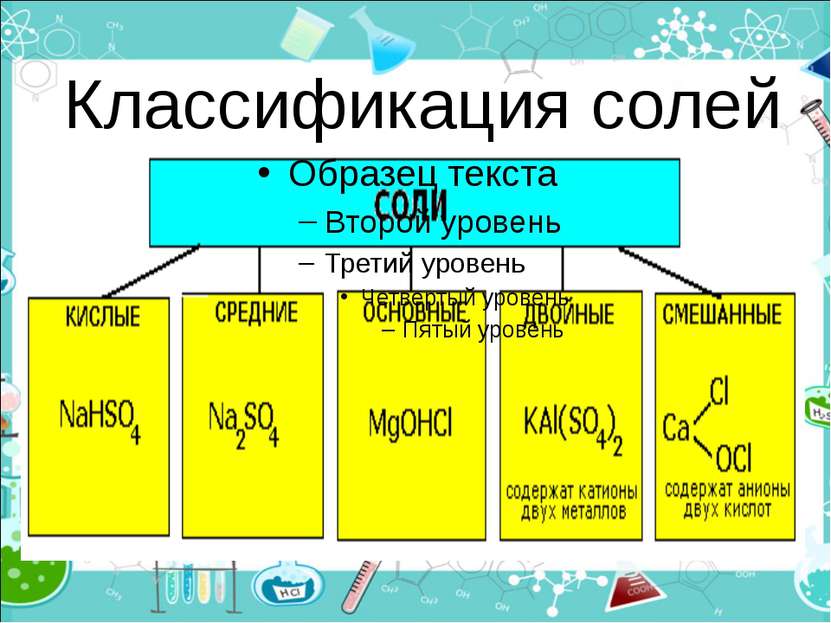
 План урока: 6. Химические свойства. 1. Что такое соли? 2. Классификация солей. 3. Номенклатура солей. 4. Физические свойства. 5. Химические свойства. 6. Получение. 7. Применение. 8. Некоторые интересные факты.
План урока: 6. Химические свойства. 1. Что такое соли? 2. Классификация солей. 3. Номенклатура солей. 4. Физические свойства. 5. Химические свойства. 6. Получение. 7. Применение. 8. Некоторые интересные факты.
Cлайд 8
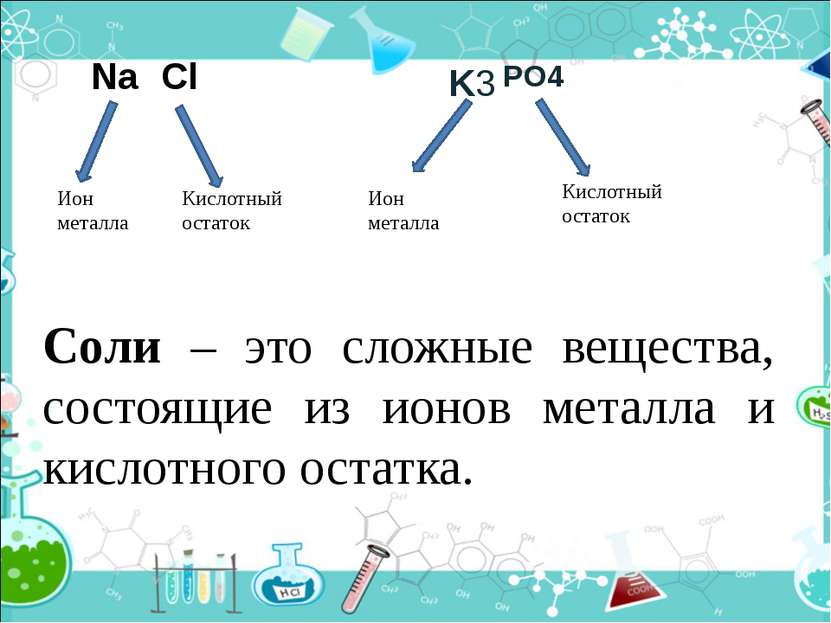
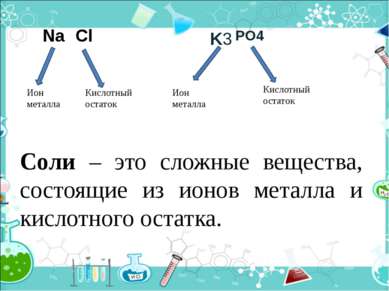 PO4 Ион металла Кислотный остаток Ион металла Кислотный остаток Na Cl K3 Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
PO4 Ион металла Кислотный остаток Ион металла Кислотный остаток Na Cl K3 Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
Cлайд 9
 Найдите среди формул веществ- формулы солей CO2 H2 SO4 CaO BaSO4 K2SO4 Fe(OH)3 HCl MgCO3 H2O
Найдите среди формул веществ- формулы солей CO2 H2 SO4 CaO BaSO4 K2SO4 Fe(OH)3 HCl MgCO3 H2O
Cлайд 11
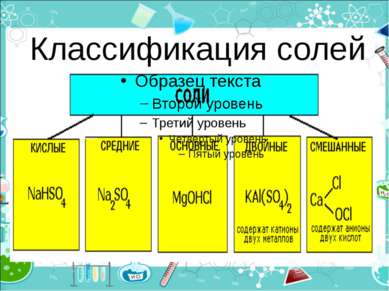
 Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла (KCl) Кислые соли — атомы водорода в кислоте замещены атомами металла частично (NaHCO3) Осно вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. ( ( CuOH)2CO3)
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла (KCl) Кислые соли — атомы водорода в кислоте замещены атомами металла частично (NaHCO3) Осно вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. ( ( CuOH)2CO3)
Cлайд 12
 Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами (KAl(SO4)2х12H2O) Смешанные соли — в их составе присутствует два различных аниона (Ca(OCl)Cl)
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами (KAl(SO4)2х12H2O) Смешанные соли — в их составе присутствует два различных аниона (Ca(OCl)Cl)
Cлайд 13
 Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
Cлайд 14
 Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в родительном падеже NaHSO4 сульфат гидро натрия
Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в родительном падеже NaHSO4 сульфат гидро натрия
Cлайд 15
 Номенклатура основных солей Указать название кислотного остатка К названию кислотного остатка прибавить «основной-» Наименование металла в родительном падеже MgOHCl хлорид основной магния
Номенклатура основных солей Указать название кислотного остатка К названию кислотного остатка прибавить «основной-» Наименование металла в родительном падеже MgOHCl хлорид основной магния
Cлайд 16
 Номенклатура двойных солей таллия (I) -натрия Название кислотного остатка Наименование металлов в родительном падеже NaTl(NO3)2 нитрат
Номенклатура двойных солей таллия (I) -натрия Название кислотного остатка Наименование металлов в родительном падеже NaTl(NO3)2 нитрат
Cлайд 17
 Номенклатура смешанных солей кальция Название кислотных остатков Наименование металла в родительном падеже CaCLOCL хлорид-гипохлорит
Номенклатура смешанных солей кальция Название кислотных остатков Наименование металла в родительном падеже CaCLOCL хлорид-гипохлорит
Cлайд 19
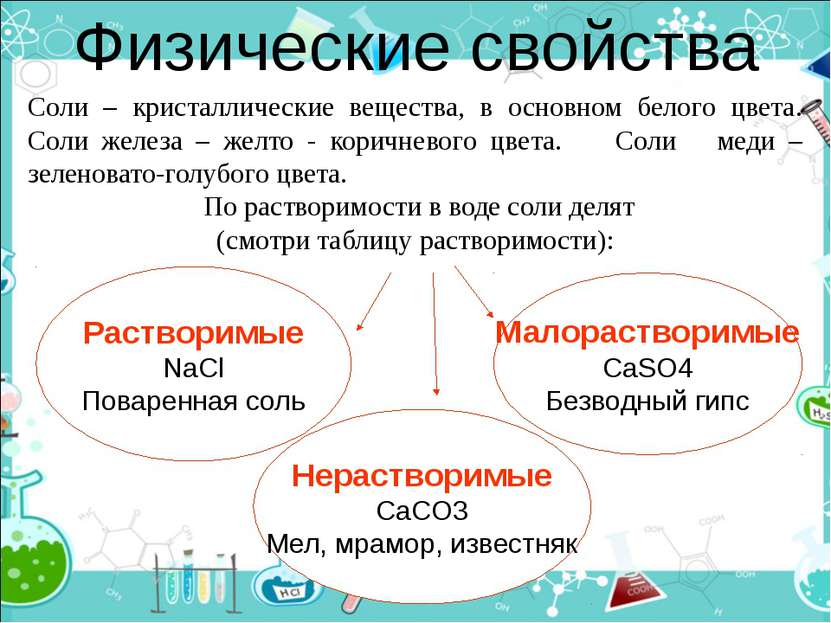
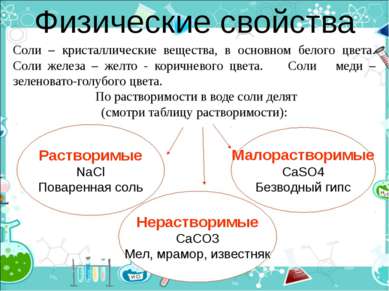 Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета. По растворимости в воде соли делят (смотри таблицу растворимости): Нерастворимые CaCO3 Мел, мрамор, известняк Малорастворимые CaSO4 Безводный гипс
Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета. По растворимости в воде соли делят (смотри таблицу растворимости): Нерастворимые CaCO3 Мел, мрамор, известняк Малорастворимые CaSO4 Безводный гипс
Cлайд 20
 Химические свойства 1. Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из раствора его соли. Fe + CuCI2=Cu + FeCI2 Fe° + Cu²+ + 2CI = Cu° + Fe²+ +2CI- Fe° + Cu²+ = Cu° + Fe²+ или Fe° – 2e → Fe²+ │ процесс окисления (восстановитель) Cu²+ + 2e → Cu° │ процесс восстановления (окислитель)
Химические свойства 1. Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из раствора его соли. Fe + CuCI2=Cu + FeCI2 Fe° + Cu²+ + 2CI = Cu° + Fe²+ +2CI- Fe° + Cu²+ = Cu° + Fe²+ или Fe° – 2e → Fe²+ │ процесс окисления (восстановитель) Cu²+ + 2e → Cu° │ процесс восстановления (окислитель)
Cлайд 21
 Химические свойства 2. Взаимодействие со щелочами: В результате обязательно должно образоваться нерастворимое основание. 3. Взаимодействие солей между собой: 2NaОН + CuSO4 → Cu(OH)2 + Na2SO4 КСl + AgNO3 → AgCl + KNO3
Химические свойства 2. Взаимодействие со щелочами: В результате обязательно должно образоваться нерастворимое основание. 3. Взаимодействие солей между собой: 2NaОН + CuSO4 → Cu(OH)2 + Na2SO4 КСl + AgNO3 → AgCl + KNO3
Cлайд 22
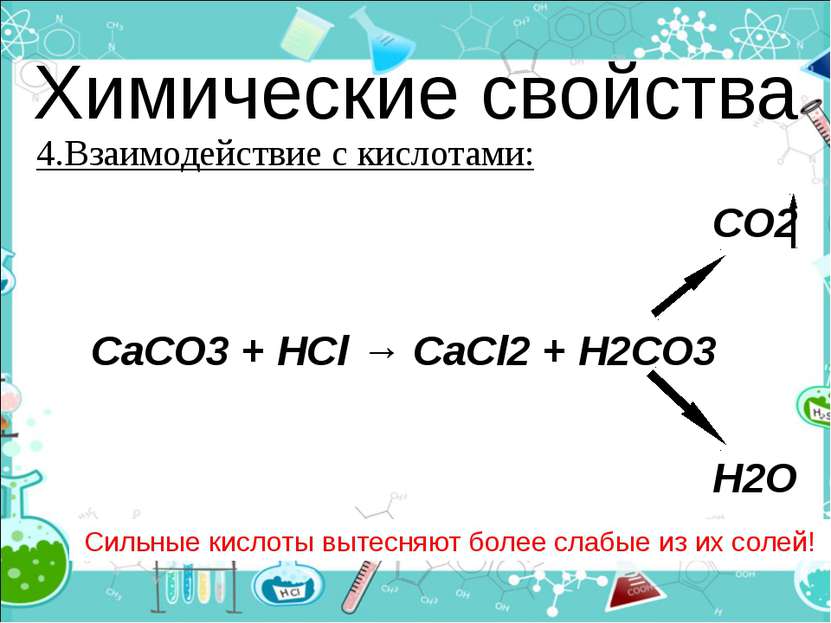
 Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 + HCl → CaCl2 + H2CO3 H2O
Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 + HCl → CaCl2 + H2CO3 H2O
Cлайд 24
 Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O 2. Кислота + металл = соль + водород 2HCL +Zn = ZnCL2 + H2 3. Кислота + основный оксид = соль + вода 2HCL + CuO = CuCL2 + H2O 4. Кислота + соль = новая кислота + новая соль H2SO4 + BaCL2 = 2HCL + BaSO4 Условия: в результате реакции должны получиться газ, осадок или вода. Основаны на химических свойствах оксидов, оснований, кислот
Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O 2. Кислота + металл = соль + водород 2HCL +Zn = ZnCL2 + H2 3. Кислота + основный оксид = соль + вода 2HCL + CuO = CuCL2 + H2O 4. Кислота + соль = новая кислота + новая соль H2SO4 + BaCL2 = 2HCL + BaSO4 Условия: в результате реакции должны получиться газ, осадок или вода. Основаны на химических свойствах оксидов, оснований, кислот
Cлайд 25
 Способы получения 5. Основание + соль = новое основание + новая соль 2КОН + СаSO4 = Са(ОН) 2 + К2SO4 6. Основание + кислотный оксид + = соль + вода 2NaOH + SO3 = Na2SO4 + H2O 7. Кислотный оксид + основный оксид = соль СО2+ СаО = СаСО3 8. Соль + соль = новая соль + новая соль КСl + AgNO3 → AgCl + KNO3 9. Соль + металл = новая соль + металл CuSO4 + Fe = FeSO4 + Cu 10. Металл + неметалл = соль Fe +S = FeS
Способы получения 5. Основание + соль = новое основание + новая соль 2КОН + СаSO4 = Са(ОН) 2 + К2SO4 6. Основание + кислотный оксид + = соль + вода 2NaOH + SO3 = Na2SO4 + H2O 7. Кислотный оксид + основный оксид = соль СО2+ СаО = СаСО3 8. Соль + соль = новая соль + новая соль КСl + AgNO3 → AgCl + KNO3 9. Соль + металл = новая соль + металл CuSO4 + Fe = FeSO4 + Cu 10. Металл + неметалл = соль Fe +S = FeS
Cлайд 26
 Применение солей Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Применение солей Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Cлайд 27
 Применение солей Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Применение солей Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Cлайд 28
 Применение солей Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
Применение солей Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
Cлайд 29
 Применение солей Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Применение солей Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия (соду) применяют в производстве стекла и при варке мыла. Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Cлайд 31
 Розовое озеро в Сенегале Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых. Местные женщины проводят до 14 часов в день собирая там соль.
Розовое озеро в Сенегале Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых. Местные женщины проводят до 14 часов в день собирая там соль.
Cлайд 32
 Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте около 3700 м. Его площадь составляет 10,5 квадратных километров. В центре толщина соли достигает 10 метров. Это озеро содержит более 10 миллиардов тонн соли. Когда Salar de Uyuni покрывается водой, в нем отражается каждое облако.
Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте около 3700 м. Его площадь составляет 10,5 квадратных километров. В центре толщина соли достигает 10 метров. Это озеро содержит более 10 миллиардов тонн соли. Когда Salar de Uyuni покрывается водой, в нем отражается каждое облако.
Cлайд 33
 Химический диктант 1 вариант 1.соли металла 2. сульфат алюминия 3. белого 4. Cu(OH)2 5. хлора, соды 2 вариант 1. ионов металла и кислотного остатка. 2. нитрат кальция. 3.растворимые, нерастворимые и малорастворимые. 4. CаCL2 5. калийное Критерии оценки 5 правильных ответов — «5» 4 правильных ответов — «4» 3 правильных ответов — «3» Меньше 3 правильных ответов — «2»
Химический диктант 1 вариант 1.соли металла 2. сульфат алюминия 3. белого 4. Cu(OH)2 5. хлора, соды 2 вариант 1. ионов металла и кислотного остатка. 2. нитрат кальция. 3.растворимые, нерастворимые и малорастворимые. 4. CаCL2 5. калийное Критерии оценки 5 правильных ответов — «5» 4 правильных ответов — «4» 3 правильных ответов — «3» Меньше 3 правильных ответов — «2»
Cлайд 34
 Сиквейн 1. В первой строчке тема называется одним словом (обычно существительным). 2. Вторая строчка — это описание темы в двух словах (двумя прилагательными). 3. Третья строчка — это описание действия в рамках этой темы тремя словами (глаголами). 4. Четвертая строка — это фраза из четырех слов, показывающая отношение к теме. 5. Последняя строка — это синоним из одного слова, который повторяет суть темы.
Сиквейн 1. В первой строчке тема называется одним словом (обычно существительным). 2. Вторая строчка — это описание темы в двух словах (двумя прилагательными). 3. Третья строчка — это описание действия в рамках этой темы тремя словами (глаголами). 4. Четвертая строка — это фраза из четырех слов, показывающая отношение к теме. 5. Последняя строка — это синоним из одного слова, который повторяет суть темы.
Cлайд 35
 Сиквейн 1. Соль 2. Белая, кристаллическая 3. Солит, удобряет, растворяется 4. Соль наносит вред здоровью 5. Селитра
Сиквейн 1. Соль 2. Белая, кристаллическая 3. Солит, удобряет, растворяется 4. Соль наносит вред здоровью 5. Селитра
Cлайд 38
 Список используемых источников Рудзитис Г.Е. Химия. Неорганическая химия. 8 класс: Учебник для общеобразовательных учреждений с прил. на электрон. носителе: базовый уровень. Просвещение, 2011 – 176 с. Журнал Химия в школе №7. 2012 год [стр. 24-25]; •Дидактический и раздаточный материал. Издательство «Учитель», 2012 http://school-collection.edu.ru/collection/organic/ http://ru.wikipedia.org/wiki/ • http://www.chemnet.ru • http://www.hij.ru • http://him-school.ru • www.bfnm.ru
Список используемых источников Рудзитис Г.Е. Химия. Неорганическая химия. 8 класс: Учебник для общеобразовательных учреждений с прил. на электрон. носителе: базовый уровень. Просвещение, 2011 – 176 с. Журнал Химия в школе №7. 2012 год [стр. 24-25]; •Дидактический и раздаточный материал. Издательство «Учитель», 2012 http://school-collection.edu.ru/collection/organic/ http://ru.wikipedia.org/wiki/ • http://www.chemnet.ru • http://www.hij.ru • http://him-school.ru • www.bfnm.ru