X
Код презентации скопируйте его
Гидролиз солей
Скачать эту презентациюПрезентация на тему Гидролиз солей
Скачать эту презентациюCлайд 1
 «Гидролиз солей» Тема урока: Новикова Ирина Петровна учитель химии МОУ Совхозная сош Тамбовский район
«Гидролиз солей» Тема урока: Новикова Ирина Петровна учитель химии МОУ Совхозная сош Тамбовский район
Cлайд 9
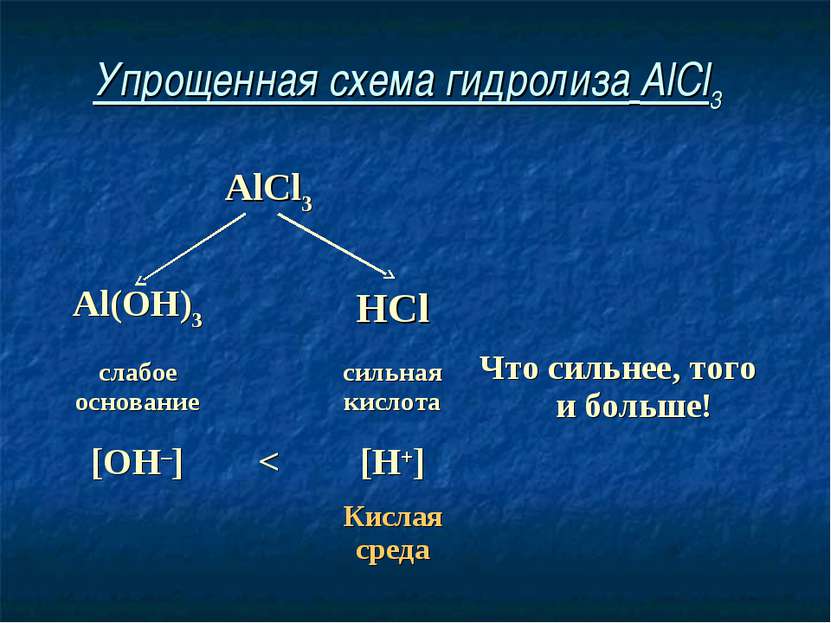
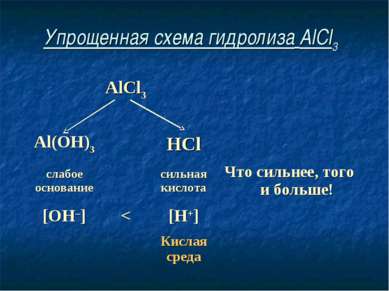 Упрощенная схема гидролиза AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота Что сильнее, того и больше! [OH–] < [H+] Кислая среда
Упрощенная схема гидролиза AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота Что сильнее, того и больше! [OH–] < [H+] Кислая среда
Cлайд 10
 Соль, образованная слабым основанием и сильной кислотой, имеет кислую среду, так как в растворе избыток ионов водорода.
Соль, образованная слабым основанием и сильной кислотой, имеет кислую среду, так как в растворе избыток ионов водорода.
Cлайд 11
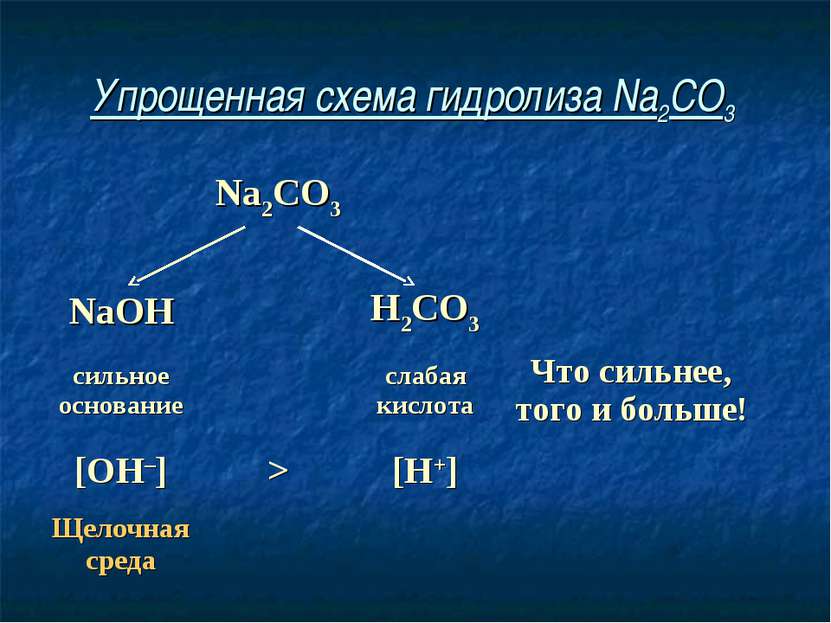
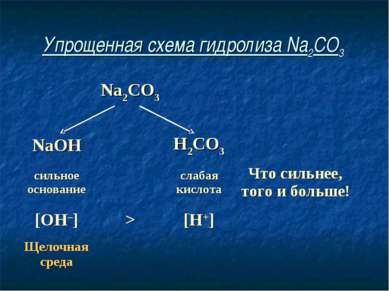 Упрощенная схема гидролиза Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота Что сильнее, того и больше! [OH–] > [H+] Щелочная среда
Упрощенная схема гидролиза Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота Что сильнее, того и больше! [OH–] > [H+] Щелочная среда
Cлайд 12
 Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
Cлайд 13
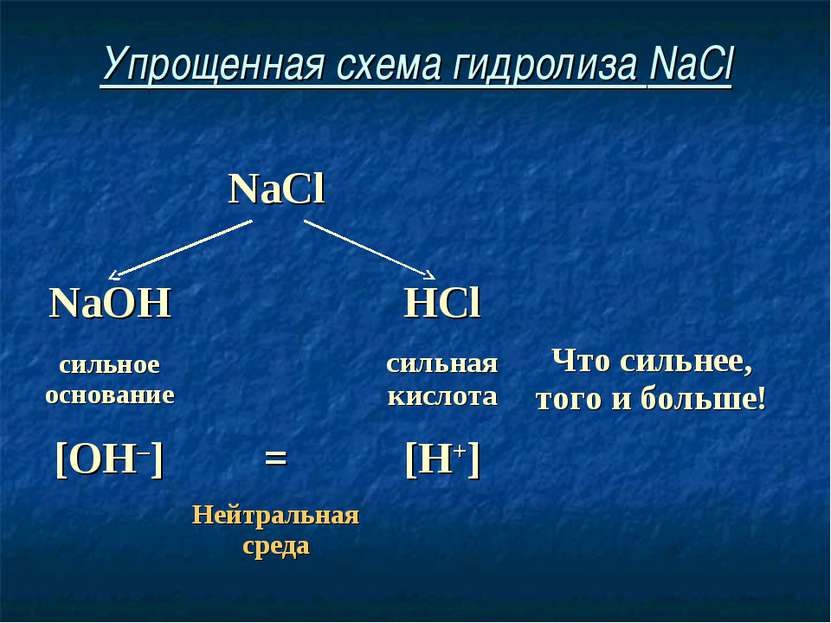
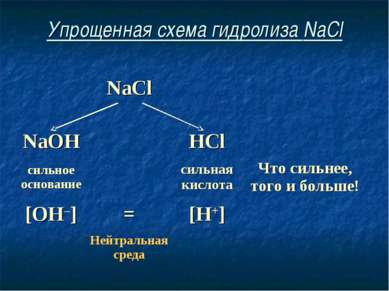 Упрощенная схема гидролиза NaCl NaCl NaOH HCl сильное основание сильная кислота Что сильнее, того и больше! [OH–] = [H+] Нейтральная среда
Упрощенная схема гидролиза NaCl NaCl NaOH HCl сильное основание сильная кислота Что сильнее, того и больше! [OH–] = [H+] Нейтральная среда
Cлайд 14
 Соль, образованная сильным основанием и сильной кислотой, имеет нейтральную среду, так как в растворе одинаковое количество ионов водорода и гидроксид-ионов.
Соль, образованная сильным основанием и сильной кислотой, имеет нейтральную среду, так как в растворе одинаковое количество ионов водорода и гидроксид-ионов.
Cлайд 15
 Гидролиз — это реакция обмена между некоторыми солями и водой («гидро» — вода, «лизис» — разложение)
Гидролиз — это реакция обмена между некоторыми солями и водой («гидро» — вода, «лизис» — разложение)
Cлайд 18
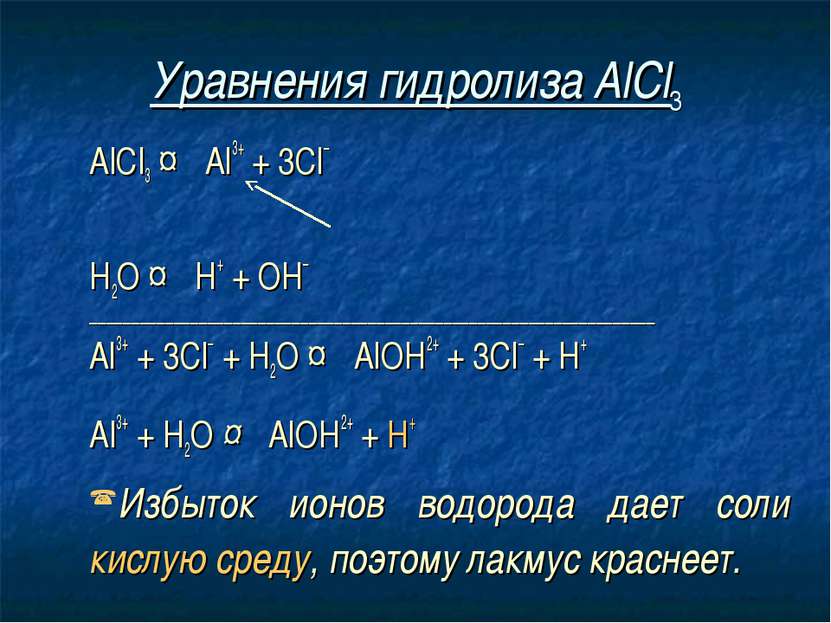
 Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________
Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________
Cлайд 19
 Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+
Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+
Cлайд 20
 Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Аl3+ + Н2O ↔ АlOН2+ + Н+
Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Аl3+ + Н2O ↔ АlOН2+ + Н+
Cлайд 21
 Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– ___________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Аl3+ + Н2O ↔ АlOН2+ + Н+ Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет.
Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– ___________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Аl3+ + Н2O ↔ АlOН2+ + Н+ Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет.
Cлайд 24
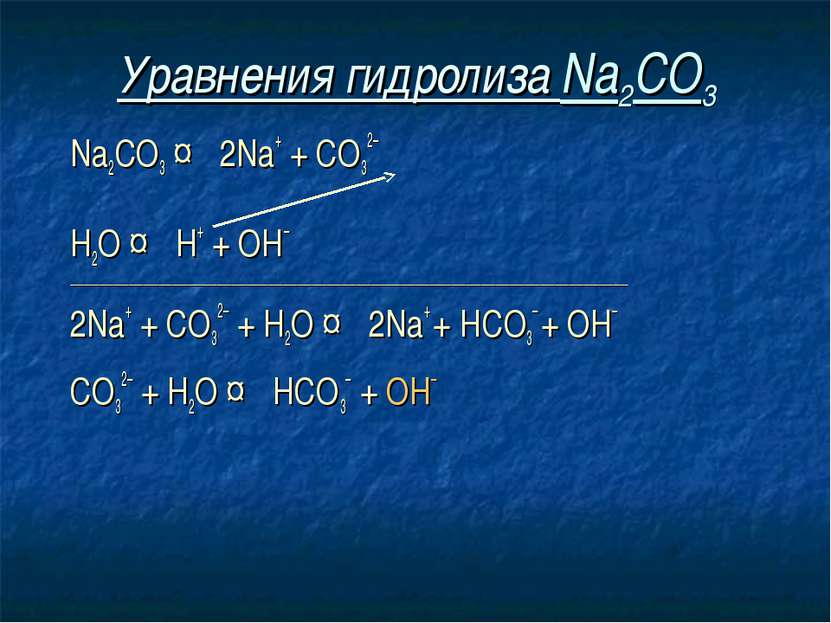
 Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________
Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________
Cлайд 25
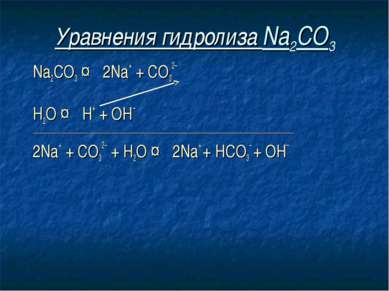 Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН–
Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН–
Cлайд 26
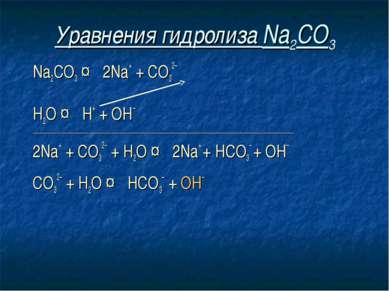 Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– СO32– + Н2O ↔ НСO3– + ОН–
Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– СO32– + Н2O ↔ НСO3– + ОН–
Cлайд 27
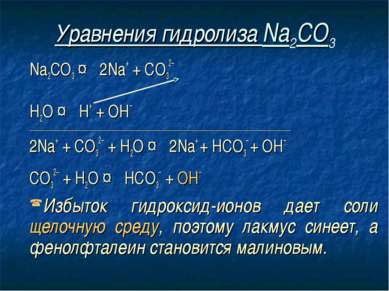 Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– СO32– + Н2O ↔ НСO3– + ОН– Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.
Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– СO32– + Н2O ↔ НСO3– + ОН– Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.
Cлайд 28
 Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ + Сl– + Н2O ↔ Na+ + Cl– + H2O Одинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).
Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ + Сl– + Н2O ↔ Na+ + Cl– + H2O Одинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).
Cлайд 29
 Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант а) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария Составьте ионное уравнение гидролиза этих солей.
Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант а) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария Составьте ионное уравнение гидролиза этих солей.
Cлайд 31
 а) 1 вариант Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+ + 2NO3– + Н2O ↔ ZnOН+ + 2NO3– + Н+ Zn2+ + Н2O ↔ ZnOН+ + Н+ (среда кислая) 2 вариант CuCl2 ↔ Cu2+ + 2Сl – Н2O ↔ Н+ + ОН – _______________________________________________________________________________________________________________________ Cu2+ + Сl – + Н2O ↔ CuOH+ + Cl – + Н+ Сu2+ + Н2O ↔ СuOH+ + Н+ (среда кислая)
а) 1 вариант Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+ + 2NO3– + Н2O ↔ ZnOН+ + 2NO3– + Н+ Zn2+ + Н2O ↔ ZnOН+ + Н+ (среда кислая) 2 вариант CuCl2 ↔ Cu2+ + 2Сl – Н2O ↔ Н+ + ОН – _______________________________________________________________________________________________________________________ Cu2+ + Сl – + Н2O ↔ CuOH+ + Cl – + Н+ Сu2+ + Н2O ↔ СuOH+ + Н+ (среда кислая)
Cлайд 32
 б) 1 вариант K2SO4 ↔ 2K+ + SO42– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2K+ + SO42– + Н2O ↔ 2K+ + SO42– + H2O (среда нейтральная) 2 вариант Na2SO3 ↔ 2Na+ + SO32– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + SO32– + Н2O ↔ 2Na+ + HSO3– + ОН SO32– + Н2O ↔ НSO3– + ОН – (среда щелочная)
б) 1 вариант K2SO4 ↔ 2K+ + SO42– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2K+ + SO42– + Н2O ↔ 2K+ + SO42– + H2O (среда нейтральная) 2 вариант Na2SO3 ↔ 2Na+ + SO32– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + SO32– + Н2O ↔ 2Na+ + HSO3– + ОН SO32– + Н2O ↔ НSO3– + ОН – (среда щелочная)
Cлайд 33
 в) 1 вариант Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + S2– + Н2O ↔ 2Na+ + HS– + ОН – S2– + Н2O ↔ НS– + ОН – (среда щелочная) 2 вариант Ba(NO3)2 ↔ Ba2+ + 2NO3– Н2O ↔ Н+ + ОН – ___________________________________________________________________ Ba2+ + 2NO3– + Н2O ↔ Ba2+ + 2NO3– + Н2O (среда нейтральная)
в) 1 вариант Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + S2– + Н2O ↔ 2Na+ + HS– + ОН – S2– + Н2O ↔ НS– + ОН – (среда щелочная) 2 вариант Ba(NO3)2 ↔ Ba2+ + 2NO3– Н2O ↔ Н+ + ОН – ___________________________________________________________________ Ba2+ + 2NO3– + Н2O ↔ Ba2+ + 2NO3– + Н2O (среда нейтральная)
Cлайд 34
 О значении и применении гидролиза... Под действием биологических катализаторов — ферментов в организме человека происходит гидролиз крахмала, целлюлозы, белка, жиров. В технике крахмал подвергают гидролизу при взаимодействии с разбавленной серной кислотой и превращают в глюкозу (это реакция Кирхгофа, 1811 г.). Продукты гидролиза крахмала широко используются в кондитерской промышленности, медицине, для технических целей. В промышленности гидролизу подвергаются сложные эфиры и жиры обязательно в щелочной среде. Такая реакция называется омылением. На этой реакции основано производство мыла, однако в настоящее время на производство моющих средств идут главным образом продукты переработки нефти. Продукты гидролиза целлюлозы в промышленности — это бумага, хлопчатобумажные ткани.
О значении и применении гидролиза... Под действием биологических катализаторов — ферментов в организме человека происходит гидролиз крахмала, целлюлозы, белка, жиров. В технике крахмал подвергают гидролизу при взаимодействии с разбавленной серной кислотой и превращают в глюкозу (это реакция Кирхгофа, 1811 г.). Продукты гидролиза крахмала широко используются в кондитерской промышленности, медицине, для технических целей. В промышленности гидролизу подвергаются сложные эфиры и жиры обязательно в щелочной среде. Такая реакция называется омылением. На этой реакции основано производство мыла, однако в настоящее время на производство моющих средств идут главным образом продукты переработки нефти. Продукты гидролиза целлюлозы в промышленности — это бумага, хлопчатобумажные ткани.