X
Код презентации скопируйте его
Химические свойства солей (8 класс)
Скачать эту презентациюПрезентация на тему Химические свойства солей (8 класс)
Скачать эту презентациюCлайд 1
 Урок № 58. «Химические свойства солей». Лабораторный опыт № 11 Урок химии в 8 классе по учебнику Габриелян О. С. Учитель химии МОУ «Цибикнурская основная общеобразовательная школа» Ласточкин Э. А. *
Урок № 58. «Химические свойства солей». Лабораторный опыт № 11 Урок химии в 8 классе по учебнику Габриелян О. С. Учитель химии МОУ «Цибикнурская основная общеобразовательная школа» Ласточкин Э. А. *
Cлайд 3
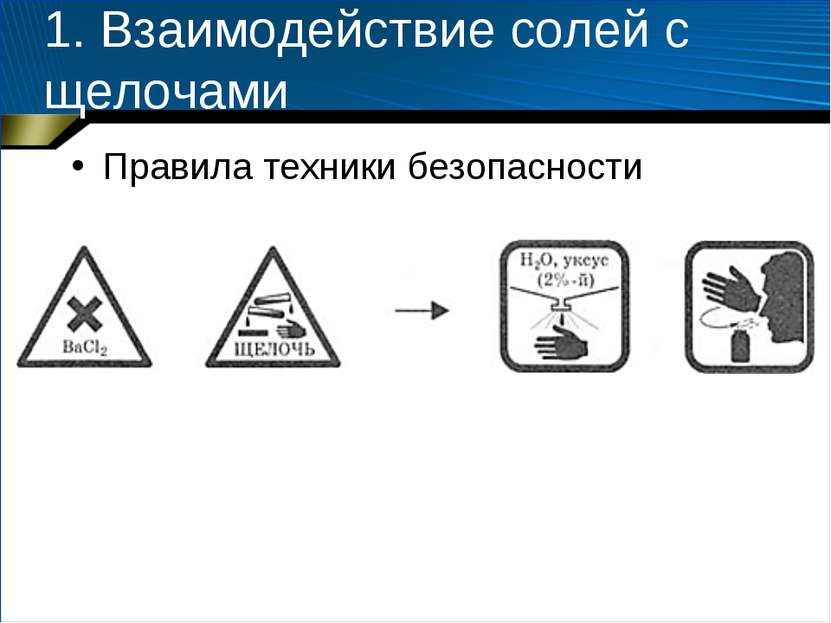
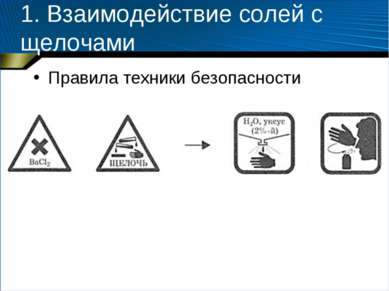
 1. Взаимодействие солей с щелочами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), спиртовка, спички, пробиркодержатель; растворы гидроксида натрия (0,5 моль/л), гидроксида калия (0,5 моль/л), сульфата аммония (0,5 моль/л), хлорида или нитрата бария (0,25 моль/л), сульфата железа (III) (0,5 моль/л).
1. Взаимодействие солей с щелочами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), спиртовка, спички, пробиркодержатель; растворы гидроксида натрия (0,5 моль/л), гидроксида калия (0,5 моль/л), сульфата аммония (0,5 моль/л), хлорида или нитрата бария (0,25 моль/л), сульфата железа (III) (0,5 моль/л).
Cлайд 5
 1. Взаимодействие солей с щелочами Содержание и порядок выполнения опыта 1. В трех пробирках слейте попарно по 1—2 мл растворов веществ: 1-я пробирка: сульфат железа (III) и гидроксид натрия; 2-я пробирка: сульфат аммония и гидроксид калия; 3-я пробирка: нитрат бария и гидроксид калия. 2. Немного нагрейте содержимое 2-й пробирки и определите по запаху один из продуктов реакции. 3. Оформите отчет, заполнив таблицу 7.
1. Взаимодействие солей с щелочами Содержание и порядок выполнения опыта 1. В трех пробирках слейте попарно по 1—2 мл растворов веществ: 1-я пробирка: сульфат железа (III) и гидроксид натрия; 2-я пробирка: сульфат аммония и гидроксид калия; 3-я пробирка: нитрат бария и гидроксид калия. 2. Немного нагрейте содержимое 2-й пробирки и определите по запаху один из продуктов реакции. 3. Оформите отчет, заполнив таблицу 7.
Cлайд 6
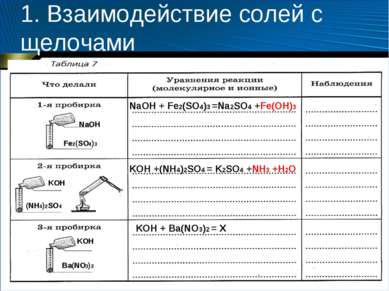 1. Взаимодействие солей с щелочами Fe2(SO4)3 NaOH KOH (NH4)2SO4 KOH Ba(NO3)2 NaOH + Fe2(SO4)3 =Na2SO4 +Fe(OH)3 KOH +(NH4)2SO4 = K2SO4 +NH3 +H2O KOH + Ba(NO3)2 = X
1. Взаимодействие солей с щелочами Fe2(SO4)3 NaOH KOH (NH4)2SO4 KOH Ba(NO3)2 NaOH + Fe2(SO4)3 =Na2SO4 +Fe(OH)3 KOH +(NH4)2SO4 = K2SO4 +NH3 +H2O KOH + Ba(NO3)2 = X
Cлайд 7
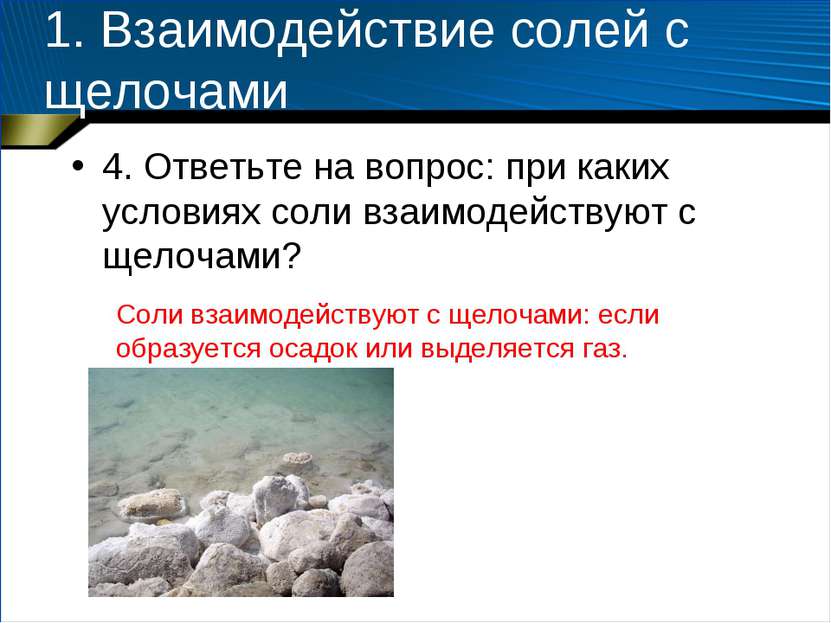
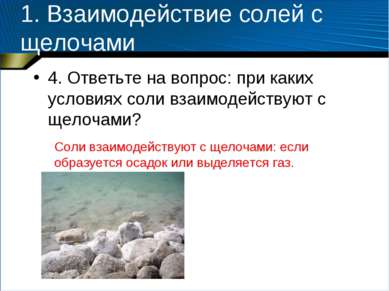 1. Взаимодействие солей с щелочами 4. Ответьте на вопрос: при каких условиях соли взаимодействуют с щелочами? Соли взаимодействуют с щелочами: если образуется осадок или выделяется газ.
1. Взаимодействие солей с щелочами 4. Ответьте на вопрос: при каких условиях соли взаимодействуют с щелочами? Соли взаимодействуют с щелочами: если образуется осадок или выделяется газ.
Cлайд 8
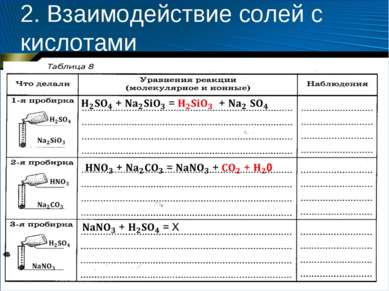
 2. Взаимодействие солей с кислотами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), растворы силиката натрия (0,5 моль/л), карбоната натрия (0,5 моль/л), нитрата натрия (0,5 моль/л), серной кислоты (1 : 5), азотной кислоты (1 : 3).
2. Взаимодействие солей с кислотами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), растворы силиката натрия (0,5 моль/л), карбоната натрия (0,5 моль/л), нитрата натрия (0,5 моль/л), серной кислоты (1 : 5), азотной кислоты (1 : 3).
Cлайд 10
 2. Взаимодействие солей с кислотами Содержание и порядок выполнения опыта 1. В трех пробирках слейте попарно по 1—2 мл растворов веществ: 1-я пробирка: силикат натрия и серная кислота; 2-я пробирка: карбонат натрия и азотная кислота; 3-я пробирка: нитрат натрия и серная кислота. 2. Оформите отчет, заполнив таблицу 8.
2. Взаимодействие солей с кислотами Содержание и порядок выполнения опыта 1. В трех пробирках слейте попарно по 1—2 мл растворов веществ: 1-я пробирка: силикат натрия и серная кислота; 2-я пробирка: карбонат натрия и азотная кислота; 3-я пробирка: нитрат натрия и серная кислота. 2. Оформите отчет, заполнив таблицу 8.
Cлайд 12
 2. Взаимодействие солей с кислотами 3. Ответьте на вопрос: при каких условиях соли взаимодействуют с кислотами? В случае, если образуется осадок или выделяется газ.
2. Взаимодействие солей с кислотами 3. Ответьте на вопрос: при каких условиях соли взаимодействуют с кислотами? В случае, если образуется осадок или выделяется газ.
Cлайд 13
 3. Взаимодействие солей с солями Оборудование и реактивы: штатив для пробирок, пробирки (2 шт.); растворы хлорида бария (0,25 моль/л), сульфата натрия (0,5 моль/л), нитрата серебра (0,01 моль/л).
3. Взаимодействие солей с солями Оборудование и реактивы: штатив для пробирок, пробирки (2 шт.); растворы хлорида бария (0,25 моль/л), сульфата натрия (0,5 моль/л), нитрата серебра (0,01 моль/л).
Cлайд 15
 3. Взаимодействие солей с солями Содержание и порядок выполнения опыта 1. Проведите качественные реакции, подтверждающие состав хлорида бария, используя в качестве реактивов только соли. 2. Отчет оформите, заполнив таблицу 9.
3. Взаимодействие солей с солями Содержание и порядок выполнения опыта 1. Проведите качественные реакции, подтверждающие состав хлорида бария, используя в качестве реактивов только соли. 2. Отчет оформите, заполнив таблицу 9.
Cлайд 17
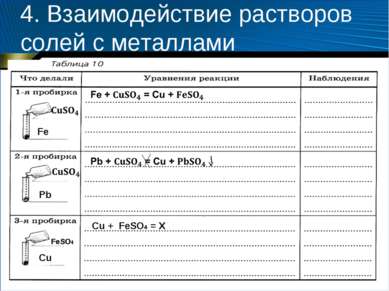
 4. Взаимодействие растворов солей с металлами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), пинцет; металлы: железо (скрепка или гвоздь), свинец (пластина), медь (проволока), растворы сульфата меди (II) (0,5 моль/л) и сульфата железа (II) (0,5 моль/л).
4. Взаимодействие растворов солей с металлами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), пинцет; металлы: железо (скрепка или гвоздь), свинец (пластина), медь (проволока), растворы сульфата меди (II) (0,5 моль/л) и сульфата железа (II) (0,5 моль/л).
Cлайд 19
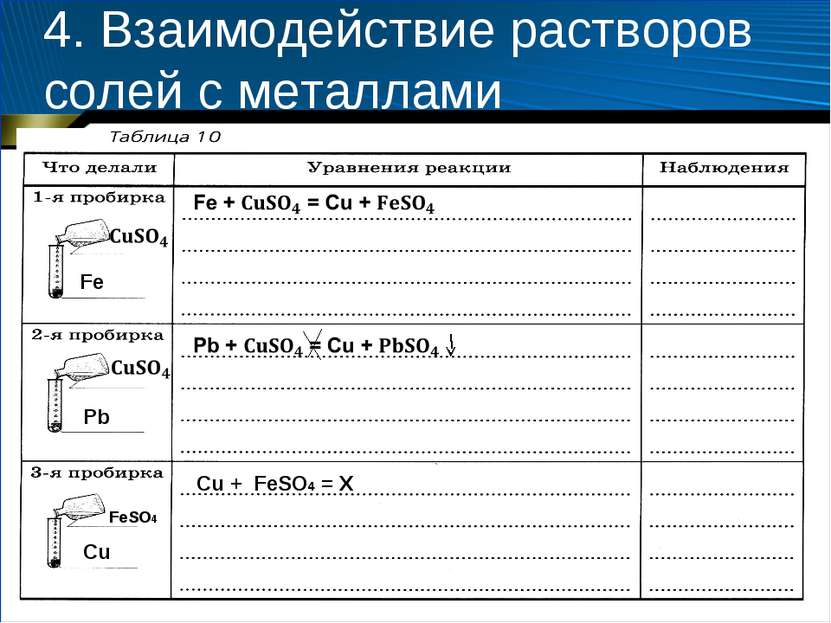
 4. Взаимодействие растворов солей с металлами Содержание и порядок выполнения опыта 1. Возьмите три пробирки. В 1-ю пробирку поместите кусочек железной проволоки (скрепку), во 2-ю — свинцовую пластину, а в 3-ю — медную проволоку. 2. Налейте в 1-ю и 2-ю пробирки по 2—3 мл раствора сульфата меди (II), а в 3-ю — раствор сульфата железа (II). 3. Через 5 минут извлеките с помощью пинцета металлические предметы из растворов и рассмотрите их. 4. Оформите отчет, заполнив таблицу 10. 5. Сделайте вывод о том, в какой из пробирок произошла химическая реакция.
4. Взаимодействие растворов солей с металлами Содержание и порядок выполнения опыта 1. Возьмите три пробирки. В 1-ю пробирку поместите кусочек железной проволоки (скрепку), во 2-ю — свинцовую пластину, а в 3-ю — медную проволоку. 2. Налейте в 1-ю и 2-ю пробирки по 2—3 мл раствора сульфата меди (II), а в 3-ю — раствор сульфата железа (II). 3. Через 5 минут извлеките с помощью пинцета металлические предметы из растворов и рассмотрите их. 4. Оформите отчет, заполнив таблицу 10. 5. Сделайте вывод о том, в какой из пробирок произошла химическая реакция.
Cлайд 21
 4. Взаимодействие растворов солей с металлами 6. Сделайте вывод о взаимодействии растворов солей с металлами, вставив пропущенные слова. Растворы солей взаимодействуют с металлами при соблюдении следующих условий: каждый металл вытесняет из растворов солей другие металлы металлы, находящиеся в ряду напряжений правее его; в результате реакции должна образоваться растворимая соль; для таких реакций не рекомендуется использовать щелочные металлы (Li, Na, K ), так как они взаимодействуют с водой (последнее условие в лабораторной работе не рассматривалось).
4. Взаимодействие растворов солей с металлами 6. Сделайте вывод о взаимодействии растворов солей с металлами, вставив пропущенные слова. Растворы солей взаимодействуют с металлами при соблюдении следующих условий: каждый металл вытесняет из растворов солей другие металлы металлы, находящиеся в ряду напряжений правее его; в результате реакции должна образоваться растворимая соль; для таких реакций не рекомендуется использовать щелочные металлы (Li, Na, K ), так как они взаимодействуют с водой (последнее условие в лабораторной работе не рассматривалось).