X
Код презентации скопируйте его
Соли. Свойства солей
Скачать эту презентациюПрезентация на тему Соли. Свойства солей
Скачать эту презентациюCлайд 5
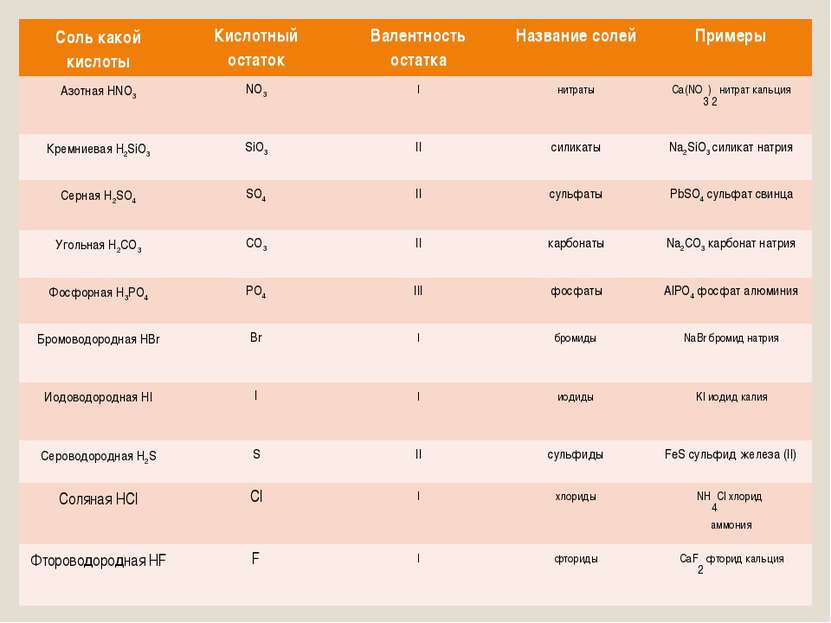
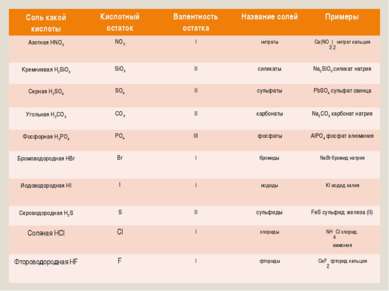 Названия солей Соль какой кислоты Кислотный остаток Валентность остатка Название солей Примеры Азотная HNO3 NO3 I нитраты Ca(NO3)2 нитрат кальция Кремниевая H2SiO3 SiO3 II силикаты Na2SiO3 силикат натрия Серная H2SO4 SO4 II сульфаты PbSO4 сульфат свинца Угольная H2CO3 CO3 II карбонаты Na2CO3 карбонат натрия Фосфорная H3PO4 PO4 III фосфаты AlPO4 фосфат алюминия Бромоводородная HBr Br I бромиды NaBr бромид натрия Иодоводородная HI I I иодиды KI иодид калия Сероводородная H2S S II сульфиды FeS сульфид железа (II) Соляная HCl Cl I хлориды NH4Cl хлорид аммония Фтороводородная HF F I фториды CaF2 фторид кальция
Названия солей Соль какой кислоты Кислотный остаток Валентность остатка Название солей Примеры Азотная HNO3 NO3 I нитраты Ca(NO3)2 нитрат кальция Кремниевая H2SiO3 SiO3 II силикаты Na2SiO3 силикат натрия Серная H2SO4 SO4 II сульфаты PbSO4 сульфат свинца Угольная H2CO3 CO3 II карбонаты Na2CO3 карбонат натрия Фосфорная H3PO4 PO4 III фосфаты AlPO4 фосфат алюминия Бромоводородная HBr Br I бромиды NaBr бромид натрия Иодоводородная HI I I иодиды KI иодид калия Сероводородная H2S S II сульфиды FeS сульфид железа (II) Соляная HCl Cl I хлориды NH4Cl хлорид аммония Фтороводородная HF F I фториды CaF2 фторид кальция
Cлайд 7
 Типы солей Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример. Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример. Осно вные соли — гидроксогруппы основания (OH-) частично замещены кислотными остатками. Пример. Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример. Смешанные соли — в их составе присутствует два различных аниона. Пример. Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример. Комплексные соли — в их состав входит комплексный катион или комплексный анион.
Типы солей Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример. Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример. Осно вные соли — гидроксогруппы основания (OH-) частично замещены кислотными остатками. Пример. Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример. Смешанные соли — в их составе присутствует два различных аниона. Пример. Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример. Комплексные соли — в их состав входит комплексный катион или комплексный анион.
Cлайд 9
 Химические свойства Химические свойства определяются свойствами катионов и анионов, входящих в их состав. Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода): Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов: Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов: Некоторые соли разлагаются при нагревании:
Химические свойства Химические свойства определяются свойствами катионов и анионов, входящих в их состав. Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода): Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов: Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов: Некоторые соли разлагаются при нагревании:
Cлайд 11
 Применение солей Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Применение солей Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды. Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Cлайд 12
 Применение солей Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Применение солей Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс. Декагидрат сульфата натрия используют в качестве сырья для получения соды.