X
Код презентации скопируйте его
Классификация химических реакций (11 класс)
Скачать эту презентациюПрезентация на тему Классификация химических реакций (11 класс)
Скачать эту презентациюCлайд 1
 Выполнила: учитель химии ГБОУ СОШ № 797 г. Москвы Макаркина М.А. Классификация химических реакций Москва 2012
Выполнила: учитель химии ГБОУ СОШ № 797 г. Москвы Макаркина М.А. Классификация химических реакций Москва 2012
Cлайд 2
 это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению. Химические реакции -
это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению. Химические реакции -
Cлайд 3
 По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию катализатора По направлению По механизму По тепловому эффекту По виду энергии, инициирующей реакцию По фазовому составу Классификация химических реакций
По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию катализатора По направлению По механизму По тепловому эффекту По виду энергии, инициирующей реакцию По фазовому составу Классификация химических реакций
Cлайд 4
 I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В неорганической химии к таким реакциям относят процессы получения аллотропных модификаций одного химического элемента, например: Классификация химических реакций Sn (белое олово) Sn (серое олово)
I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В неорганической химии к таким реакциям относят процессы получения аллотропных модификаций одного химического элемента, например: Классификация химических реакций Sn (белое олово) Sn (серое олово)
Cлайд 5
 I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 1. Реакции соединения – реакции, при которых из двух и более веществ образуется одно сложное вещество. Классификация химических реакций S + O2 = SO2 2SO2 + O2 = 2SO3 SO3 + H2O = H2SO4
I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 1. Реакции соединения – реакции, при которых из двух и более веществ образуется одно сложное вещество. Классификация химических реакций S + O2 = SO2 2SO2 + O2 = 2SO3 SO3 + H2O = H2SO4
Cлайд 7
 I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2. Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ. Классификация химических реакций 2HgO = 2Hg + O2 2KNO3 = 2KNO2 + O2 2KMnO4 = K2MnO4 + MnO2 + O2
I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2. Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ. Классификация химических реакций 2HgO = 2Hg + O2 2KNO3 = 2KNO2 + O2 2KMnO4 = K2MnO4 + MnO2 + O2
Cлайд 9
 I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3. Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе. Классификация химических реакций Zn + 2HCl = ZnCl2 + H2 2Na + 2H2O = 2NaOH + H2 Fe + CuSO4 = FeSO4 + Cu↓
I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3. Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе. Классификация химических реакций Zn + 2HCl = ZnCl2 + H2 2Na + 2H2O = 2NaOH + H2 Fe + CuSO4 = FeSO4 + Cu↓
Cлайд 11
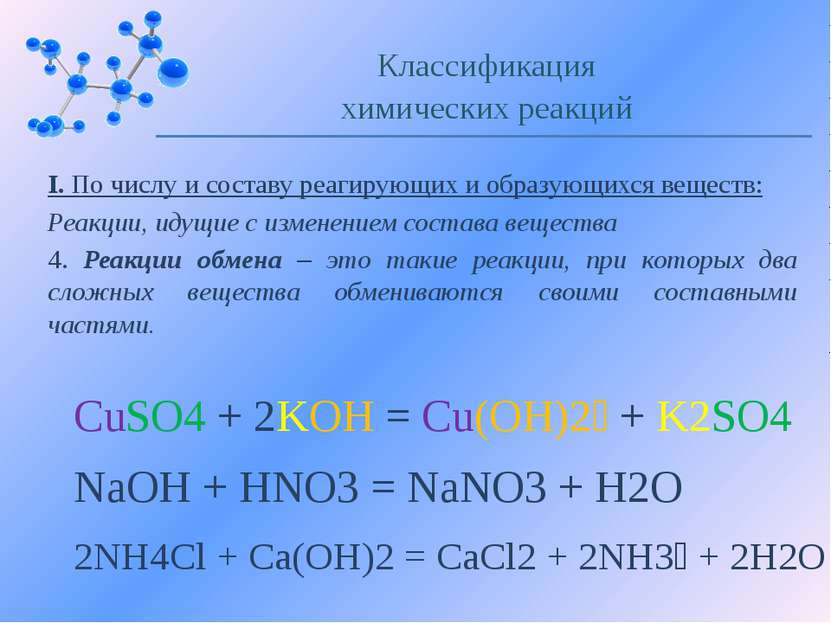
 I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4. Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями. Классификация химических реакций CuSO4 + 2KOH = Cu(OH)2 + K2SO4 NaOH + HNO3 = NaNO3 + H2O 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4. Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями. Классификация химических реакций CuSO4 + 2KOH = Cu(OH)2 + K2SO4 NaOH + HNO3 = NaNO3 + H2O 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
Cлайд 13
 II. По изменению степеней окисления химических элементов: 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней окисления элементов (все реакции замещения, а также реакции соединения и разложения, в которых участвует хотя бы одно простое вещество). Классификация химических реакций CuSO4 + Fe = FeSO4 + Cu↓ Zn + 2HCl = ZnCl2 + H2↑ Mg + H2SO4 = MgSO4 + H2↑
II. По изменению степеней окисления химических элементов: 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней окисления элементов (все реакции замещения, а также реакции соединения и разложения, в которых участвует хотя бы одно простое вещество). Классификация химических реакций CuSO4 + Fe = FeSO4 + Cu↓ Zn + 2HCl = ZnCl2 + H2↑ Mg + H2SO4 = MgSO4 + H2↑
Cлайд 15
 III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций 2HgO = 2Hg + O2↑ t
III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций 2HgO = 2Hg + O2↑ t
Cлайд 16
 III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с участием катализатора: Классификация химических реакций 2H2O2 = 2H2O + O2↑ MnO2
III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с участием катализатора: Классификация химических реакций 2H2O2 = 2H2O + O2↑ MnO2
Cлайд 18
 IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических реакций Ba(ClO2)2 + H2SO4 = 2HClO2 + BaSO4↓ 2. Обратимые реакции в данных условиях протекают одновременно в двух направлениях: 3H2 + N2 2NH3 N2O4 2NO2
IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических реакций Ba(ClO2)2 + H2SO4 = 2HClO2 + BaSO4↓ 2. Обратимые реакции в данных условиях протекают одновременно в двух направлениях: 3H2 + N2 2NH3 N2O4 2NO2
Cлайд 19
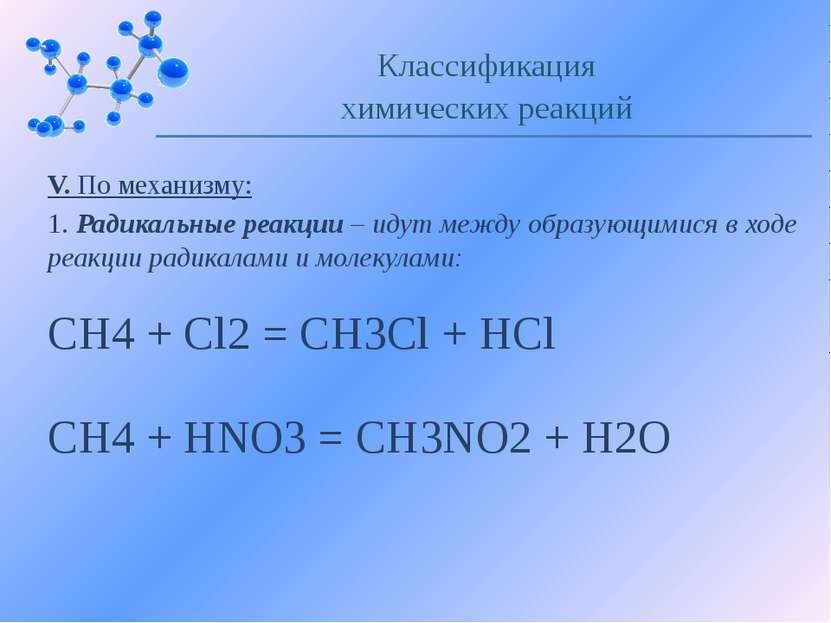
 V. По механизму: 1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами: Классификация химических реакций CH4 + Cl2 = CH3Cl + HCl CH4 + HNO3 = CH3NO2 + H2O
V. По механизму: 1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами: Классификация химических реакций CH4 + Cl2 = CH3Cl + HCl CH4 + HNO3 = CH3NO2 + H2O
Cлайд 20
 V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции ионами: Классификация химических реакций C2H4 + HBr = C2H5Br
V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции ионами: Классификация химических реакций C2H4 + HBr = C2H5Br
Cлайд 21
 VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: Классификация химических реакций 4P + 5O2 = 2P2O5 + Q кДж
VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: Классификация химических реакций 4P + 5O2 = 2P2O5 + Q кДж
Cлайд 23
 VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: Классификация химических реакций N2 + O2 = 2NO – Q кДж 2HgO = 2Hg↓ + O2↑ - Q кДж
VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: Классификация химических реакций N2 + O2 = 2NO – Q кДж 2HgO = 2Hg↓ + O2↑ - Q кДж
Cлайд 25
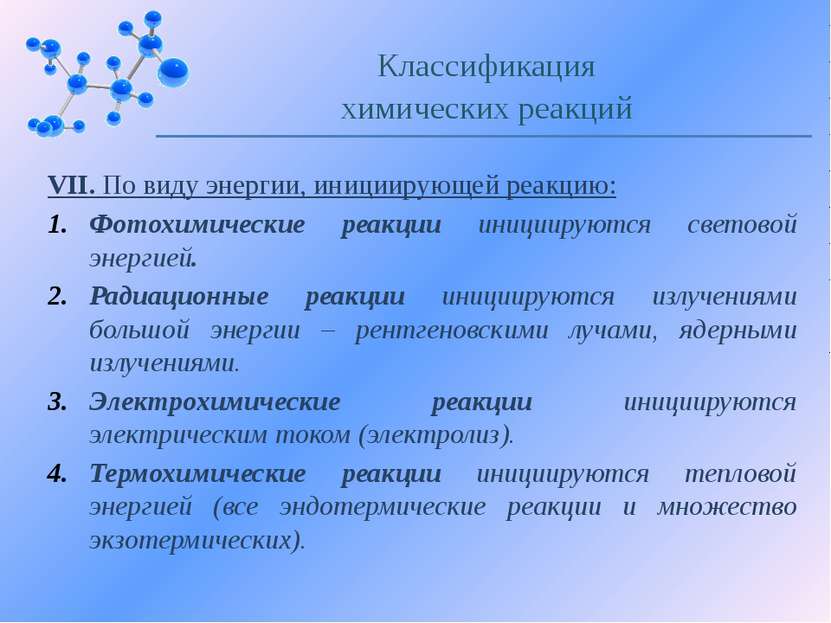
 VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией. Радиационные реакции инициируются излучениями большой энергии – рентгеновскими лучами, ядерными излучениями. Электрохимические реакции инициируются электрическим током (электролиз). Термохимические реакции инициируются тепловой энергией (все эндотермические реакции и множество экзотермических). Классификация химических реакций
VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией. Радиационные реакции инициируются излучениями большой энергии – рентгеновскими лучами, ядерными излучениями. Электрохимические реакции инициируются электрическим током (электролиз). Термохимические реакции инициируются тепловой энергией (все эндотермические реакции и множество экзотермических). Классификация химических реакций