X
Код презентации скопируйте его
Обобщение по типам химических реакций
Скачать эту презентациюПрезентация на тему Обобщение по типам химических реакций
Скачать эту презентациюCлайд 2
 превращение одних веществ в другие. Вещества, полученные в результате реакции, отличаются от исходных веществ составом, строением и свойствами. Химическая реакция – Реагент 1 + Реагент 2 = Продукты
превращение одних веществ в другие. Вещества, полученные в результате реакции, отличаются от исходных веществ составом, строением и свойствами. Химическая реакция – Реагент 1 + Реагент 2 = Продукты
Cлайд 3
 Признаки химических реакций Появление запаха Выделение газа Изменение окраски Выпадение осадка Растворение осадка Образование воды Выделение теплоты Поглощение теплоты
Признаки химических реакций Появление запаха Выделение газа Изменение окраски Выпадение осадка Растворение осадка Образование воды Выделение теплоты Поглощение теплоты
Cлайд 4
 Классификация по тепловому эффекту Эндотермические – с поглощением тепла + Q Экзотермические – с выделением тепла - Q
Классификация по тепловому эффекту Эндотермические – с поглощением тепла + Q Экзотермические – с выделением тепла - Q
Cлайд 5
 Классификация по числу и составу исходных и образующихся веществ Реакции соединения: А + В = АВ Реакции разложения: АВ = А + В Реакции замещения: АВ + С = А + СВ Реакции обмена: АВ + CD = AD + CB
Классификация по числу и составу исходных и образующихся веществ Реакции соединения: А + В = АВ Реакции разложения: АВ = А + В Реакции замещения: АВ + С = А + СВ Реакции обмена: АВ + CD = AD + CB
Cлайд 6
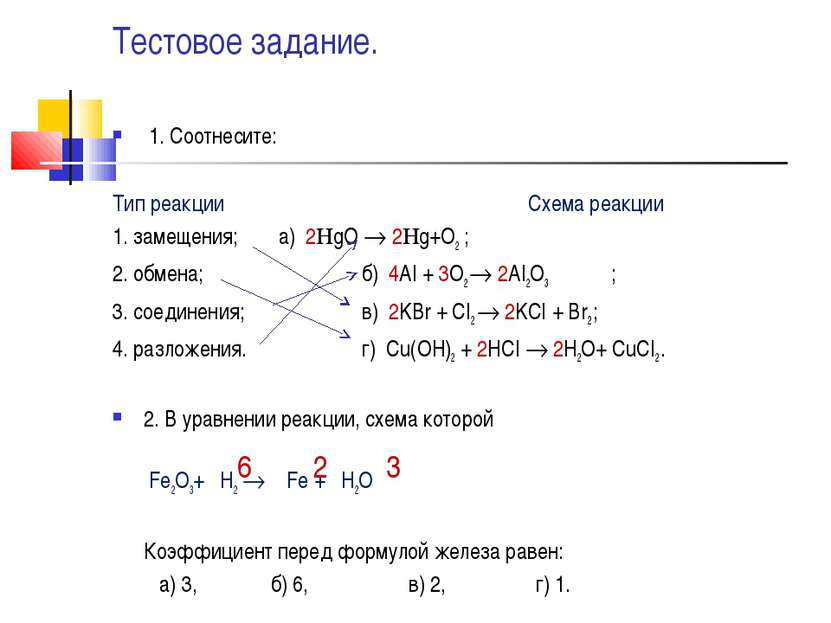
 Тестовое задание. 1. Соотнесите: Тип реакции Схема реакции 1. замещения; а) 2 gO 2 g+O2 ; 2. обмена; б) 4AI + 3O2 2AI2O3 ; 3. соединения; в) 2KBr + CI2 2KCI + Br2 ; 4. разложения. г) Сu(OH)2 + 2HCI 2H2O+ CuCI2 . 2. В уравнении реакции, схема которой Fe2O3+ H2 Fe + H2O Коэффициент перед формулой железа равен: а) 3, б) 6, в) 2, г) 1. 2 3 6
Тестовое задание. 1. Соотнесите: Тип реакции Схема реакции 1. замещения; а) 2 gO 2 g+O2 ; 2. обмена; б) 4AI + 3O2 2AI2O3 ; 3. соединения; в) 2KBr + CI2 2KCI + Br2 ; 4. разложения. г) Сu(OH)2 + 2HCI 2H2O+ CuCI2 . 2. В уравнении реакции, схема которой Fe2O3+ H2 Fe + H2O Коэффициент перед формулой железа равен: а) 3, б) 6, в) 2, г) 1. 2 3 6
Cлайд 7
 3. Реакции, в результате которых из одного сложного вещества образуется несколько более простого состава относятся к: а) реакциям соединения; б) реакциям разложения; в) реакциям замещения; г) реакциям обмена. 4. Веществом «А» в схеме уравнения реакции является: Mg + HCI MgCI2 + А а) H2 б) CI2 в)Mg г) O2 2
3. Реакции, в результате которых из одного сложного вещества образуется несколько более простого состава относятся к: а) реакциям соединения; б) реакциям разложения; в) реакциям замещения; г) реакциям обмена. 4. Веществом «А» в схеме уравнения реакции является: Mg + HCI MgCI2 + А а) H2 б) CI2 в)Mg г) O2 2
Cлайд 8
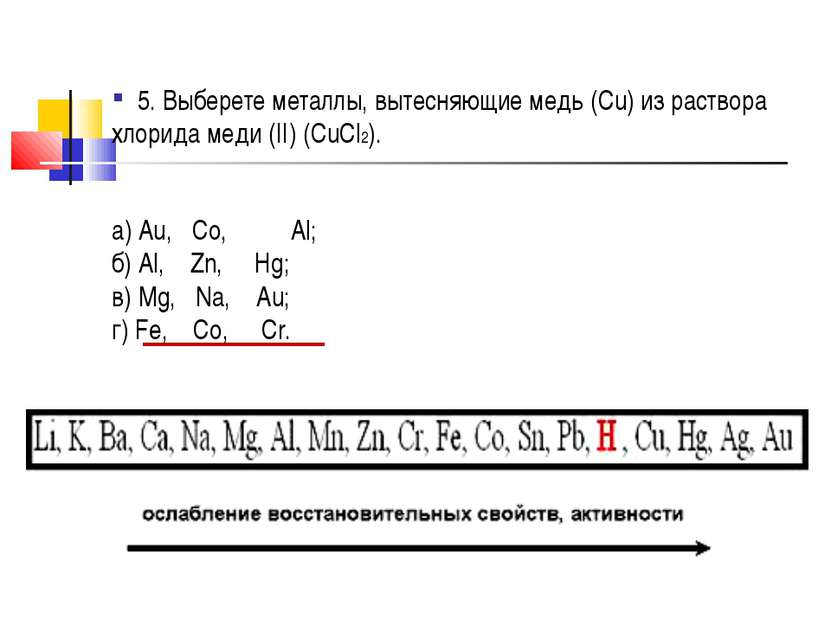
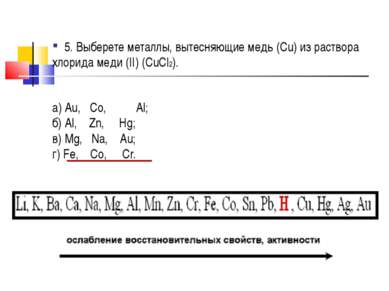 5. Выберете металлы, вытесняющие медь (Cu) из раствора хлорида меди (II) (CuCl2). а) Au, Co, Al; б) Al, Zn, Hg; в) Mg, Na, Au; г) Fe, Co, Cr.
5. Выберете металлы, вытесняющие медь (Cu) из раствора хлорида меди (II) (CuCl2). а) Au, Co, Al; б) Al, Zn, Hg; в) Mg, Na, Au; г) Fe, Co, Cr.
Cлайд 9
 6. По данным схемам реакций, запишите уравнения реакций. 1. Гидроксид меди (II) = оксид меди (II) + вода 2. Соляная кислота + цинк = хлорид цинка + водород 3. Хлорид бария + сульфат натрия = … 4. Оксид фосфора (V) + вода = …
6. По данным схемам реакций, запишите уравнения реакций. 1. Гидроксид меди (II) = оксид меди (II) + вода 2. Соляная кислота + цинк = хлорид цинка + водород 3. Хлорид бария + сульфат натрия = … 4. Оксид фосфора (V) + вода = …