X
Код презентации скопируйте его
Классификация неорганических веществ
Скачать эту презентациюПрезентация на тему Классификация неорганических веществ
Скачать эту презентациюCлайд 2
 Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ. Неорганические вещества Простые Металлы Неметаллы Сложные Оксиды Основания Кислоты Соли
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ. Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ. Неорганические вещества Простые Металлы Неметаллы Сложные Оксиды Основания Кислоты Соли
Cлайд 5
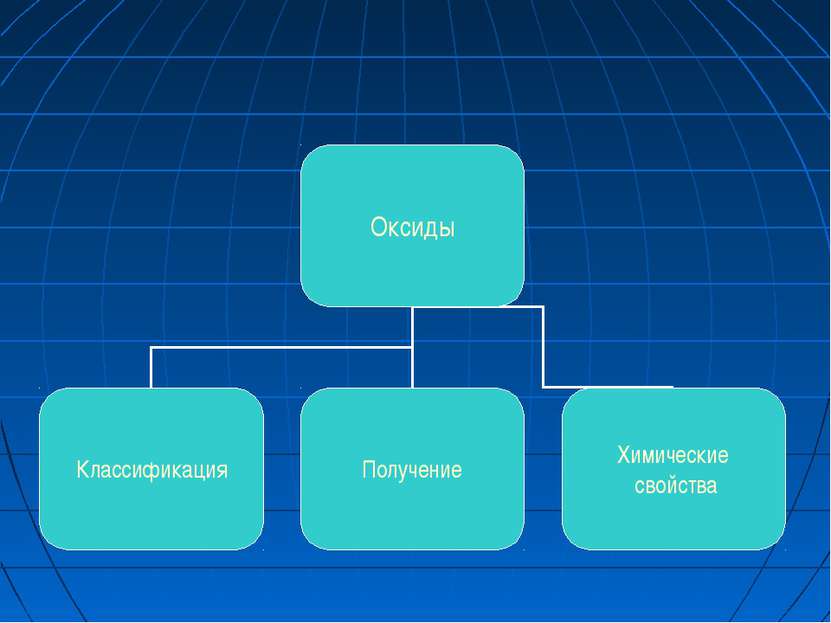
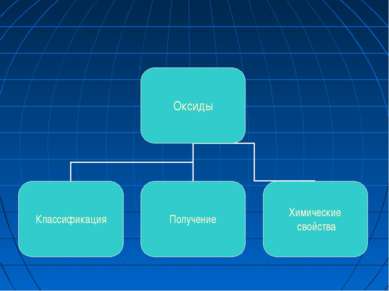
 ОКСИДЫ Классификация Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. ОКСИДЫ Несолеобразующие CO, N2O, NO Солеобразующие Основные -это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2 Na2O; MgO; CuO Амфотерные (обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды ZnO; Al2O3; Cr2O3; SnO2 Кислотные -это оксиды неметаллов и металлов со степенью окисления от +5 до +7 SO2; SO3; P2O5; Mn2O7; CrO3 Основным оксидам соответствуют основания, кислотным – кислоты, амфотерным – и те и другие
ОКСИДЫ Классификация Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. ОКСИДЫ Несолеобразующие CO, N2O, NO Солеобразующие Основные -это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2 Na2O; MgO; CuO Амфотерные (обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды ZnO; Al2O3; Cr2O3; SnO2 Кислотные -это оксиды неметаллов и металлов со степенью окисления от +5 до +7 SO2; SO3; P2O5; Mn2O7; CrO3 Основным оксидам соответствуют основания, кислотным – кислоты, амфотерным – и те и другие
Cлайд 6
 Получение 1. Взаимодействие простых и сложных веществ с кислородом: 2Mg + O2 = 2MgO 4P + 5O2 =2P2O5 S + O2 = SO2 2CO + O2 =2CO2 2CuS + 3O2= 2CuO + 2SO2 CH4 + 2O2 = CO2 + 2H2O 4NH3 + 5O2 = 4NO + 6H2O 2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании: Cu(OH)2 = CuO + H2O (CuOH)2CO3 = 2CuO + CO2 + H2O 2Pb(NO3)2 = 2PbO + 4NO2 + O2 2HMnO4 = Mn2O7 + H2O
Получение 1. Взаимодействие простых и сложных веществ с кислородом: 2Mg + O2 = 2MgO 4P + 5O2 =2P2O5 S + O2 = SO2 2CO + O2 =2CO2 2CuS + 3O2= 2CuO + 2SO2 CH4 + 2O2 = CO2 + 2H2O 4NH3 + 5O2 = 4NO + 6H2O 2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании: Cu(OH)2 = CuO + H2O (CuOH)2CO3 = 2CuO + CO2 + H2O 2Pb(NO3)2 = 2PbO + 4NO2 + O2 2HMnO4 = Mn2O7 + H2O
Cлайд 7
 Химические свойства Основные оксиды 1. Взаимодействие с водой Образуется основание:Na2O + H2O =2NaOH CaO + H2O = Ca(OH)2 2. Взаимодействие с кислотой или основанием: При реакции с кислотой образуется соль и вода MgO + H2SO4 = MgSO4 + H2O CuO + 2HCl = CuCl2 + H2O
Химические свойства Основные оксиды 1. Взаимодействие с водой Образуется основание:Na2O + H2O =2NaOH CaO + H2O = Ca(OH)2 2. Взаимодействие с кислотой или основанием: При реакции с кислотой образуется соль и вода MgO + H2SO4 = MgSO4 + H2O CuO + 2HCl = CuCl2 + H2O
Cлайд 8
 Кислотные оксиды 1. Взаимодействие с водой Образуется кислота: SO3 + H2O =H2SO4 P2O5 + 3H2O =2H3PO4 2. Взаимодействие с кислотой или основанием: При реакции с основанием образуется соль и вода CO2 + Ba(OH)2 = BaCO3 + H2O SO2 + 2NaOH = Na2SO3 + H2O
Кислотные оксиды 1. Взаимодействие с водой Образуется кислота: SO3 + H2O =H2SO4 P2O5 + 3H2O =2H3PO4 2. Взаимодействие с кислотой или основанием: При реакции с основанием образуется соль и вода CO2 + Ba(OH)2 = BaCO3 + H2O SO2 + 2NaOH = Na2SO3 + H2O
Cлайд 9
 Амфотерные оксиды Амфотерные оксиды взаимодействуют с кислотами как основные: ZnO + H2SO4 =ZnSO4 + H2O с основаниями как кислотные: ZnO + 2NaOH = Na2ZnO2 + H2O(ZnO + 2NaOH + H2O =Na2[Zn(OH)4]) 3. Взаимодействие основных и кислотных оксидов между собой приводит к солям.Na2O + CO2 ® Na2CO34. Восстановление до простых веществ:3CuO + 2NH3 = 3Cu + N2 + 3H2O P2O5 + 5C = 2P + 5CO
Амфотерные оксиды Амфотерные оксиды взаимодействуют с кислотами как основные: ZnO + H2SO4 =ZnSO4 + H2O с основаниями как кислотные: ZnO + 2NaOH = Na2ZnO2 + H2O(ZnO + 2NaOH + H2O =Na2[Zn(OH)4]) 3. Взаимодействие основных и кислотных оксидов между собой приводит к солям.Na2O + CO2 ® Na2CO34. Восстановление до простых веществ:3CuO + 2NH3 = 3Cu + N2 + 3H2O P2O5 + 5C = 2P + 5CO
Cлайд 11
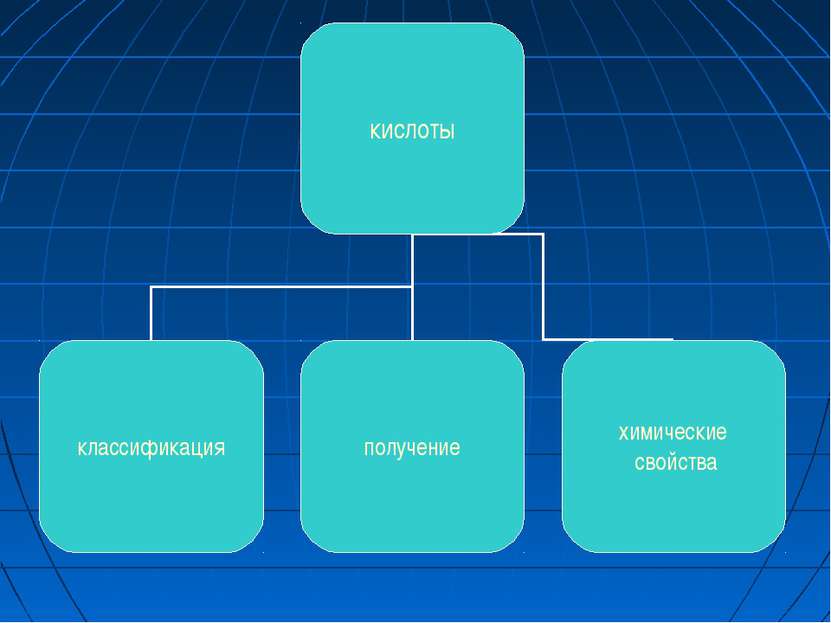
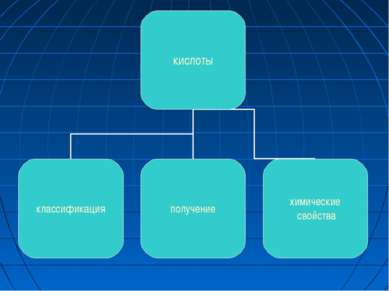
 КИСЛОТЫ Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
КИСЛОТЫ Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Cлайд 13
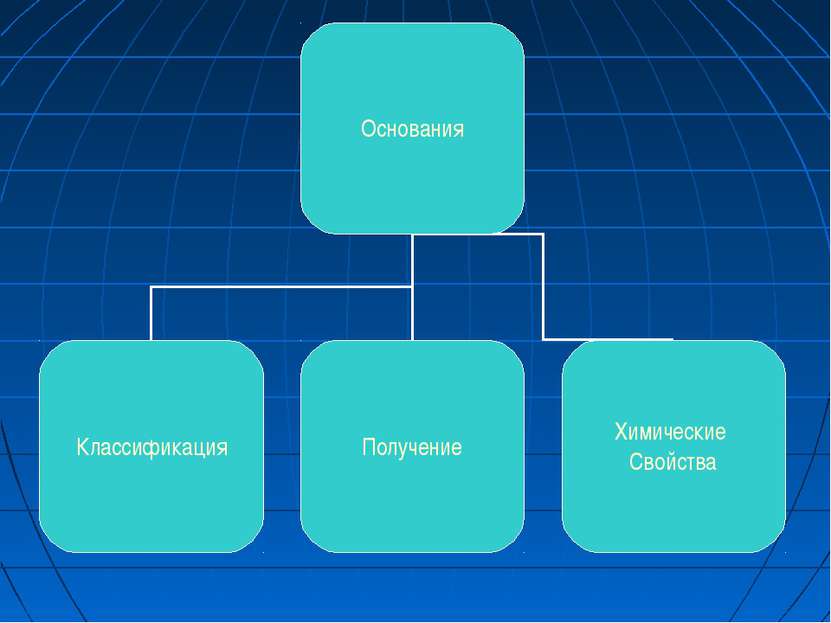
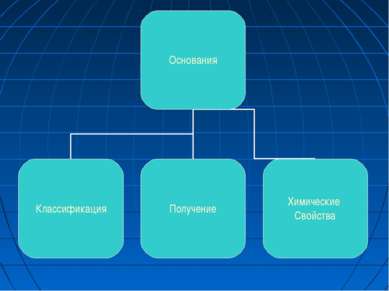
 ОСНОВАНИЯ Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
ОСНОВАНИЯ Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Cлайд 14
 Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.