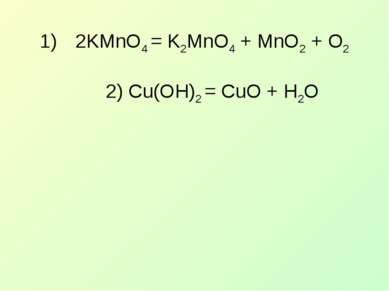X
Код презентации скопируйте его
Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»
Скачать эту презентациюПрезентация на тему Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»
Скачать эту презентациюCлайд 3
 Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит» Задачи урока: Познакомиться с понятиями: ОВР, окисление, восстановление, окислитель, восстановитель. Научиться по уравнениям реакций распознавать ОВР, определять окислитель, восстановитель
Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит» Задачи урока: Познакомиться с понятиями: ОВР, окисление, восстановление, окислитель, восстановитель. Научиться по уравнениям реакций распознавать ОВР, определять окислитель, восстановитель
Cлайд 4
 Входной контроль 1 вариант 1 - Г 2 - А 3 – Г 4 – А 5) А- 1 Б- 3 В- 3 Г- 4 2 вариант 1 – В 2 – В 3 – Г 4 – А 5) А- 2 Б- 3 В- 1 Г- 4
Входной контроль 1 вариант 1 - Г 2 - А 3 – Г 4 – А 5) А- 1 Б- 3 В- 3 Г- 4 2 вариант 1 – В 2 – В 3 – Г 4 – А 5) А- 2 Б- 3 В- 1 Г- 4
Cлайд 5
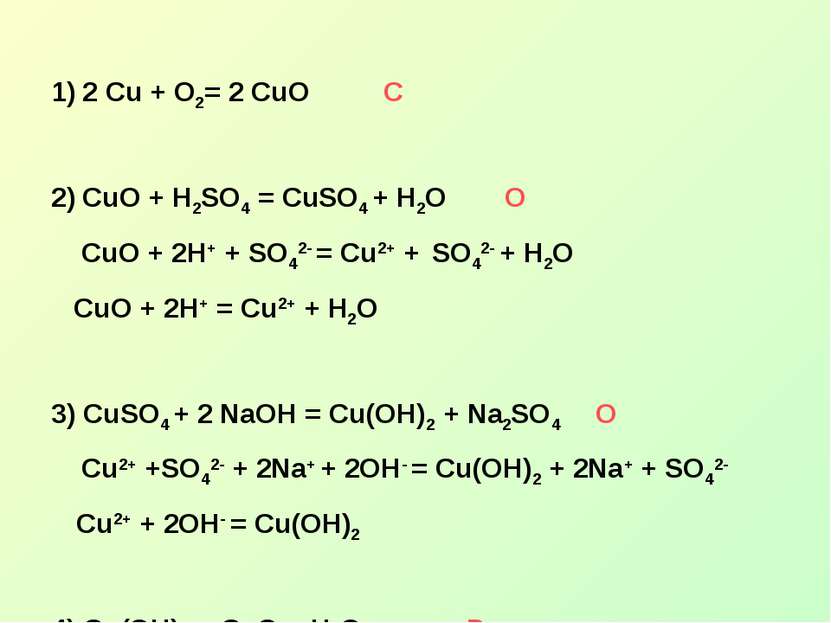
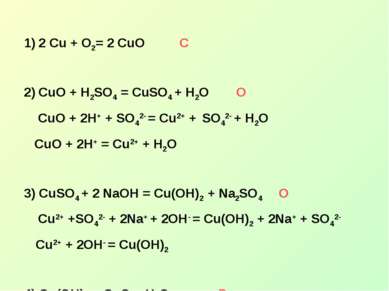
 Лабораторная работа А) Проведите химические реакции Взаимодействия железа с сульфатом меди Взаимодействия растворов сульфата меди и раствором щелочи. Б) Запишите уравнения реакций в молекулярном и ионном виде. Укажите тип реакции В) Укажите различия данных реакций.
Лабораторная работа А) Проведите химические реакции Взаимодействия железа с сульфатом меди Взаимодействия растворов сульфата меди и раствором щелочи. Б) Запишите уравнения реакций в молекулярном и ионном виде. Укажите тип реакции В) Укажите различия данных реакций.
Cлайд 6
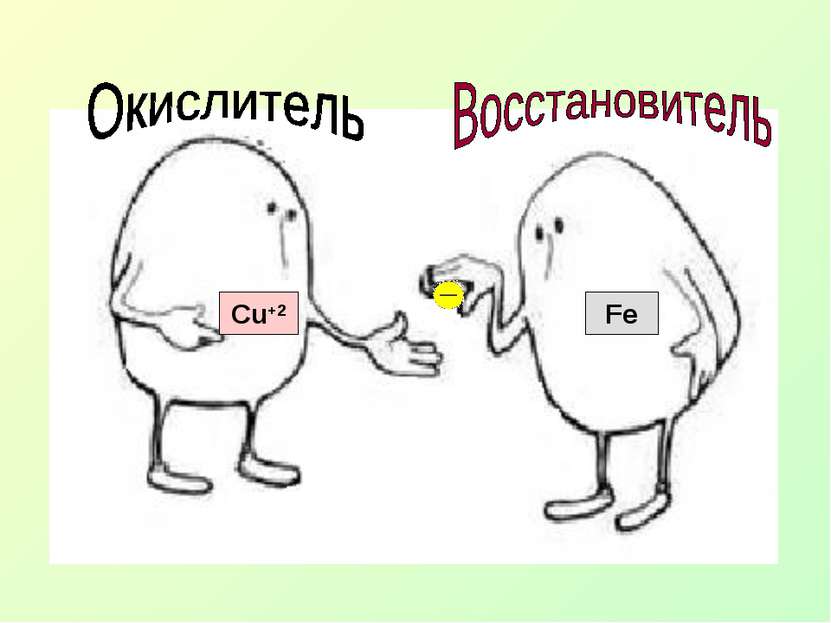
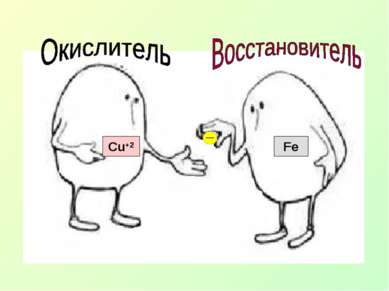
 Fe0+Cu+2 SO4 = Fe SO4 + Сu +2 0 Суть ОВР – переход электронов от одних атомов, молекул или ионов к другим.
Fe0+Cu+2 SO4 = Fe SO4 + Сu +2 0 Суть ОВР – переход электронов от одних атомов, молекул или ионов к другим.
Cлайд 7
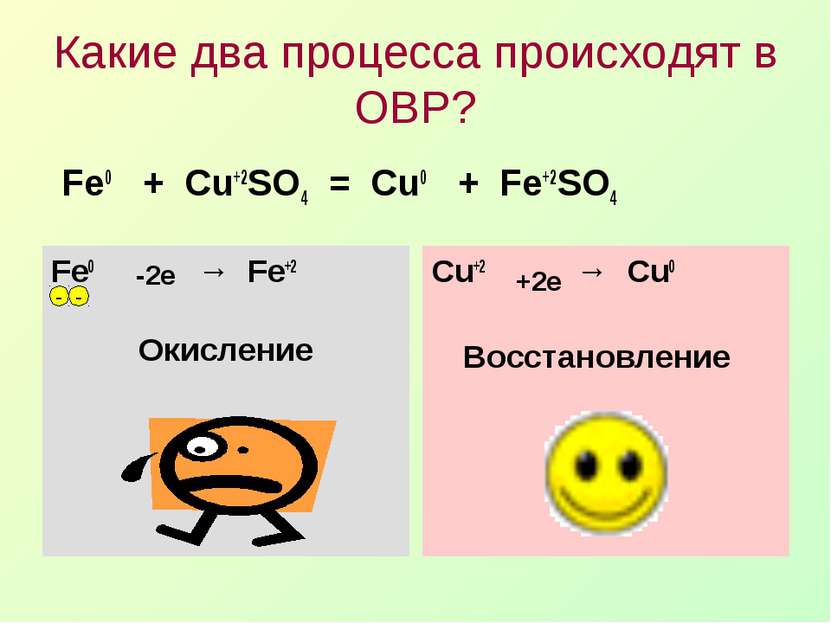
 Какие два процесса происходят в ОВР? Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4 Fe0 → Fe+2 - - -2е Окисление Cu+2 → Cu0 - - +2е Восстановление
Какие два процесса происходят в ОВР? Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4 Fe0 → Fe+2 - - -2е Окисление Cu+2 → Cu0 - - +2е Восстановление
Cлайд 10
 Уэ-1 Значение ОВР ОВР обеспечивают жизненно важные процессы организмов. Используются для получения различных веществ; для теплообеспечения
Уэ-1 Значение ОВР ОВР обеспечивают жизненно важные процессы организмов. Используются для получения различных веществ; для теплообеспечения
Cлайд 11
 УЭ-2 Распознавание ОВР по химическим уравнениям Окислительно-восстановительную реакцию можно определить по изменению степени окисления у отдельных элементов, по наличию простого вещества и по типу химической реакции. 1, 4 1вариант: Б,Г 2 вариант: А,В
УЭ-2 Распознавание ОВР по химическим уравнениям Окислительно-восстановительную реакцию можно определить по изменению степени окисления у отдельных элементов, по наличию простого вещества и по типу химической реакции. 1, 4 1вариант: Б,Г 2 вариант: А,В
Cлайд 12
 УЭ-3 Процессы окисления и восстановления. 1. А) окисление (ок-ие),восстановитель (в-ль) Б) восстановление (в-ие), окислитель (ок-ль) В) окисление (ок-ие),восстановитель (в-ль) Г) восстановление (в-ие), окислитель (ок-ль) 2. 1) увеличивается 3) уменьшается 2) уменьшается 4) увеличивается 3. 1) Fe – 3е = Fe3+ - ок-ие, в-ль 2) C+4 + 2е =C+2 - в-ие, ок-ль 3) S+6 + 8е = S-2 - в-ие, ок-ль 4) P-3 – 3 =P0 - ок-ие, в-ль
УЭ-3 Процессы окисления и восстановления. 1. А) окисление (ок-ие),восстановитель (в-ль) Б) восстановление (в-ие), окислитель (ок-ль) В) окисление (ок-ие),восстановитель (в-ль) Г) восстановление (в-ие), окислитель (ок-ль) 2. 1) увеличивается 3) уменьшается 2) уменьшается 4) увеличивается 3. 1) Fe – 3е = Fe3+ - ок-ие, в-ль 2) C+4 + 2е =C+2 - в-ие, ок-ль 3) S+6 + 8е = S-2 - в-ие, ок-ль 4) P-3 – 3 =P0 - ок-ие, в-ль
Cлайд 13
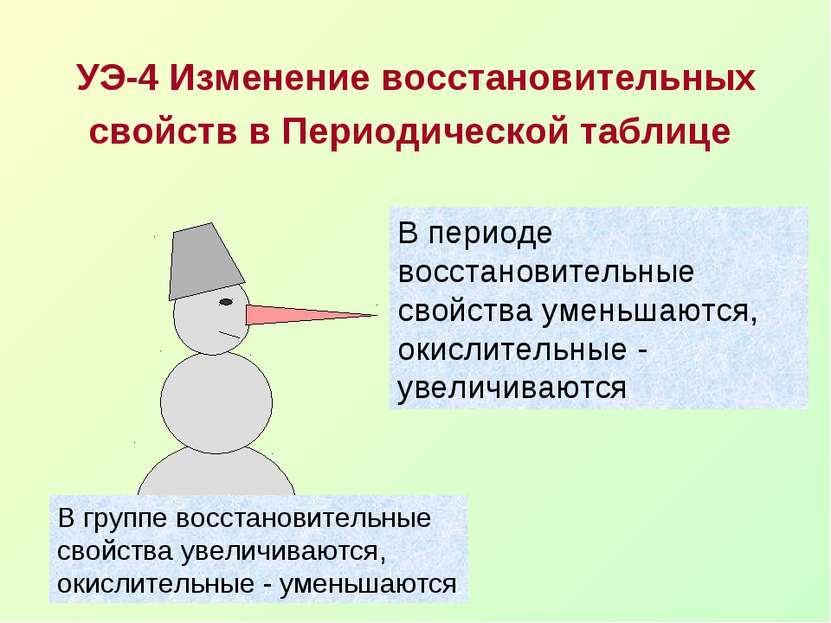
 УЭ-4 Изменение восстановительных свойств в Периодической таблице В периоде восстановительные свойства уменьшаются, окислительные - увеличиваются В группе восстановительные свойства увеличиваются, окислительные - уменьшаются
УЭ-4 Изменение восстановительных свойств в Периодической таблице В периоде восстановительные свойства уменьшаются, окислительные - увеличиваются В группе восстановительные свойства увеличиваются, окислительные - уменьшаются
Cлайд 14
 УЭ-4 Изменение восстановительных свойств в Периодической таблице 2. а) Li, Na, K б) S, Si, Na 3) а) С, O, F б) Br, Cl, F
УЭ-4 Изменение восстановительных свойств в Периодической таблице 2. а) Li, Na, K б) S, Si, Na 3) а) С, O, F б) Br, Cl, F
Cлайд 16
 1 Вариант С0 + О20 = С+4О2-2 C0 - 4e = C+4 - ок-ие, в-ль O0 + 2e = O-2 - в-ие, ок-ль 2Fe2+3O3+3C0 =4Fe0 +3C+4O2 C0 - 4e = C+4- ок-ие, в-ль Fe+3 +3e = Fe0-в-ие, ок-ль 2 Вариант C-4H4+ = C0 + 2H20 C-4 – 4e = C0 - ок-ие, в-ль H+ + 1e = H0 - в-ие, ок-ль Fe2+3O3 + 2Al0 = Al2+3O3 + 2Fe0 Al0 -3e =Al+3 - ок-ие, в-ль Fe+3 + 3e = Fe0 - в-ие, ок-ль
1 Вариант С0 + О20 = С+4О2-2 C0 - 4e = C+4 - ок-ие, в-ль O0 + 2e = O-2 - в-ие, ок-ль 2Fe2+3O3+3C0 =4Fe0 +3C+4O2 C0 - 4e = C+4- ок-ие, в-ль Fe+3 +3e = Fe0-в-ие, ок-ль 2 Вариант C-4H4+ = C0 + 2H20 C-4 – 4e = C0 - ок-ие, в-ль H+ + 1e = H0 - в-ие, ок-ль Fe2+3O3 + 2Al0 = Al2+3O3 + 2Fe0 Al0 -3e =Al+3 - ок-ие, в-ль Fe+3 + 3e = Fe0 - в-ие, ок-ль
Cлайд 17
 Домашнее задание Стр. 229-231, выучить определения. Стр.235. упр 1( «3») упр 1,3 («4») упр 1, 3, 5 ( «5»)
Домашнее задание Стр. 229-231, выучить определения. Стр.235. упр 1( «3») упр 1,3 («4») упр 1, 3, 5 ( «5»)
Cлайд 18
 Закончите схемы процессов, укажите окислитель и восстановитель: Na …… = Na+ S-2 …… = S0 S-2 …… = S+6 Al+3 ….. = Al P+5 ….. = P0 P+5 ….. = P-3 - 1е - 2е - 8е +3е +5е +8е При восстановлении степень окисления уменьшается, при окислении - возрастает
Закончите схемы процессов, укажите окислитель и восстановитель: Na …… = Na+ S-2 …… = S0 S-2 …… = S+6 Al+3 ….. = Al P+5 ….. = P0 P+5 ….. = P-3 - 1е - 2е - 8е +3е +5е +8е При восстановлении степень окисления уменьшается, при окислении - возрастает