X
Код презентации скопируйте его
Кислоты органические и неорганические
Скачать эту презентациюПрезентация на тему Кислоты органические и неорганические
Скачать эту презентациюCлайд 2
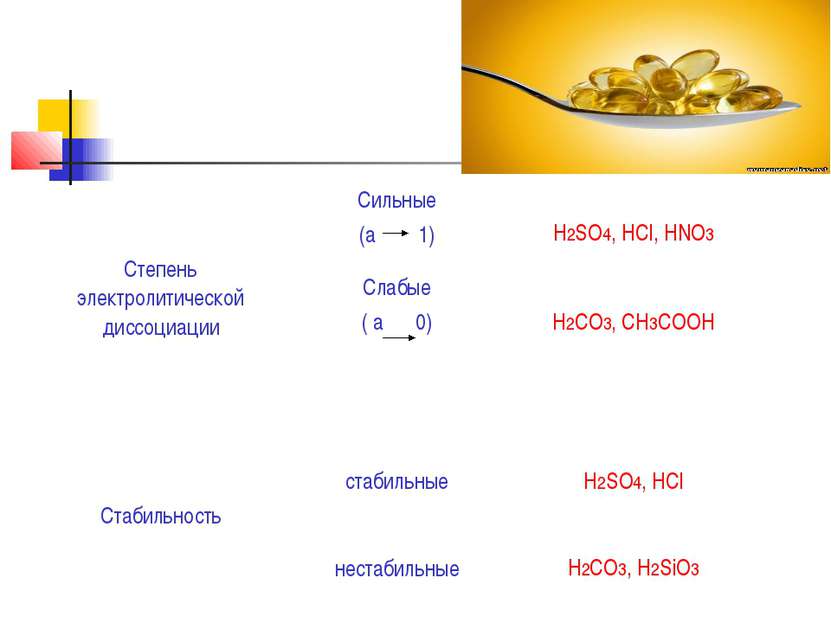
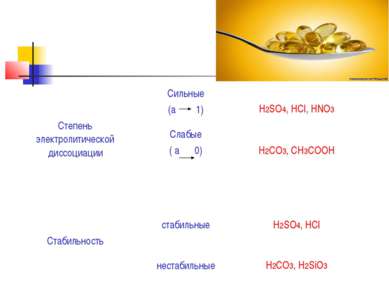
 Кисло ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
Кисло ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков. Они получили своё название из-за кислого вкуса большинства кислот. В водных растворах они диссоциируют на катион водорода (протон) и анион кислотного остатка.
Cлайд 3
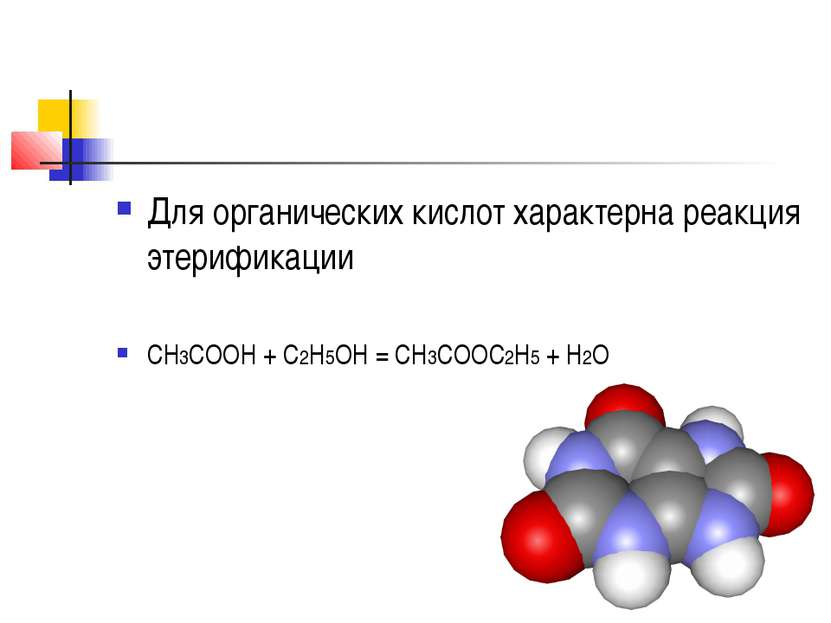
 По определению Льюиса, кислота — это электролит(вещество, участвующее в реакциях с переходом электрона), принимающий электронную пару в реакции с основанием, то есть веществом, отдающим электронную пару. В теории Бренстеда-Лоури, кислота — вещество, отдающее протон (основание — вещество, принимающее протон).
По определению Льюиса, кислота — это электролит(вещество, участвующее в реакциях с переходом электрона), принимающий электронную пару в реакции с основанием, то есть веществом, отдающим электронную пару. В теории Бренстеда-Лоури, кислота — вещество, отдающее протон (основание — вещество, принимающее протон).
Cлайд 4
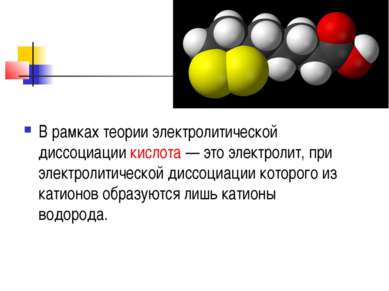 В рамках теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации которого из катионов образуются лишь катионы водорода.
В рамках теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации которого из катионов образуются лишь катионы водорода.
Cлайд 8
 Химические свойства. Взаимодействие с оксидами металлов с образованием соли и воды : CaO + 2HCl = CaCl2 + H2O Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации): NaOH + HCl = NaCl + H2O
Химические свойства. Взаимодействие с оксидами металлов с образованием соли и воды : CaO + 2HCl = CaCl2 + H2O Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации): NaOH + HCl = NaCl + H2O
Cлайд 9
 Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима: Cu(OH)2 + H2SO4 = CuSO4 + H2O
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима: Cu(OH)2 + H2SO4 = CuSO4 + H2O
Cлайд 10
 Взаимодействие с солями, если выпадает осадок или выделяется газ: BaCl2 + H2SO4 = BaSO4 + 2HCl Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты Mg + 2HCl = MgCl2 + H2
Взаимодействие с солями, если выпадает осадок или выделяется газ: BaCl2 + H2SO4 = BaSO4 + 2HCl Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты Mg + 2HCl = MgCl2 + H2