X
Код презентации скопируйте его
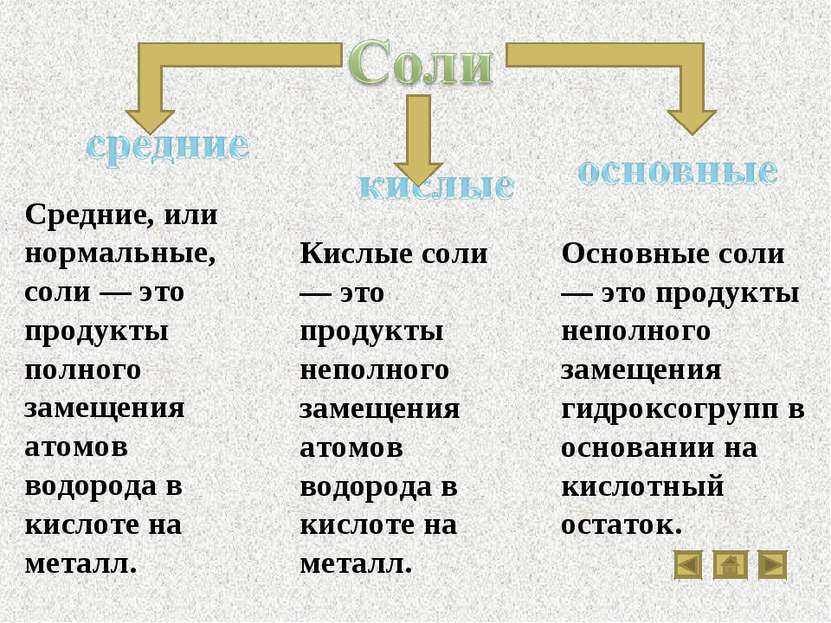
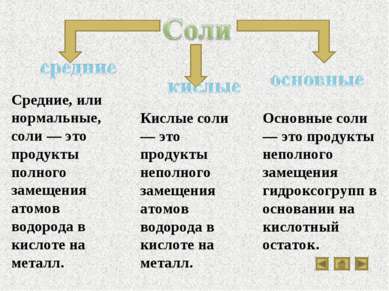
Свойства основных классов неорганических соединений
Скачать эту презентациюПрезентация на тему Свойства основных классов неорганических соединений
Скачать эту презентациюCлайд 1
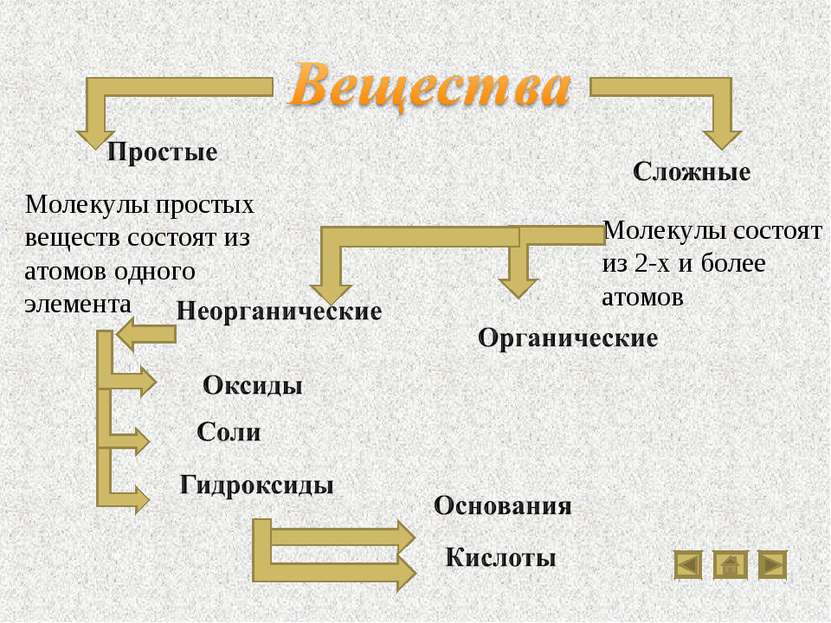
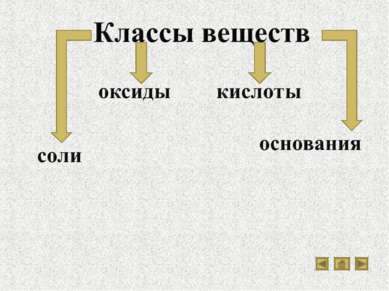
 Вещества Классы веществ Кислоты Классификация кислот Химические свойства кислот Основания Классификация оснований Свойства оснований Разложение нерастворимых оснований Соли Разнообразие солей Свойства солей Оксиды Солеобразующие оксиды Типичные реакции основных оксидов Типичные реакции кислотных оксидов
Вещества Классы веществ Кислоты Классификация кислот Химические свойства кислот Основания Классификация оснований Свойства оснований Разложение нерастворимых оснований Соли Разнообразие солей Свойства солей Оксиды Солеобразующие оксиды Типичные реакции основных оксидов Типичные реакции кислотных оксидов
Cлайд 2
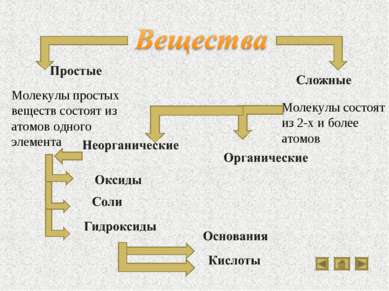 Молекулы простых веществ состоят из атомов одного элемента Молекулы состоят из 2-х и более атомов
Молекулы простых веществ состоят из атомов одного элемента Молекулы состоят из 2-х и более атомов
Cлайд 4
 это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления -2. - такие оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей. - такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления -2. - такие оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей. - такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Cлайд 5
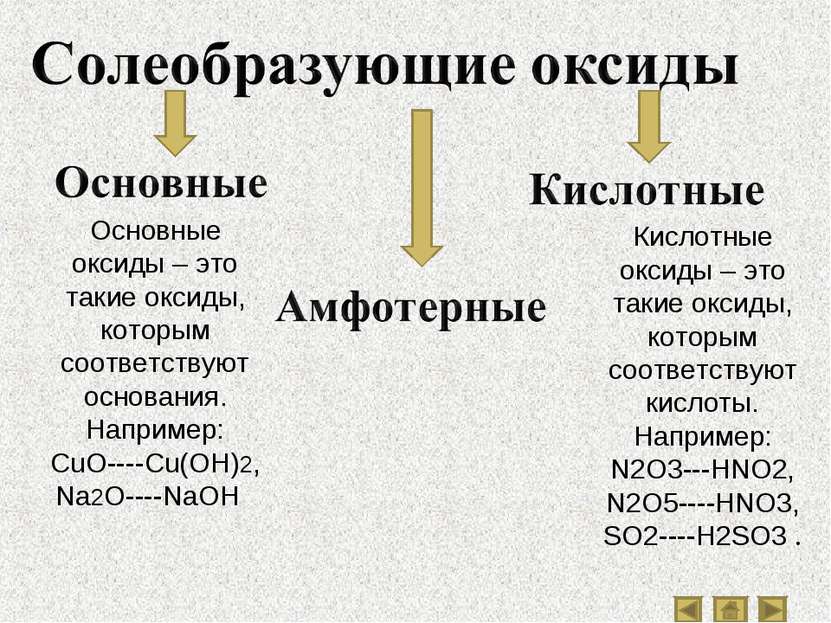
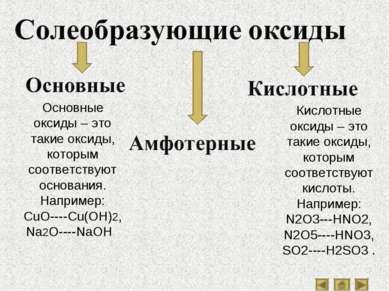 Основные оксиды – это такие оксиды, которым соответствуют основания. Например: CuO----Cu(OH)2, Na2O----NaOH . Кислотные оксиды – это такие оксиды, которым соответствуют кислоты. Например: N2O3---HNO2, N2O5----HNO3, SO2----H2SO3 .
Основные оксиды – это такие оксиды, которым соответствуют основания. Например: CuO----Cu(OH)2, Na2O----NaOH . Кислотные оксиды – это такие оксиды, которым соответствуют кислоты. Например: N2O3---HNO2, N2O5----HNO3, SO2----H2SO3 .
Cлайд 6
 Основный оксид + кислота соль + вода. (реакция обмена) CuO + 2HNO3 = Cu(NO3)2 + H2O Основный оксид + кислотный оксид соль. (реакция соединения) CaO + N2O5 = Ca(NO3)2 Основный оксид + вода щелочь. (реакция соединения) K2O + H2O = 2KOH Основные оксиды взаимодействуют:
Основный оксид + кислота соль + вода. (реакция обмена) CuO + 2HNO3 = Cu(NO3)2 + H2O Основный оксид + кислотный оксид соль. (реакция соединения) CaO + N2O5 = Ca(NO3)2 Основный оксид + вода щелочь. (реакция соединения) K2O + H2O = 2KOH Основные оксиды взаимодействуют:
Cлайд 7
 Кислотный оксид + основание соль + вода. (реакция обмена) SO2 + 2NaOH = Na2SO3 + H2O Кислотный оксид + основный оксид соль. (реакция соединения) K2O + SO3 = K2SO4 Кислотный оксид + вода кислота. (реакция соединения) SO3 + H2O = H2SO4 Кислотные оксиды взаимодействуют:
Кислотный оксид + основание соль + вода. (реакция обмена) SO2 + 2NaOH = Na2SO3 + H2O Кислотный оксид + основный оксид соль. (реакция соединения) K2O + SO3 = K2SO4 Кислотный оксид + вода кислота. (реакция соединения) SO3 + H2O = H2SO4 Кислотные оксиды взаимодействуют:
Cлайд 8
 Этот класс соединений широко распространен в природе. В желудке человека содержится сильная бескислородная одноосновная соляная кислота. В природе наблюдается многообразие органических кислот . Молочная кислота содержится в кисломолочных продуктах (а), образуется при квашении капусты (б)
Этот класс соединений широко распространен в природе. В желудке человека содержится сильная бескислородная одноосновная соляная кислота. В природе наблюдается многообразие органических кислот . Молочная кислота содержится в кисломолочных продуктах (а), образуется при квашении капусты (б)
Cлайд 10
 Кислота + основание соль + вода. (реакция обмена) HСl + NaOH = NaCl + H2O Кислота + оксид металла соль + вода. (реакция обмена) CuO + H2SO4 = CuSO4 + H2O Кислота + соль новая кислота + новая соль. (реакция обмена) H2SO4 + BaCl2 = BaSO4 + 2HCl
Кислота + основание соль + вода. (реакция обмена) HСl + NaOH = NaCl + H2O Кислота + оксид металла соль + вода. (реакция обмена) CuO + H2SO4 = CuSO4 + H2O Кислота + соль новая кислота + новая соль. (реакция обмена) H2SO4 + BaCl2 = BaSO4 + 2HCl
Cлайд 11
 Кислота + металл соль + водород. (реакция замещения) 1)Металл должен находиться в ряду стандартных электронных потенциалов до водорода. Например, Zn + 2НСl = ZnCl2 + Н2 2)Должна получиться растворимая соль. Pb + H2SO4 = PbSO4 + H2 3) Третья реакция характерна для растворов кислот, поэтому нерастворимые кислоты например кремниевая, не вступают в реакции с металлами. 4) Концентрированный раствор H2SO4, раствор НNO3 любой концентрации взаимодействуют с металлами иначе. Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O. Взаимодействие кон. НNO3 с медью сопровождается образованием бурого газа – оксида азота (IV)
Кислота + металл соль + водород. (реакция замещения) 1)Металл должен находиться в ряду стандартных электронных потенциалов до водорода. Например, Zn + 2НСl = ZnCl2 + Н2 2)Должна получиться растворимая соль. Pb + H2SO4 = PbSO4 + H2 3) Третья реакция характерна для растворов кислот, поэтому нерастворимые кислоты например кремниевая, не вступают в реакции с металлами. 4) Концентрированный раствор H2SO4, раствор НNO3 любой концентрации взаимодействуют с металлами иначе. Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O. Взаимодействие кон. НNO3 с медью сопровождается образованием бурого газа – оксида азота (IV)
Cлайд 12
 Основания – это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими гидросогруппами (ОН)
Основания – это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими гидросогруппами (ОН)
Cлайд 13
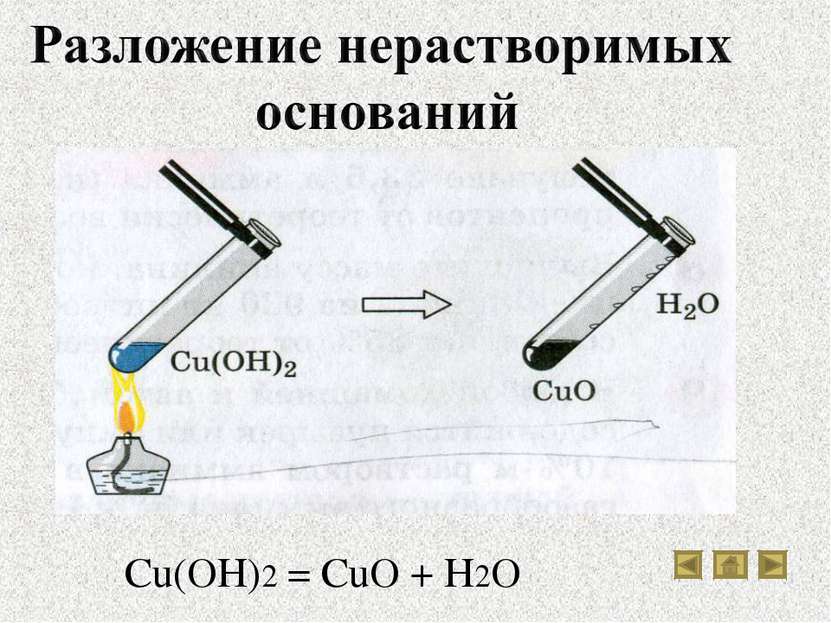
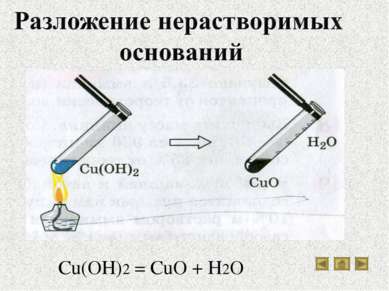
 Водные растворы щелочей, мылкие на ощупь, разъедают кожу, ткань, изменяют окраску индикаторов. Нерастворимые основания этими свойствами не обладают. Нерастворимые гидроксиды: а - гидроксид меди (II); б - гидроксид магния; в - гидроксид никеля (II); г - гидроксид железа (III); д - гидроксид кобальта (II)
Водные растворы щелочей, мылкие на ощупь, разъедают кожу, ткань, изменяют окраску индикаторов. Нерастворимые основания этими свойствами не обладают. Нерастворимые гидроксиды: а - гидроксид меди (II); б - гидроксид магния; в - гидроксид никеля (II); г - гидроксид железа (III); д - гидроксид кобальта (II)
Cлайд 14
 Основание + оксид неметалла соль + вода. ( реакция обмена) 2KOH + SO2 = K2SO3 + H2O Щелочь + соль новое основание + новая соль. (реакция обмена) 2KOH + CuSO4 = Cu(OH)2 + K2SO4
Основание + оксид неметалла соль + вода. ( реакция обмена) 2KOH + SO2 = K2SO3 + H2O Щелочь + соль новое основание + новая соль. (реакция обмена) 2KOH + CuSO4 = Cu(OH)2 + K2SO4
Cлайд 17
 Соли имеют самые различные цвета: а - медный купорос; б - дихромат калия; в - желтая кровяная соль; г - перманганат калия; д - хлорид натрия; е - нитрат никеля (II) Раковины состоят из карбоната кальция Малахит
Соли имеют самые различные цвета: а - медный купорос; б - дихромат калия; в - желтая кровяная соль; г - перманганат калия; д - хлорид натрия; е - нитрат никеля (II) Раковины состоят из карбоната кальция Малахит