X
Код презентации скопируйте его
Свойства газов
Скачать эту презентациюПрезентация на тему Свойства газов
Скачать эту презентациюCлайд 2
 Закономерности броуновского движения 1905 год - А.Эйнштейн на основе МКТ разработал теорию броуновского движения и доказал, что смещение частицы от начального положения пропорционально квадратному корню из времени. 1908 году Ж. Перрен полностью подтвердил этот теоретический результат своими наблюдениями.
Закономерности броуновского движения 1905 год - А.Эйнштейн на основе МКТ разработал теорию броуновского движения и доказал, что смещение частицы от начального положения пропорционально квадратному корню из времени. 1908 году Ж. Перрен полностью подтвердил этот теоретический результат своими наблюдениями.
Cлайд 3
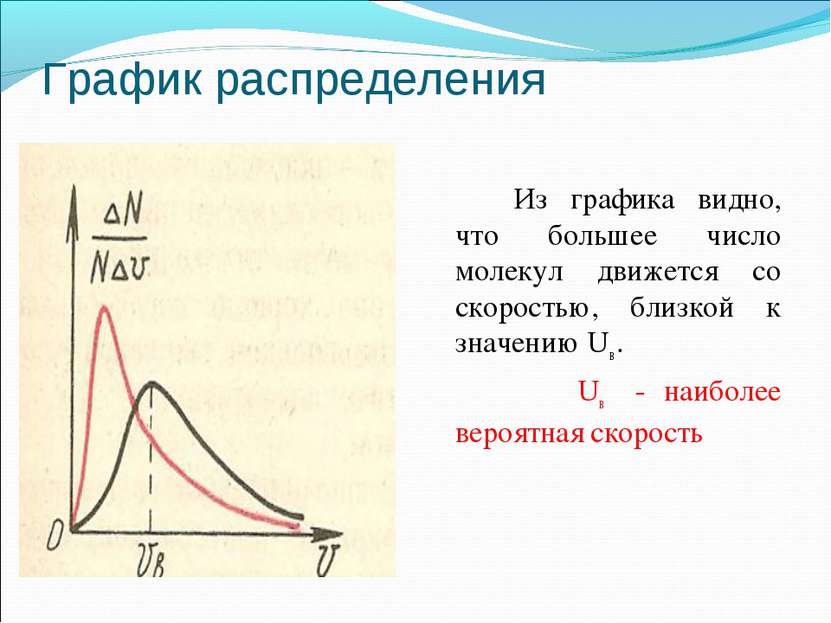
 Распределение молекул по скоростям В 1860 году Дж. Максвелл пришел к фундаментальному выводу: молекулы газа движутся с различными скоростями(ранее считалось, что они движутся с одинаковыми скоростями). Он также вывел закон распределения молекул газа по скоростям.
Распределение молекул по скоростям В 1860 году Дж. Максвелл пришел к фундаментальному выводу: молекулы газа движутся с различными скоростями(ранее считалось, что они движутся с одинаковыми скоростями). Он также вывел закон распределения молекул газа по скоростям.
Cлайд 4
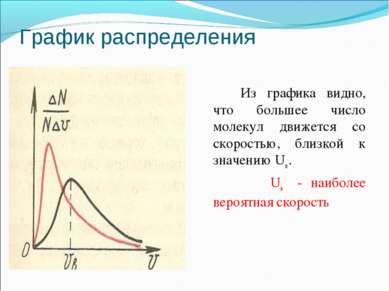 График распределения Из графика видно, что большее число молекул движется со скоростью, близкой к значению Uв . Uв - наиболее вероятная скорость
График распределения Из графика видно, что большее число молекул движется со скоростью, близкой к значению Uв . Uв - наиболее вероятная скорость
Cлайд 5
 Свойства газов Основу КТГ составляют положения: Газы способны неограниченно расширяться и занимать любой предоставленный им объем Смесь газов оказывает на стенки сосуда давление, равное сумме давлений каждого газа взятого в отдельности (закон Дальтона) При постоянной температуре давление данной массы газа обратно пропорционально его объему (закон Бойля-Мариотта) При постоянном объеме давление данной массы газа линейно зависит от температуры (закон Шарля) При постоянном давлении объем данной массы газа линейно зависит от температуры (закон Гей-Люссака)
Свойства газов Основу КТГ составляют положения: Газы способны неограниченно расширяться и занимать любой предоставленный им объем Смесь газов оказывает на стенки сосуда давление, равное сумме давлений каждого газа взятого в отдельности (закон Дальтона) При постоянной температуре давление данной массы газа обратно пропорционально его объему (закон Бойля-Мариотта) При постоянном объеме давление данной массы газа линейно зависит от температуры (закон Шарля) При постоянном давлении объем данной массы газа линейно зависит от температуры (закон Гей-Люссака)
Cлайд 6
 Идеальный газ М.В.Ломоносов считал, что вещества состоят из корпускул, находящихся во вращательном движении. Д.Джоуль в 1852 году предложил более точную модель, приписав молекулам газа поступательное движение. В 1857 году немецкий физик Р.Клаузиус, используя модель идеального газа, впервые систематически изложил кинетическую теорию газов.
Идеальный газ М.В.Ломоносов считал, что вещества состоят из корпускул, находящихся во вращательном движении. Д.Джоуль в 1852 году предложил более точную модель, приписав молекулам газа поступательное движение. В 1857 году немецкий физик Р.Клаузиус, используя модель идеального газа, впервые систематически изложил кинетическую теорию газов.
Cлайд 7
 Модель Клаузиуса Идеальным Клаузиус назвал газ, удовлетворяющий следующим условиям: Объемом всех молекул газа можно пренебречь по сравнению с объемом сосуда, в котором этот газ находится Время столкновения молекул друг с другом пренебрежимо мало по сравнению со временем между двумя столкновениями Молекулы взаимодействую между собой только при непосредственном соприкосновении, при этом они отталкиваются Силы притяжения между молекулами идеального газа ничтожно малы и ими можно пренебречь
Модель Клаузиуса Идеальным Клаузиус назвал газ, удовлетворяющий следующим условиям: Объемом всех молекул газа можно пренебречь по сравнению с объемом сосуда, в котором этот газ находится Время столкновения молекул друг с другом пренебрежимо мало по сравнению со временем между двумя столкновениями Молекулы взаимодействую между собой только при непосредственном соприкосновении, при этом они отталкиваются Силы притяжения между молекулами идеального газа ничтожно малы и ими можно пренебречь
Cлайд 8
 Давление идеального газа Давление идеального газа равно 2/3 произведения концентрации молекул n на среднее значение кинетической энергии хаотического поступательного движения молекул Ek p = 1/3 nm0Ū2 = 2/3n(m0Ū2)/2 = 2/3Ēk (уравнение Клаузиуса)
Давление идеального газа Давление идеального газа равно 2/3 произведения концентрации молекул n на среднее значение кинетической энергии хаотического поступательного движения молекул Ek p = 1/3 nm0Ū2 = 2/3n(m0Ū2)/2 = 2/3Ēk (уравнение Клаузиуса)
Cлайд 9
 Решим задачу Считая воздух идеальным газом, состоящим из одинаковых молекул, оцените скорость теплового движения молекул газа при нормальных условиях. Дано: Формула: Решение: P = 1.01•105 Па U = √ Ū2 = U = √ (1,01*105)/1,29 = = 280 м/с = √ 3p/ρ ρ = 1,29 кг•м-3
Решим задачу Считая воздух идеальным газом, состоящим из одинаковых молекул, оцените скорость теплового движения молекул газа при нормальных условиях. Дано: Формула: Решение: P = 1.01•105 Па U = √ Ū2 = U = √ (1,01*105)/1,29 = = 280 м/с = √ 3p/ρ ρ = 1,29 кг•м-3