X
Код презентации скопируйте его
Молекулярная физика
Скачать эту презентациюПрезентация на тему Молекулярная физика
Скачать эту презентациюCлайд 3
 Цели урока 1.Способствовать формированию у учащихся знания молекулярно-кинетической теории идеального газа; выявить причинно-следственные связи между величинами, входящими в уравнение; сформировать понятие «изопроцесс». 2.Создать условия для выявления качества и уровня овладения знаниями и умениями с использованием компьютерных технологий.
Цели урока 1.Способствовать формированию у учащихся знания молекулярно-кинетической теории идеального газа; выявить причинно-следственные связи между величинами, входящими в уравнение; сформировать понятие «изопроцесс». 2.Создать условия для выявления качества и уровня овладения знаниями и умениями с использованием компьютерных технологий.
Cлайд 4
 Способствовать эмоционально-ценностному отношению к физическим явлениям в природе. Создать позитивные условия для проявления познавательного интереса у учащихся, желания самостоятельного поиска знаний и развития творческого мышления. Цели, ориентированные на развитие личности учащегося
Способствовать эмоционально-ценностному отношению к физическим явлениям в природе. Создать позитивные условия для проявления познавательного интереса у учащихся, желания самостоятельного поиска знаний и развития творческого мышления. Цели, ориентированные на развитие личности учащегося
Cлайд 5
 Выявить взаимосвязь теории и эксперимента как критерия истины. Продолжить работу по развитию мышления и мировоззрения школьников. Содействовать осознанию учащимися ценностей совместной деятельности на уроке. Воспитательные цели
Выявить взаимосвязь теории и эксперимента как критерия истины. Продолжить работу по развитию мышления и мировоззрения школьников. Содействовать осознанию учащимися ценностей совместной деятельности на уроке. Воспитательные цели
Cлайд 6
 Структура урока Актуализация знаний. Объяснение нового материала. Закрепление. Домашнее задание.
Структура урока Актуализация знаний. Объяснение нового материала. Закрепление. Домашнее задание.
Cлайд 7
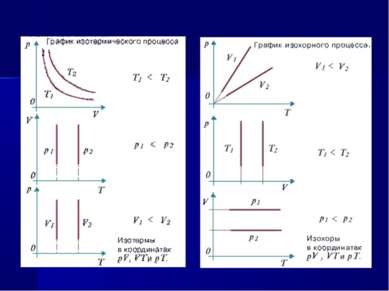
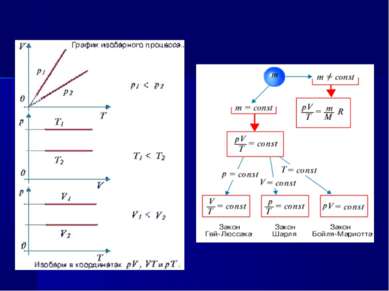
 Единый план изучения газовых законов Определение и условия осуществления процесса. Уравнение и формулировка закона. Историческая справка. Экспериментальное исследование справедливости закона. Графическое изображение процесса. Границы применимости закона.
Единый план изучения газовых законов Определение и условия осуществления процесса. Уравнение и формулировка закона. Историческая справка. Экспериментальное исследование справедливости закона. Графическое изображение процесса. Границы применимости закона.
Cлайд 9
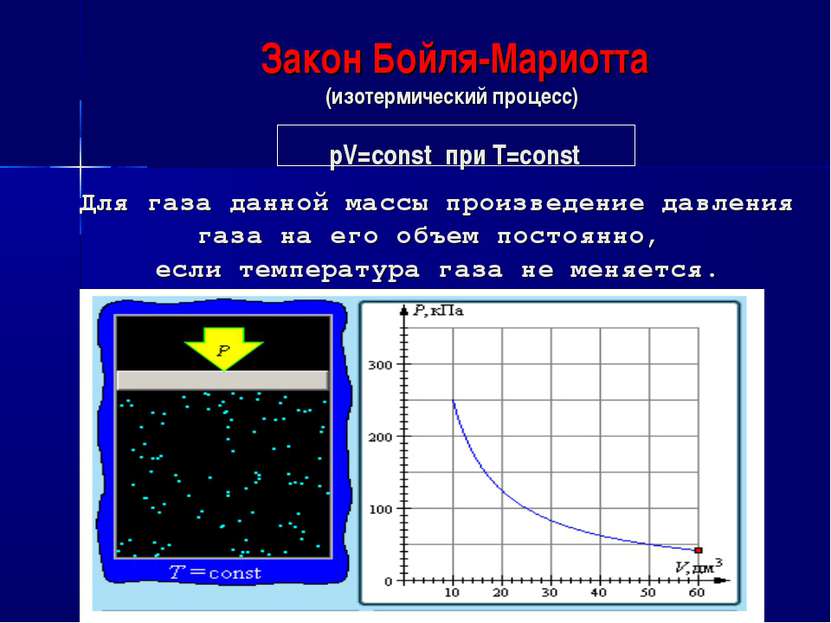
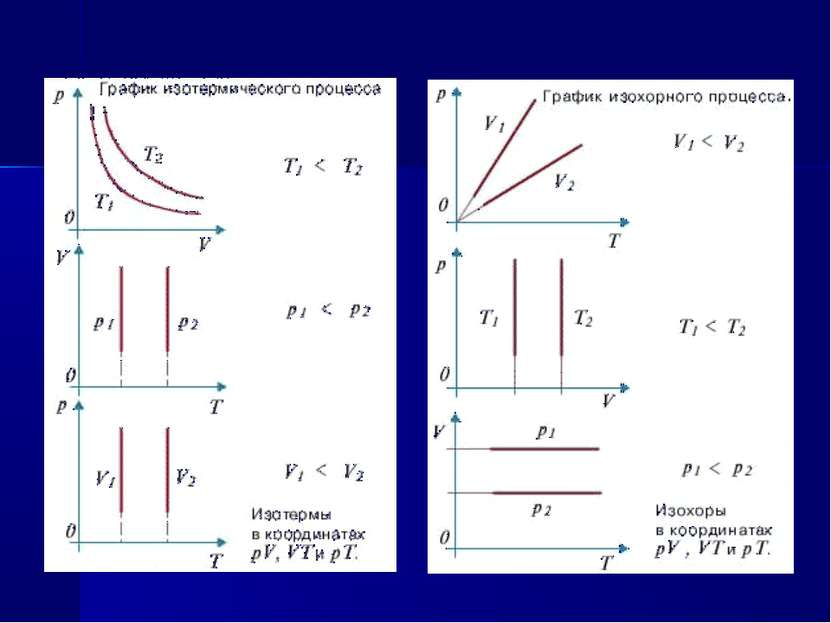
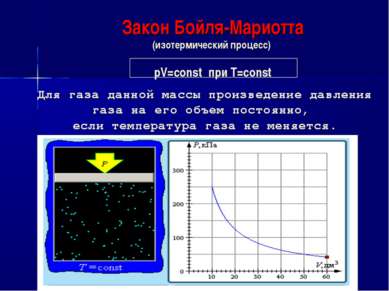 Закон Бойля-Мариотта (изотермический процесс) pV=const при T=const Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Закон Бойля-Мариотта (изотермический процесс) pV=const при T=const Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
Cлайд 10
 Бойль (Boyle) Роберт (25.I.1627–30.XII.1691) Английский физик и химик, член Лондонского королевского общества. Работы Бойля в области газов помогли ему сформулировать закон взаимосвязи между объемом газа и его давлением.
Бойль (Boyle) Роберт (25.I.1627–30.XII.1691) Английский физик и химик, член Лондонского королевского общества. Работы Бойля в области газов помогли ему сформулировать закон взаимосвязи между объемом газа и его давлением.
Cлайд 11
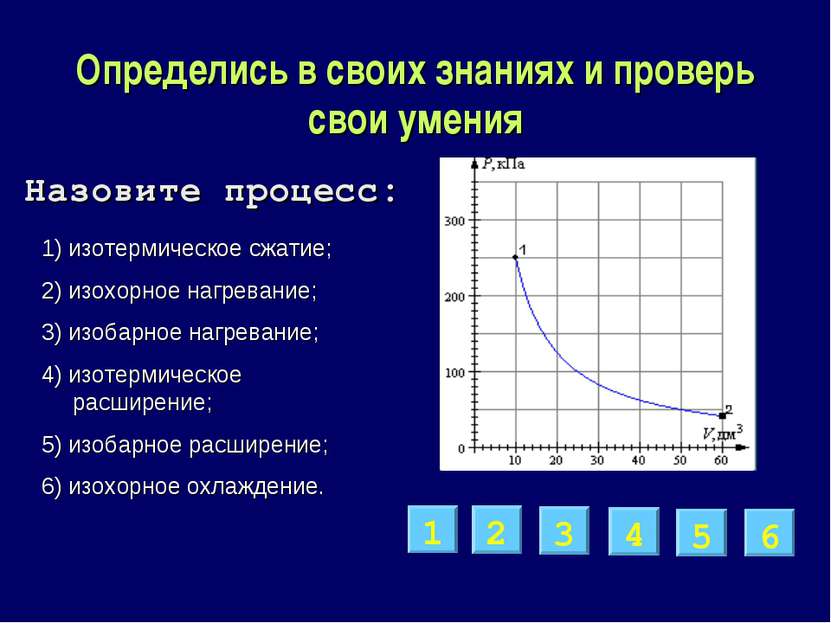
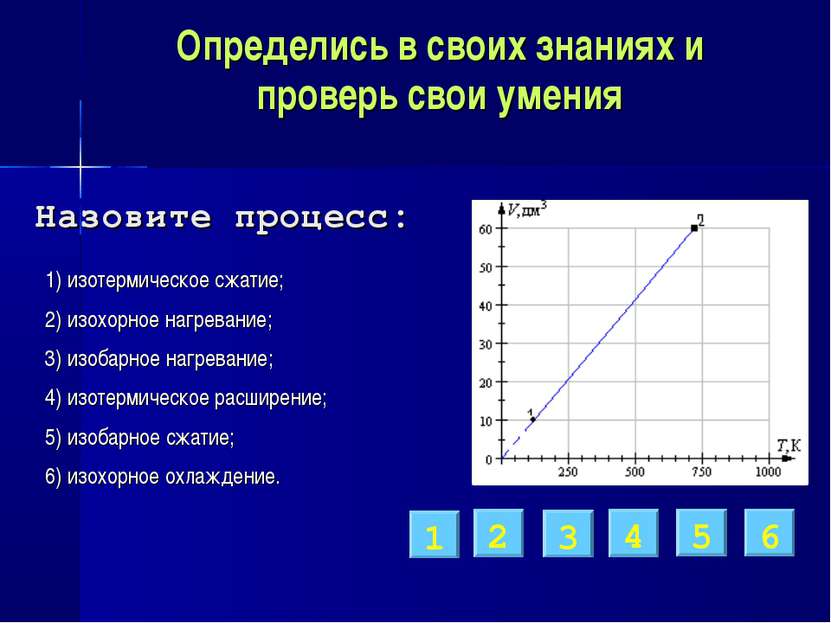
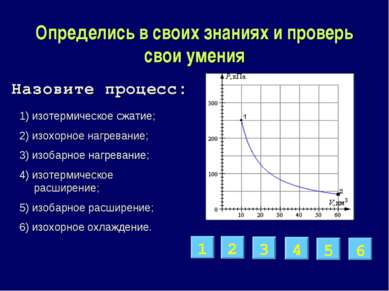 Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изохорное нагревание; 3) изобарное нагревание; 4) изотермическое расширение; 5) изобарное расширение; 6) изохорное охлаждение. 4 2 6 5 1 3 Назовите процесс:
Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изохорное нагревание; 3) изобарное нагревание; 4) изотермическое расширение; 5) изобарное расширение; 6) изохорное охлаждение. 4 2 6 5 1 3 Назовите процесс:
Cлайд 12
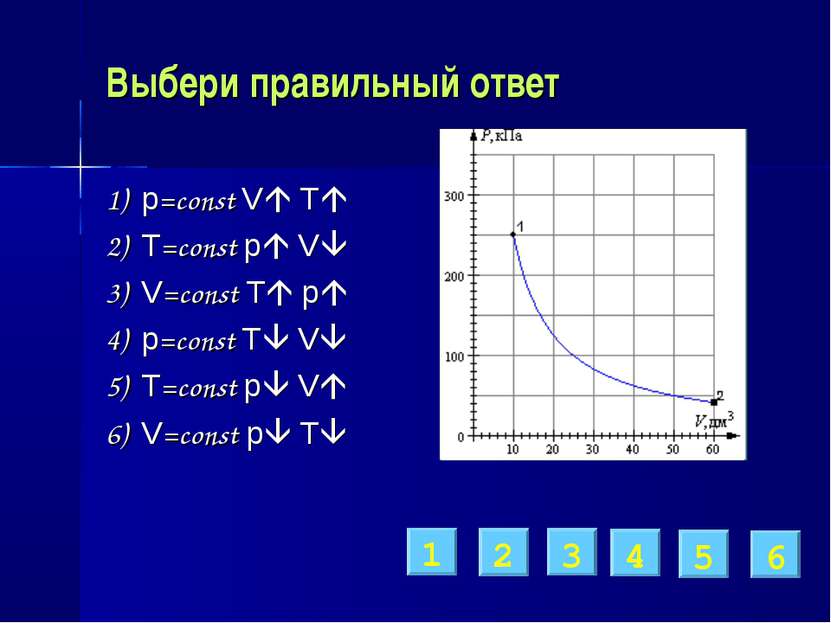
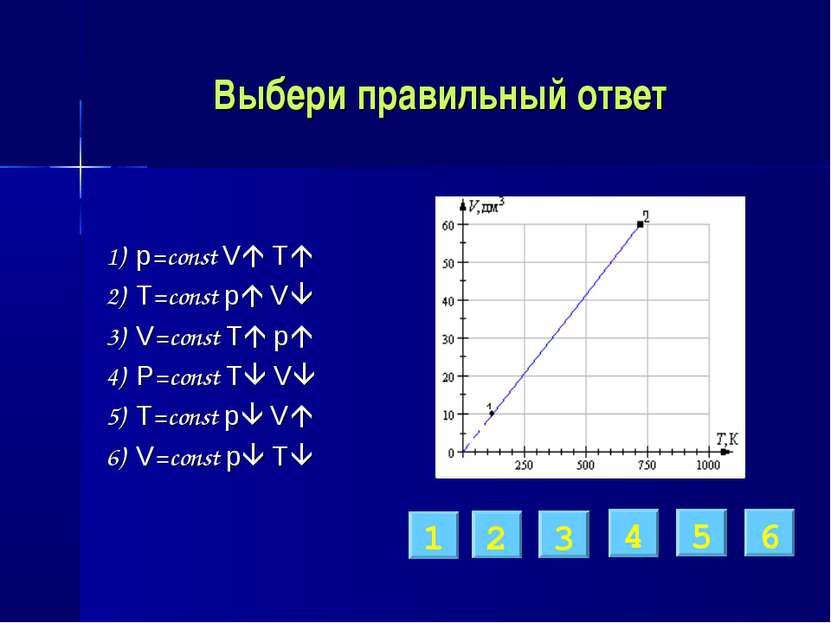
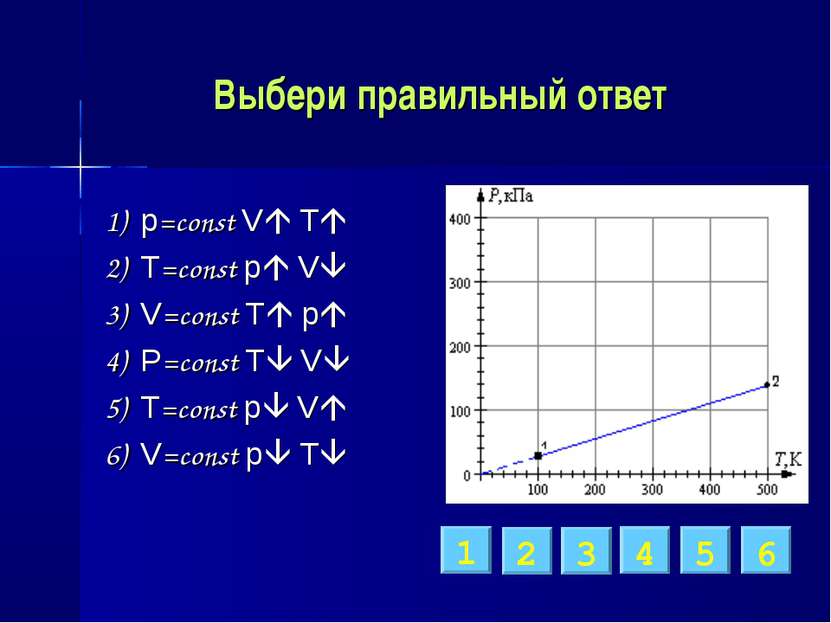
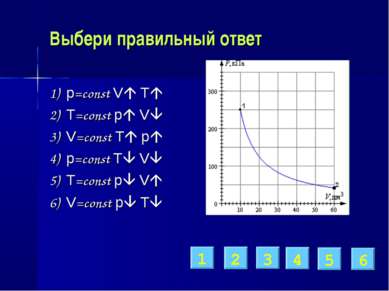 Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4) p=const T V 5) T=const p V 6) V=const p T 1 2 3 4 5 6
Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4) p=const T V 5) T=const p V 6) V=const p T 1 2 3 4 5 6
Cлайд 13
 Реши задачу Воздух под поршнем насоса имеет давление 105 Па и объем 260 см3. При каком давлении этот воздух займет объем 130 см3, если его температура не изменится? 1) 0,5*105 Па; 3) 2*104 Па; 5) 3*105 Па; 2) 5*104 Па; 4) 2*105 Па; 6) 3,9*105 Па 5 2 6 1 4 3
Реши задачу Воздух под поршнем насоса имеет давление 105 Па и объем 260 см3. При каком давлении этот воздух займет объем 130 см3, если его температура не изменится? 1) 0,5*105 Па; 3) 2*104 Па; 5) 3*105 Па; 2) 5*104 Па; 4) 2*105 Па; 6) 3,9*105 Па 5 2 6 1 4 3
Cлайд 14
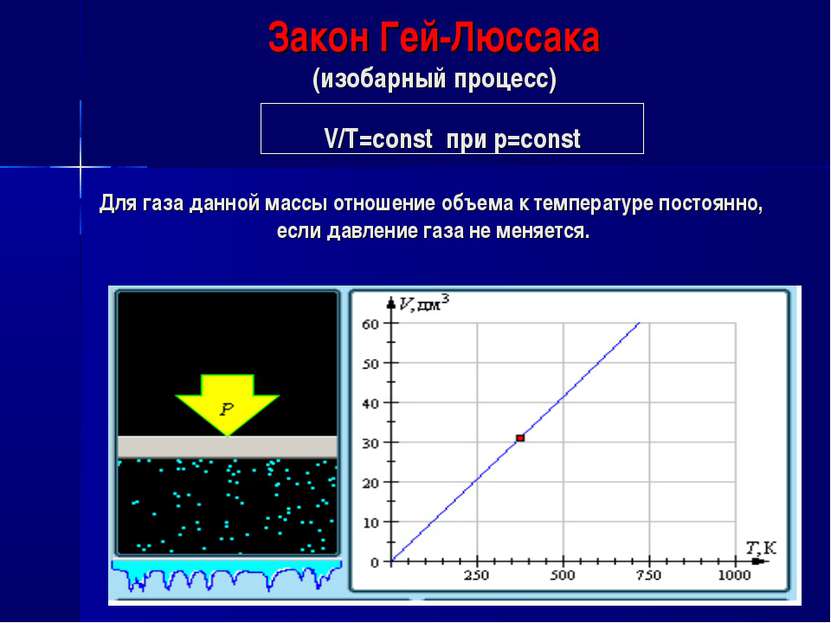
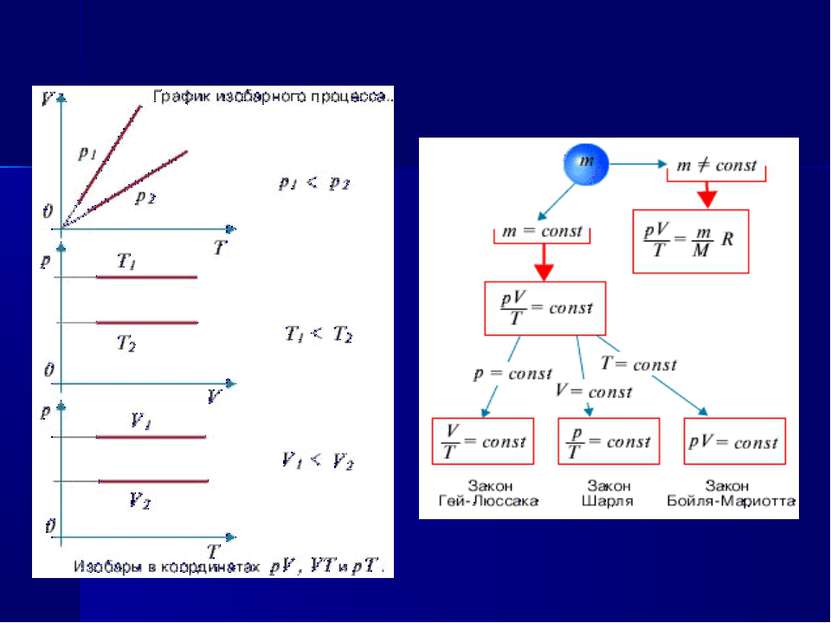
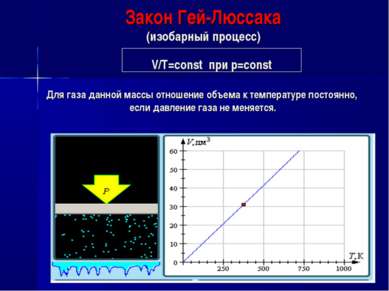 Закон Гей-Люссака (изобарный процесс) V/Т=const при р=const Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
Закон Гей-Люссака (изобарный процесс) V/Т=const при р=const Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
Cлайд 15
 Гей-Люссак (Gay-Lussac) Жозеф Луи (6.XII.1778–9.V.1850) Французский химик и физик, член АН в Париже (1806). В 1802, независимо от Дж. Дальтона, Гей- Люссак открыл закон теплового расширения газов.
Гей-Люссак (Gay-Lussac) Жозеф Луи (6.XII.1778–9.V.1850) Французский химик и физик, член АН в Париже (1806). В 1802, независимо от Дж. Дальтона, Гей- Люссак открыл закон теплового расширения газов.
Cлайд 16
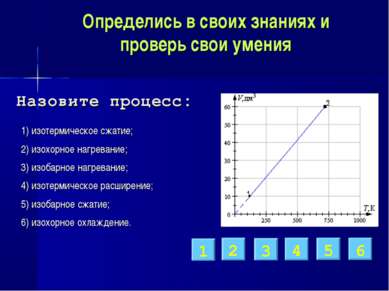 Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изохорное нагревание; 3) изобарное нагревание; 4) изотермическое расширение; 5) изобарное сжатие; 6) изохорное охлаждение. 3 2 6 5 1 4 Назовите процесс:
Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изохорное нагревание; 3) изобарное нагревание; 4) изотермическое расширение; 5) изобарное сжатие; 6) изохорное охлаждение. 3 2 6 5 1 4 Назовите процесс:
Cлайд 17
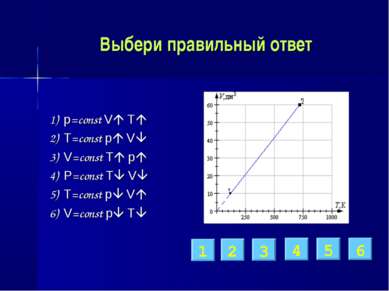 Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4) P=const T V 5) T=const p V 6) V=const p T 1 2 6 5 3 4
Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4) P=const T V 5) T=const p V 6) V=const p T 1 2 6 5 3 4
Cлайд 18
 Реши задачу Газ занимает объём 2м3 при температуре 2730С. Каков будет его объём при температуре 5460С и прежнем давлении? 1) 3,5м3; 3) 2,5м3; 5) 3м3; 2) 1м3; 4) 4м3; 6) 1,5м3 5 2 6 1 3 4
Реши задачу Газ занимает объём 2м3 при температуре 2730С. Каков будет его объём при температуре 5460С и прежнем давлении? 1) 3,5м3; 3) 2,5м3; 5) 3м3; 2) 1м3; 4) 4м3; 6) 1,5м3 5 2 6 1 3 4
Cлайд 19
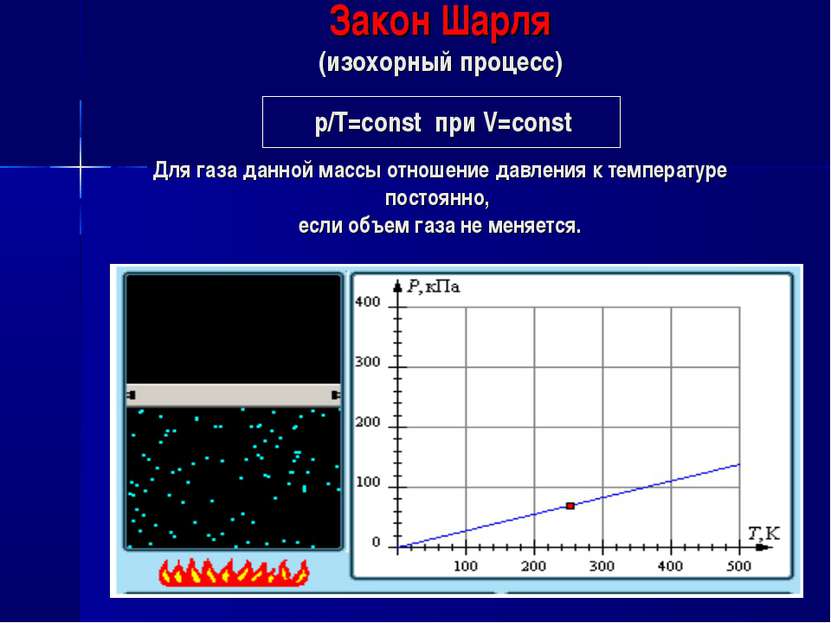
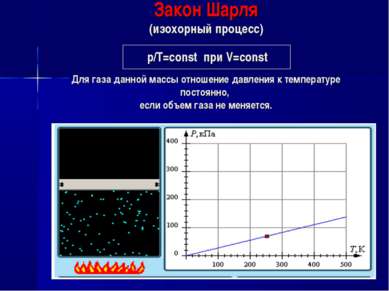 Закон Шарля (изохорный процесс) р/Т=const при V=const Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется.
Закон Шарля (изохорный процесс) р/Т=const при V=const Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется.
Cлайд 20
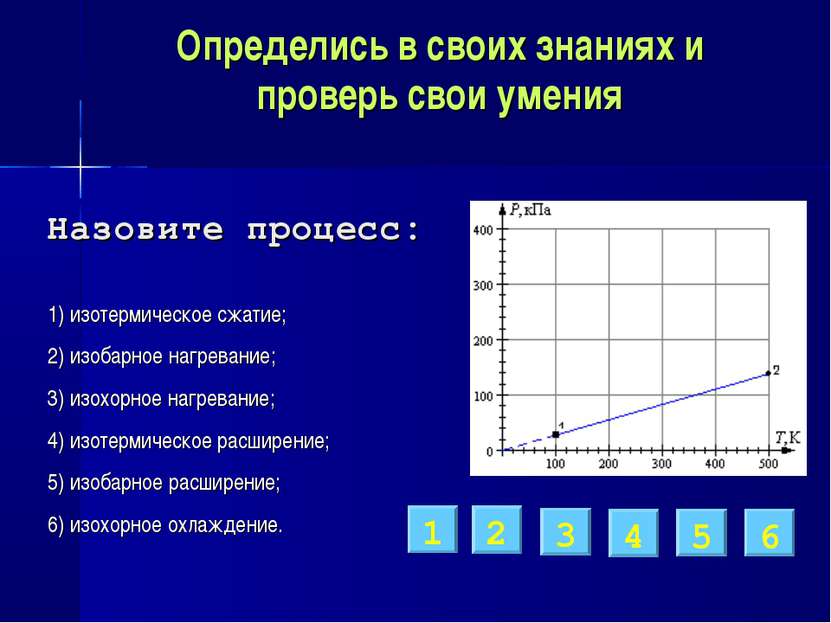
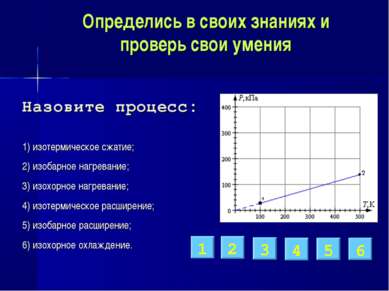 Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изобарное нагревание; 3) изохорное нагревание; 4) изотермическое расширение; 5) изобарное расширение; 6) изохорное охлаждение. 3 2 6 5 1 4 Назовите процесс:
Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изобарное нагревание; 3) изохорное нагревание; 4) изотермическое расширение; 5) изобарное расширение; 6) изохорное охлаждение. 3 2 6 5 1 4 Назовите процесс:
Cлайд 21
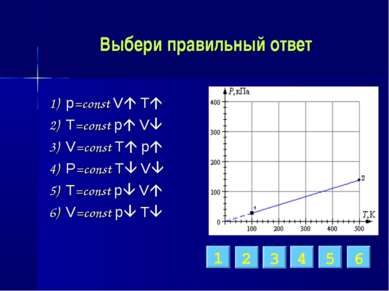 Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4) P=const T V 5) T=const p V 6) V=const p T 3 2 6 5 1 4
Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4) P=const T V 5) T=const p V 6) V=const p T 3 2 6 5 1 4
Cлайд 22
 Реши задачу Газ находится в баллоне при температуре 288 К и давлении 1,8 МПа. При какой температуре давление газа станет равным 1,55 МПа? Объем баллона считать неизменным. 1) 100К; 3) 248К; 5) 456К; 2) 284К; 4) 123К; 6) 789К 5 2 6 1 3 4
Реши задачу Газ находится в баллоне при температуре 288 К и давлении 1,8 МПа. При какой температуре давление газа станет равным 1,55 МПа? Объем баллона считать неизменным. 1) 100К; 3) 248К; 5) 456К; 2) 284К; 4) 123К; 6) 789К 5 2 6 1 3 4