X
Код презентации скопируйте его
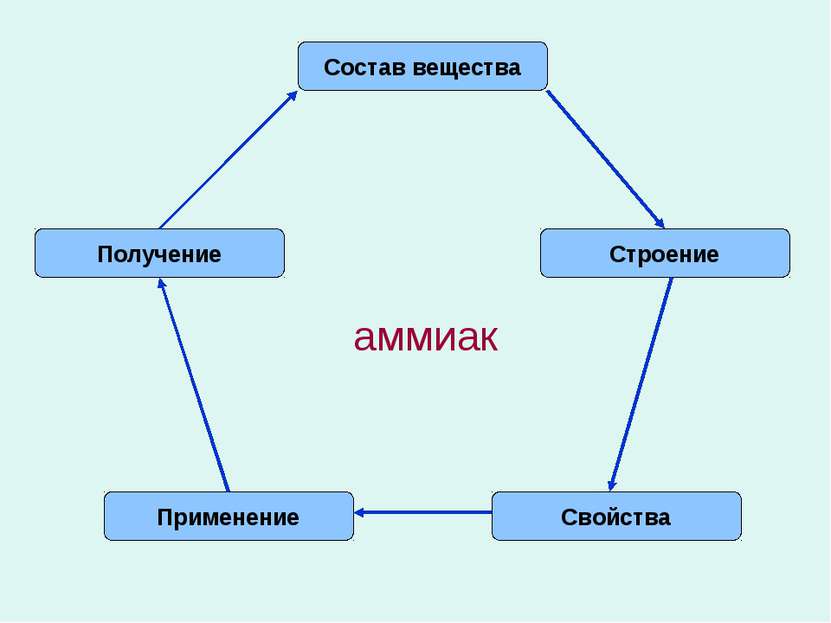
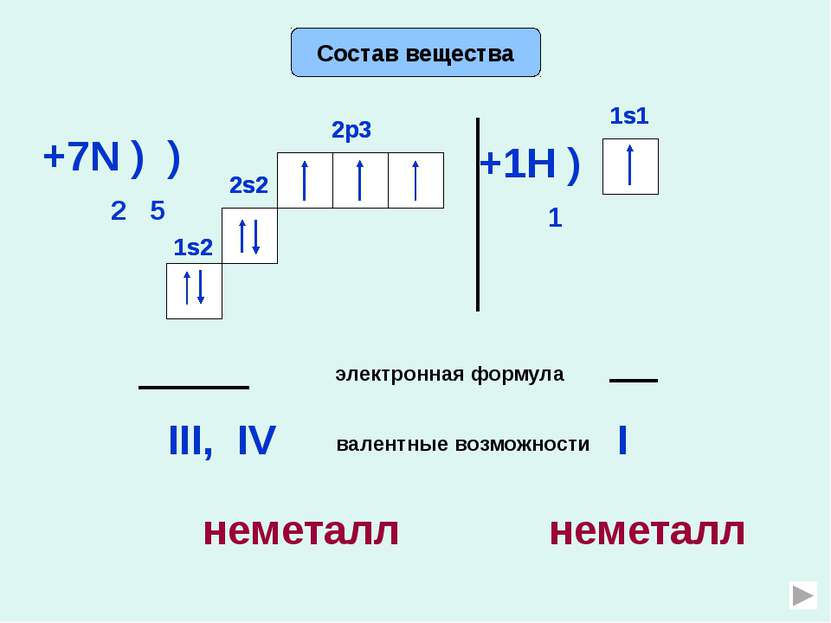
Аммиак
Скачать эту презентациюПрезентация на тему Аммиак
Скачать эту презентациюCлайд 1
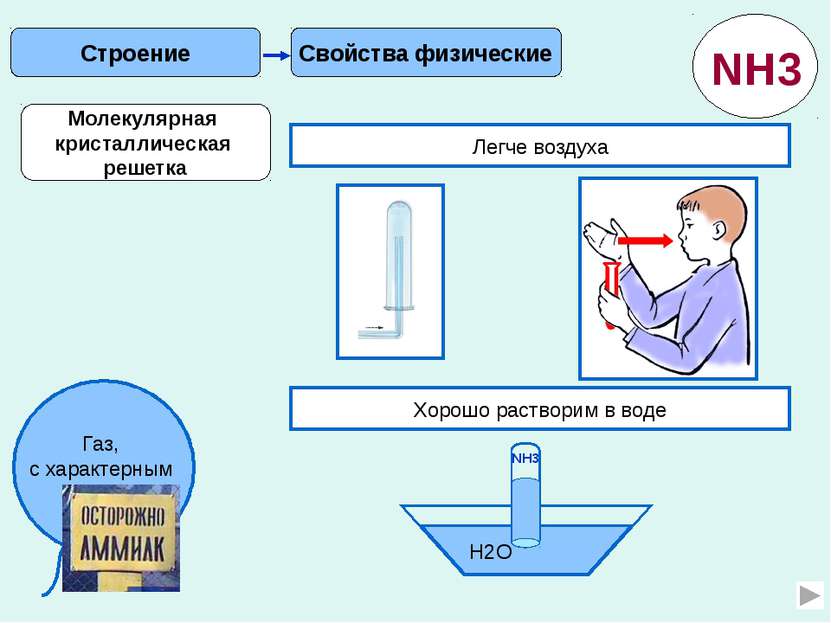
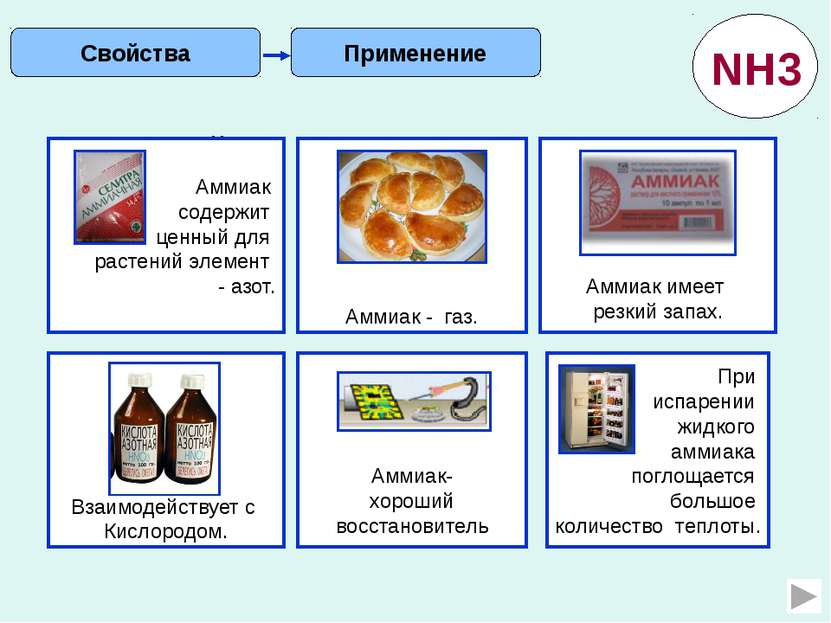
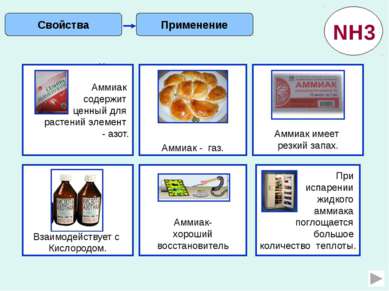
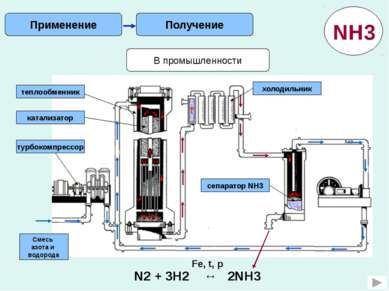
 Применение Свойства NH3 Аммиак содержит ценный для растений элемент - азот. Аммиак - газ. Аммиак имеет резкий запах. Взаимодействует с Кислородом. Аммиак- хороший восстановитель При испарении жидкого аммиака поглощается большое количество теплоты. Рассчитайте массовую долю азота в аммиачной селитре Запишите уравнение реакции разложения гидрокарбоната аммония Рассчитайте объем аммиака для приготовления 50г 5% - ного нашатырного спирта (при н.у.) Как осуществить превращения? NH3→ NO → NO2HNO3 Составьте окислительно-восстановительную реакцию взаимодействия хлорида аммония с оксидом меди. Какой объем при нормальных условиях будет занимать 1 кг жидкого аммиака.
Применение Свойства NH3 Аммиак содержит ценный для растений элемент - азот. Аммиак - газ. Аммиак имеет резкий запах. Взаимодействует с Кислородом. Аммиак- хороший восстановитель При испарении жидкого аммиака поглощается большое количество теплоты. Рассчитайте массовую долю азота в аммиачной селитре Запишите уравнение реакции разложения гидрокарбоната аммония Рассчитайте объем аммиака для приготовления 50г 5% - ного нашатырного спирта (при н.у.) Как осуществить превращения? NH3→ NO → NO2HNO3 Составьте окислительно-восстановительную реакцию взаимодействия хлорида аммония с оксидом меди. Какой объем при нормальных условиях будет занимать 1 кг жидкого аммиака.
Cлайд 3
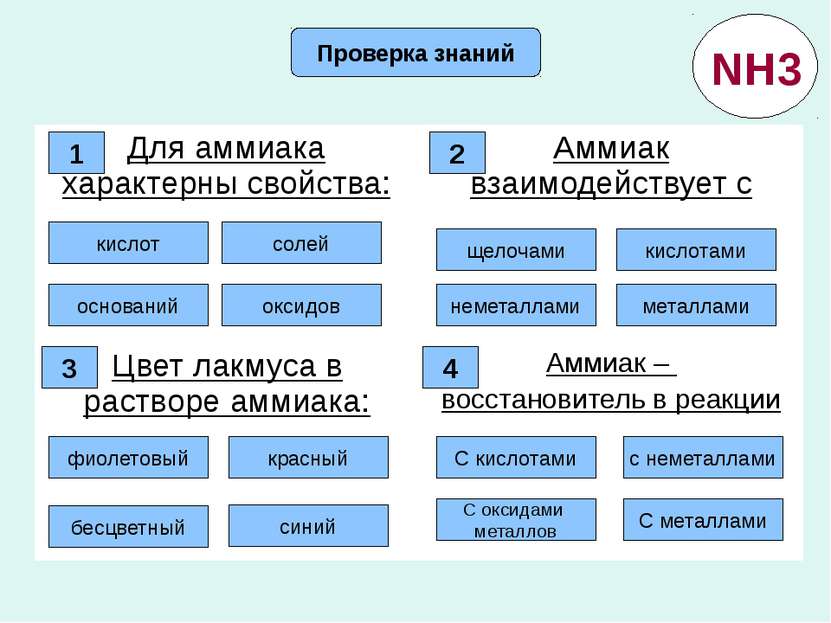
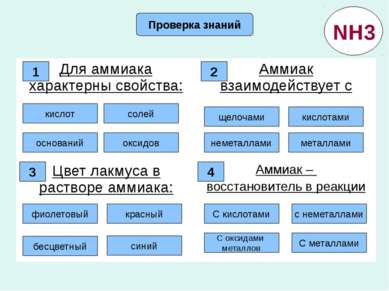
 Проверка знаний Правильно! Ошибка Ошибка Ошибка 1 кислот солей оксидов оснований 2 Ошибка Правильно! Ошибка Ошибка щелочами кислотами металлами неметаллами 3 Ошибка Правильно! Ошибка Ошибка Ошибка Ошибка Ошибка Правильно! фиолетовый бесцветный красный синий С кислотами С оксидами металлов с неметаллами С металлами 4 NH3 Для аммиака характерны свойства: Аммиак взаимодействует с Цвет лакмуса в растворе аммиака: Аммиак – восстановитель в реакции
Проверка знаний Правильно! Ошибка Ошибка Ошибка 1 кислот солей оксидов оснований 2 Ошибка Правильно! Ошибка Ошибка щелочами кислотами металлами неметаллами 3 Ошибка Правильно! Ошибка Ошибка Ошибка Ошибка Ошибка Правильно! фиолетовый бесцветный красный синий С кислотами С оксидами металлов с неметаллами С металлами 4 NH3 Для аммиака характерны свойства: Аммиак взаимодействует с Цвет лакмуса в растворе аммиака: Аммиак – восстановитель в реакции
Cлайд 4
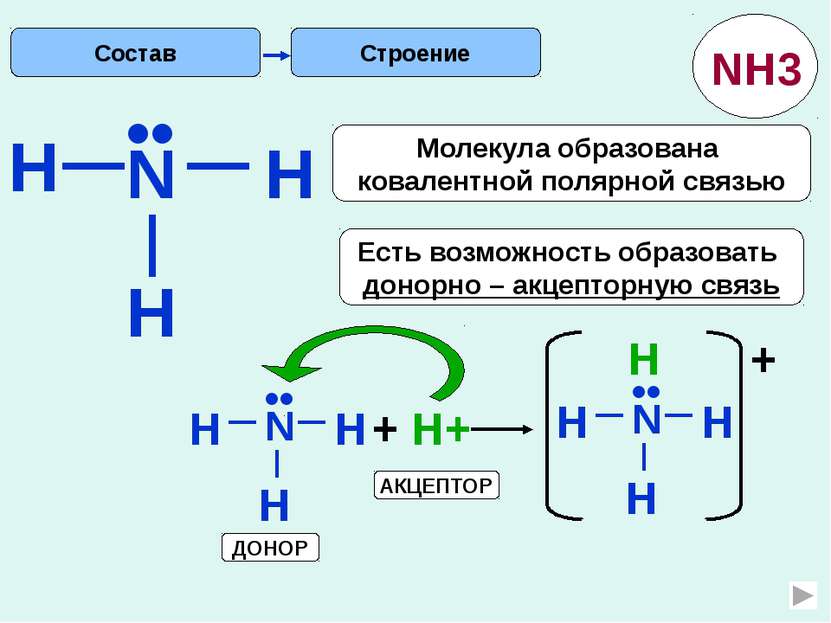
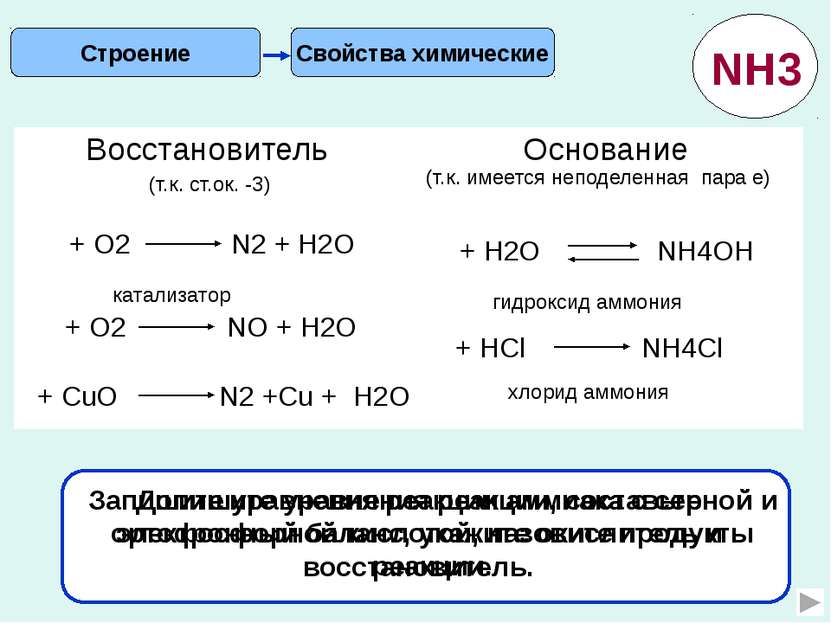
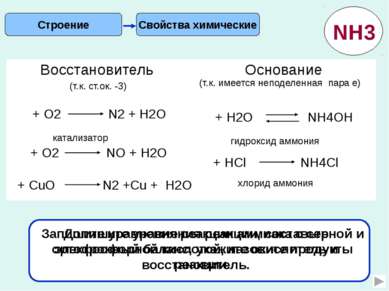
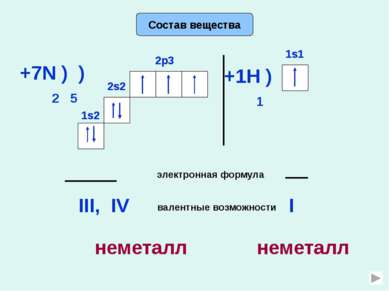
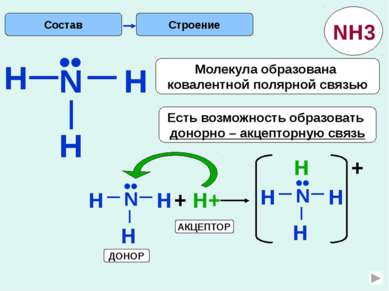 Свойства химические Строение (т.к. ст.ок. -3) (т.к. имеется неподеленная пара е) Допишите уравнения реакции, составьте электронный баланс, укажите окислитель и восстановитель. гидроксид аммония хлорид аммония Запишите уравнения реакции аммиака с серной и ортофосфорной кислотой, назовите продукты реакции. NH3 + О2 N2 + Н2О катализатор + CuО N2 +Cu + Н2О + HCl NH4Cl + H2O NH4OH Восстановитель Основание
Свойства химические Строение (т.к. ст.ок. -3) (т.к. имеется неподеленная пара е) Допишите уравнения реакции, составьте электронный баланс, укажите окислитель и восстановитель. гидроксид аммония хлорид аммония Запишите уравнения реакции аммиака с серной и ортофосфорной кислотой, назовите продукты реакции. NH3 + О2 N2 + Н2О катализатор + CuО N2 +Cu + Н2О + HCl NH4Cl + H2O NH4OH Восстановитель Основание
Cлайд 5
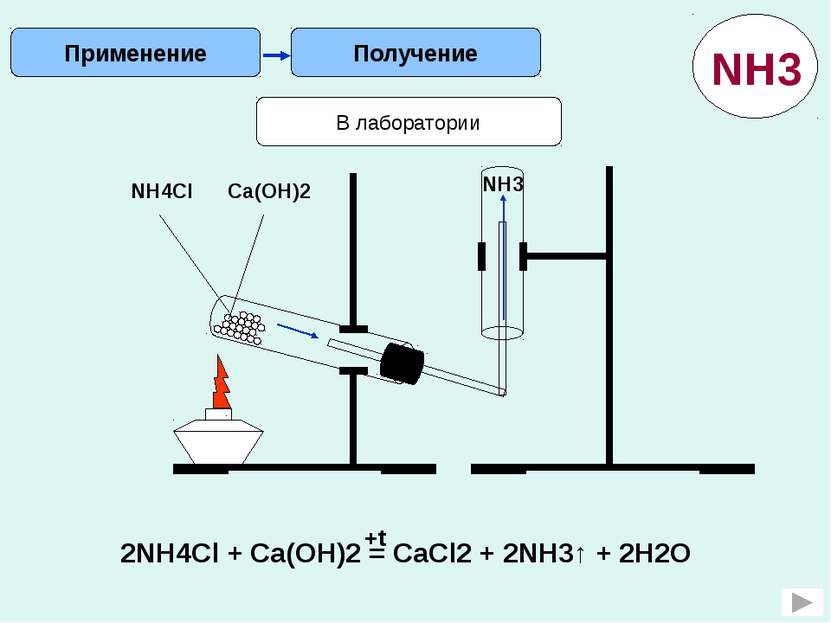
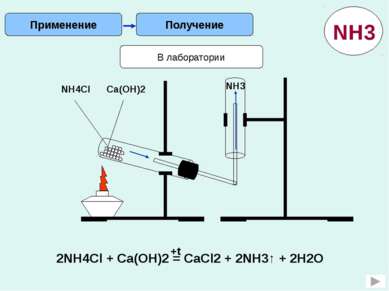
 Получение Применение В лаборатории NH4Cl Ca(OH)2 NH3 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O +t NH3
Получение Применение В лаборатории NH4Cl Ca(OH)2 NH3 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O +t NH3