X
Код презентации скопируйте его
В царстве кислот
Скачать эту презентациюПрезентация на тему В царстве кислот
Скачать эту презентациюCлайд 3
 1. Повторить определение кислот, их состав и классификацию. 2. Выяснить значение кислот для человека и природы. 3. Изучить химические свойства кислот. 4. Развивать умение у учащихся логически мыслить, умение наблюдать, анализировать, делать выводы.
1. Повторить определение кислот, их состав и классификацию. 2. Выяснить значение кислот для человека и природы. 3. Изучить химические свойства кислот. 4. Развивать умение у учащихся логически мыслить, умение наблюдать, анализировать, делать выводы.
Cлайд 4
 В природе существует множество различных кислот. Встречались ли вы где-нибудь с кислотами, кроме уроков химии? Выбери продукты, содержащие кислоты:
В природе существует множество различных кислот. Встречались ли вы где-нибудь с кислотами, кроме уроков химии? Выбери продукты, содержащие кислоты:
Cлайд 5
 Пора отправится в гости .Однако, чтобы попасть в дом, необходимо вспомнить адрес хозяев, их имена и фамилии. 1.Что общего у всех кислот: H2SO4, HCL, H2CO3, HNO3, H3PO4, H2S ? 2.Чем различаются следующие кислоты? H2CO3 и HCL, H2SO4 и H2S, H3PO4 и НF? 3. По какому ещё признаку можно разделить кислоты на группы?
Пора отправится в гости .Однако, чтобы попасть в дом, необходимо вспомнить адрес хозяев, их имена и фамилии. 1.Что общего у всех кислот: H2SO4, HCL, H2CO3, HNO3, H3PO4, H2S ? 2.Чем различаются следующие кислоты? H2CO3 и HCL, H2SO4 и H2S, H3PO4 и НF? 3. По какому ещё признаку можно разделить кислоты на группы?
Cлайд 7
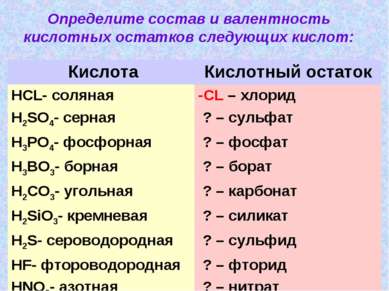 Определите состав и валентность кислотных остатков следующих кислот: Кислота Кислотный остаток HCL- cоляная -CL – хлорид H2SO4- серная ? – сульфат H3PO4- фосфорная ? – фосфат H3BO3- борная ? – борат H2CO3- угольная ? – карбонат H2SiO3- кремневая ? – силикат H2S- сероводородная ? – сульфид HF- фтороводородная ? – фторид HNO3- азотная ? – нитрат
Определите состав и валентность кислотных остатков следующих кислот: Кислота Кислотный остаток HCL- cоляная -CL – хлорид H2SO4- серная ? – сульфат H3PO4- фосфорная ? – фосфат H3BO3- борная ? – борат H2CO3- угольная ? – карбонат H2SiO3- кремневая ? – силикат H2S- сероводородная ? – сульфид HF- фтороводородная ? – фторид HNO3- азотная ? – нитрат
Cлайд 8
 Мы попали в комнату, где много гостей. Необходимо найти хозяев и выделить их ( выписать формулы кислот). MgCL2, H2SO4, Ca(OH)2, CuSO4, H2O, HCL, Fe2O3, NaOH, HF, ZnCL2, H2CO3, MgO, O2, H3PO4, KOH, H2, H2SiO4. Кислоты – большие затейники и решили поиграть с вами в игру «третий лишний»: А) BaO, HNO3, HCL; B) Na2SO4,H2S,H2SO4; Б) H2CO3, HF, H2O; Г) H3PO4, H2, H2SiO3.
Мы попали в комнату, где много гостей. Необходимо найти хозяев и выделить их ( выписать формулы кислот). MgCL2, H2SO4, Ca(OH)2, CuSO4, H2O, HCL, Fe2O3, NaOH, HF, ZnCL2, H2CO3, MgO, O2, H3PO4, KOH, H2, H2SiO4. Кислоты – большие затейники и решили поиграть с вами в игру «третий лишний»: А) BaO, HNO3, HCL; B) Na2SO4,H2S,H2SO4; Б) H2CO3, HF, H2O; Г) H3PO4, H2, H2SiO3.
Cлайд 9
 Интересно, какие кислоты с какими веществами дружат? Однако, это очень своенравные вещества, и чтобы подружиться с ними надо знать их характер: Это очень едкие вещества! Как вы считаете, чтобы приготовить раствор кислоты, надо: А)прилить кислоту в воду; Б)прилить воду в кислоту? Будьте с ними осторожны!
Интересно, какие кислоты с какими веществами дружат? Однако, это очень своенравные вещества, и чтобы подружиться с ними надо знать их характер: Это очень едкие вещества! Как вы считаете, чтобы приготовить раствор кислоты, надо: А)прилить кислоту в воду; Б)прилить воду в кислоту? Будьте с ними осторожны!
Cлайд 10
 1. Волшебные индикаторы 2. Отношение к металлам: (с разными металлами кислоты дружат по разному). H2SO4 + Zn = ZnSO4 + H2 HCL + Cu = Давайте попробуем дописать уравнения реакций и назвать полученные вещества: 3. Реакции с основными оксидами: H2SO4 + MgO = MgSO4 + H2O H2SO4 + CuO = CuSO4 + H2O (сульфат цинка) (сульфат магния) ( сульфат меди (II) )
1. Волшебные индикаторы 2. Отношение к металлам: (с разными металлами кислоты дружат по разному). H2SO4 + Zn = ZnSO4 + H2 HCL + Cu = Давайте попробуем дописать уравнения реакций и назвать полученные вещества: 3. Реакции с основными оксидами: H2SO4 + MgO = MgSO4 + H2O H2SO4 + CuO = CuSO4 + H2O (сульфат цинка) (сульфат магния) ( сульфат меди (II) )
Cлайд 11
 4. Реакции с основаниями: H2SO4 + 2NaOH = Na2SO4 +2H2O 2HCL + Cu(OH)2 = CuCL2 + 2H2O 5. Реакции с солями: А) со щелочами: Б) с нерастворимыми основаниями: ( более сильные кислоты вытесняют из соли менее сильные, но не наоборот!) Na2SiO3 + H2CO3 = Na2CO3 + H2SiO3 Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O (сульфат натрия) (хлорид меди) ( карбонат натрия) (сульфат натрия) Вещества, в которых атомы металла соединены с кислотными остатками, называются солями.
4. Реакции с основаниями: H2SO4 + 2NaOH = Na2SO4 +2H2O 2HCL + Cu(OH)2 = CuCL2 + 2H2O 5. Реакции с солями: А) со щелочами: Б) с нерастворимыми основаниями: ( более сильные кислоты вытесняют из соли менее сильные, но не наоборот!) Na2SiO3 + H2CO3 = Na2CO3 + H2SiO3 Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O (сульфат натрия) (хлорид меди) ( карбонат натрия) (сульфат натрия) Вещества, в которых атомы металла соединены с кислотными остатками, называются солями.
Cлайд 12
 Чтобы вы не скучали, кислоты придумали игру «Угадай». Назовите номера практически возможных реакций. 1) AL+ HCL= 2) Cu + H2SO4= 3) CuO + H2SO4= 4) Ag + H3PO4= 5) KOH + HCL= 6) SO3 + H2SO4= А теперь игра «Мои друзья». могут ли одновременно находиться в растворе: А) NaOH и KOH; в) Ca(OH)2 и HCL; Б) NaOH и HNO3; г) Ba(OH)2 и LiOH.
Чтобы вы не скучали, кислоты придумали игру «Угадай». Назовите номера практически возможных реакций. 1) AL+ HCL= 2) Cu + H2SO4= 3) CuO + H2SO4= 4) Ag + H3PO4= 5) KOH + HCL= 6) SO3 + H2SO4= А теперь игра «Мои друзья». могут ли одновременно находиться в растворе: А) NaOH и KOH; в) Ca(OH)2 и HCL; Б) NaOH и HNO3; г) Ba(OH)2 и LiOH.
Cлайд 13
 Один рассеянный человек писал уравнения реакций и потерял свои записи, остались в памяти только продукты реакции. Помогите восстановить записи: А) ? + ? = Na2SO4 + ? ; Б) ? + ? =ZnCL2 + H2 ; B) MgO + ? = MgSO4 + ? ; Г) K2CO3 +? = KCL +? + ? Молодцы, ребята! За вашу помощь этот человек подарил вам разные металлы. С какой «тройкой» этих металлов может реагировать соляная кислота? a) Na, Ba, Ag; б) K, Ca, Au; в) Mg, AL, Zn; г) Pb, Cr, Cu.
Один рассеянный человек писал уравнения реакций и потерял свои записи, остались в памяти только продукты реакции. Помогите восстановить записи: А) ? + ? = Na2SO4 + ? ; Б) ? + ? =ZnCL2 + H2 ; B) MgO + ? = MgSO4 + ? ; Г) K2CO3 +? = KCL +? + ? Молодцы, ребята! За вашу помощь этот человек подарил вам разные металлы. С какой «тройкой» этих металлов может реагировать соляная кислота? a) Na, Ba, Ag; б) K, Ca, Au; в) Mg, AL, Zn; г) Pb, Cr, Cu.
Cлайд 14
 Время в гостях летит быстро, и надо прощаться с хозяевами. Однако неожиданно за окном пошел дождь и кислоты нас не могут проводить, так как с дождевой водой представляют опасную смесь! В чем опасность кислотных дождей? Если вы не знаете, вам об этом расскажет угольная кислота. Найди её из перечня кислот: HCL, H2SO3, H2CO3, H2SiO3, HNO3, H3PO4
Время в гостях летит быстро, и надо прощаться с хозяевами. Однако неожиданно за окном пошел дождь и кислоты нас не могут проводить, так как с дождевой водой представляют опасную смесь! В чем опасность кислотных дождей? Если вы не знаете, вам об этом расскажет угольная кислота. Найди её из перечня кислот: HCL, H2SO3, H2CO3, H2SiO3, HNO3, H3PO4
Cлайд 15
 CO2 + H2O = H2CO3 H2SO4 SO2 + H2O = SO3 + H2O = H2SO3 3N02 +H2O = 2 HNO3 + NO Допишите уравнения реакций образования кислотных дождей: Итак, оксиды серы, азота и углерода попадают на землю в виде сухих осадков (так называемое «сухое осаждение»), подкисляя почву и воду. А также вместе с дождём, снегом и градом ( так называемое «влажное осаждение»). Даже на большом расстоянии от загряз- нения дождь имеет слабокислую реакцию!
CO2 + H2O = H2CO3 H2SO4 SO2 + H2O = SO3 + H2O = H2SO3 3N02 +H2O = 2 HNO3 + NO Допишите уравнения реакций образования кислотных дождей: Итак, оксиды серы, азота и углерода попадают на землю в виде сухих осадков (так называемое «сухое осаждение»), подкисляя почву и воду. А также вместе с дождём, снегом и градом ( так называемое «влажное осаждение»). Даже на большом расстоянии от загряз- нения дождь имеет слабокислую реакцию!
Cлайд 16
 Заполните таблицу, вставляя формулы и названия кислот, содержащихся в кислотном дожде, и формулы оксидов из которых они образуются: Формула кислоты Название кислоты Кислотный оксид HNO3 серная CO2 H2SO3 азотистая
Заполните таблицу, вставляя формулы и названия кислот, содержащихся в кислотном дожде, и формулы оксидов из которых они образуются: Формула кислоты Название кислоты Кислотный оксид HNO3 серная CO2 H2SO3 азотистая
Cлайд 17
 Наконец дождь кончился и мы можем спокойно идти домой. Сегодня вы узнали много нового и интересного о кислотах, и будем надеяться, что полученные знания вам помогут в жизни! Ну а вам остаётся приготовить домашнее задание к следующему уроку: & 8.1 Приготовить творческие карточки-задания по теме «Кислоты» 3.Сообщение по теме «Кислоты в аптеке»
Наконец дождь кончился и мы можем спокойно идти домой. Сегодня вы узнали много нового и интересного о кислотах, и будем надеяться, что полученные знания вам помогут в жизни! Ну а вам остаётся приготовить домашнее задание к следующему уроку: & 8.1 Приготовить творческие карточки-задания по теме «Кислоты» 3.Сообщение по теме «Кислоты в аптеке»