X
Код презентации скопируйте его
Углерод. Кремний
Скачать эту презентациюПрезентация на тему Углерод. Кремний
Скачать эту презентациюCлайд 1
 Характерные степени окисления: В большинстве: +4; +2; +3 Важнейшие соединения: CO, карбонилы металлов, CO2, соли H2CO3 – карбонаты, HCN – синильная кислота и её соли цианиды, HCNS – роданиды. Fe3C, CaC2 – карбиды и др. CS2 – сероуглерод CoCl2 – фосген CCl2 – четырех хлор. углерод
Характерные степени окисления: В большинстве: +4; +2; +3 Важнейшие соединения: CO, карбонилы металлов, CO2, соли H2CO3 – карбонаты, HCN – синильная кислота и её соли цианиды, HCNS – роданиды. Fe3C, CaC2 – карбиды и др. CS2 – сероуглерод CoCl2 – фосген CCl2 – четырех хлор. углерод
Cлайд 2
 Природные ресурсы: В земной коре 0,14 %. Большая часть его входит в состав карбонатов (CaCO3, MgCO3), нефти, каменного и бурого угля, сланцев, природного газа. Хотя содержание CO2 в атмосфере невелико (всего ~ 0,03%), но его общая масса составляет около 600 млн тонн. Углерод входит в состав всего живого + графит, алмаз, карбин и т.д.
Природные ресурсы: В земной коре 0,14 %. Большая часть его входит в состав карбонатов (CaCO3, MgCO3), нефти, каменного и бурого угля, сланцев, природного газа. Хотя содержание CO2 в атмосфере невелико (всего ~ 0,03%), но его общая масса составляет около 600 млн тонн. Углерод входит в состав всего живого + графит, алмаз, карбин и т.д.
Cлайд 3
 Свойства и получение Углерод имеет уникальное строение 1s22s22p2. В валентном состоянии: 1s22s px py pz Он имеет неспаренных электрона и во внешнем электронном слое отсутствуют как свободные квантовые ячейки, так и неподеленные электронные пары.
Свойства и получение Углерод имеет уникальное строение 1s22s22p2. В валентном состоянии: 1s22s px py pz Он имеет неспаренных электрона и во внешнем электронном слое отсутствуют как свободные квантовые ячейки, так и неподеленные электронные пары.
Cлайд 4
 Такое электронное строение и расположение углерода посередине шкалы электроотрицательнос-тей обуславливает свойства данного элемента, благодаря чему существует огромное многообразие органических соединений. Промежуточное значение электроотрицательности приводит к тому, что углерод образует ковалентные связи со всеми реакционоспособными элементами периодической таблицы, стоящими от него справа (O, N, галогены) и снизу (Si, Ge, Sn, Pb). Невозм0жность донорно-акцепторного взаимодействия обусловливает примерно одинаковую прочность связей с водородом, у которого нет неподеленных электронных пар и с другими атомами, имеющими неподеленные пары, а также связей С–С.
Такое электронное строение и расположение углерода посередине шкалы электроотрицательнос-тей обуславливает свойства данного элемента, благодаря чему существует огромное многообразие органических соединений. Промежуточное значение электроотрицательности приводит к тому, что углерод образует ковалентные связи со всеми реакционоспособными элементами периодической таблицы, стоящими от него справа (O, N, галогены) и снизу (Si, Ge, Sn, Pb). Невозм0жность донорно-акцепторного взаимодействия обусловливает примерно одинаковую прочность связей с водородом, у которого нет неподеленных электронных пар и с другими атомами, имеющими неподеленные пары, а также связей С–С.
Cлайд 5
 Четырехвалентность углерода предоставляет широкие возможности для разветвления цепей и образования циклических структур. Формирование цепей … – С – С – С – … энергетически выгоднее, чем молекул С2, в которых углерод двухвалентен и образует менее прочную π-связь, чем σ-связь в цепях. В подавляющем большинстве углерод четырехвалентен (исключение CO и существующие в плазме •CN; •CH3; :CH). Координационные числа выше 4 для углерода нехарактерны, т.к. его атом не имеет d–орбиталей в валентном слое (исключение – некторые карбиды).
Четырехвалентность углерода предоставляет широкие возможности для разветвления цепей и образования циклических структур. Формирование цепей … – С – С – С – … энергетически выгоднее, чем молекул С2, в которых углерод двухвалентен и образует менее прочную π-связь, чем σ-связь в цепях. В подавляющем большинстве углерод четырехвалентен (исключение CO и существующие в плазме •CN; •CH3; :CH). Координационные числа выше 4 для углерода нехарактерны, т.к. его атом не имеет d–орбиталей в валентном слое (исключение – некторые карбиды).
Cлайд 6
 Известно несколько аллотропных форм С: графит. Его кристаллическая решетка состоит из плоских слоев атомов, которые находятся на расстоянии 334 пм, и слабо связаны между собой, поэтому графит легко разделяется на чешуйки. Графит – электропроводен, теплопроводен, похож на металлы, свмое тугоплавкое из простых веществ tпл 3800°С. Природный графит встречается редко, используется искусственный, получаемый t° в электропечи при 2200°-2800° углей или нефтяного кокса. В зависимости от условий получения различают стеклографит, пирографит, графитовое волокно. Благодаря структуры в него могут внедряться B, F, Na, K, H2SO4, FeCl3, FeS2 и т.д. При этом образуется C8K, C64Na и т.д.
Известно несколько аллотропных форм С: графит. Его кристаллическая решетка состоит из плоских слоев атомов, которые находятся на расстоянии 334 пм, и слабо связаны между собой, поэтому графит легко разделяется на чешуйки. Графит – электропроводен, теплопроводен, похож на металлы, свмое тугоплавкое из простых веществ tпл 3800°С. Природный графит встречается редко, используется искусственный, получаемый t° в электропечи при 2200°-2800° углей или нефтяного кокса. В зависимости от условий получения различают стеклографит, пирографит, графитовое волокно. Благодаря структуры в него могут внедряться B, F, Na, K, H2SO4, FeCl3, FeS2 и т.д. При этом образуется C8K, C64Na и т.д.
Cлайд 7
 Разновидностями графита следует считать также сажу и древесный уголь. Одним из широко применяемых адсорбентов является активный (активированный уголь). Его получают обработкой древесного угля перегретым водяным паром (удаляют смолистые вещества из пор). Пиролизом определенных сортов каменного угля получают кокс. Это углерод (графит) + зола. Другой аллотропной модификацией является алмаз. В кристаллической решетке алмаза каждый атом 4 ковалентные связи (sp3 гибридизация, d(C–C) = 154 пм). Известны кристаллы алмаза кубической и гексагональной сингоний. (очень редко встречаются в природе).
Разновидностями графита следует считать также сажу и древесный уголь. Одним из широко применяемых адсорбентов является активный (активированный уголь). Его получают обработкой древесного угля перегретым водяным паром (удаляют смолистые вещества из пор). Пиролизом определенных сортов каменного угля получают кокс. Это углерод (графит) + зола. Другой аллотропной модификацией является алмаз. В кристаллической решетке алмаза каждый атом 4 ковалентные связи (sp3 гибридизация, d(C–C) = 154 пм). Известны кристаллы алмаза кубической и гексагональной сингоний. (очень редко встречаются в природе).
Cлайд 8
 Окрашенные (очень редкие алмазы) очень ценятся. Масса алмаза выражается в каратах. 1 карат составляет 0,2 г. Стоимость зависит от размера. Самый большой весит 600 г. Создаются искусственные алмазы (школа Лейпунского 1939 г. и Верещагина Л.Ф.). В 1963 удалось получить новую модификацию углерода, путем каталитического окисления ацетилена, которую назвали α-карбином). Позднее она была найдена в природе. Это линейный полимер. Это черный мелкокристаллический порошок. Получен также ρ-карбин
Окрашенные (очень редкие алмазы) очень ценятся. Масса алмаза выражается в каратах. 1 карат составляет 0,2 г. Стоимость зависит от размера. Самый большой весит 600 г. Создаются искусственные алмазы (школа Лейпунского 1939 г. и Верещагина Л.Ф.). В 1963 удалось получить новую модификацию углерода, путем каталитического окисления ацетилена, которую назвали α-карбином). Позднее она была найдена в природе. Это линейный полимер. Это черный мелкокристаллический порошок. Получен также ρ-карбин
Cлайд 9
 Соединения Водородные соединения изучаются в органической химии (CH4 и т.д.). Известно несколько кислородных соединений углерода – CO, CO2, C3O2, C5O2, C6O9 и циклические соединения (эфиры) C12O12 и (C4O3)n. CO и CO2 – являются наиболее распространенными оксидами. CO – бесцветный, малорастворимый в воде газ, без запаха. Очень ядовитый «угарный газ». В лабораторных условиях СО получают, действуя на муравьиную кислоту водоотнимающими средствами H2SO4 и P2O5.
Соединения Водородные соединения изучаются в органической химии (CH4 и т.д.). Известно несколько кислородных соединений углерода – CO, CO2, C3O2, C5O2, C6O9 и циклические соединения (эфиры) C12O12 и (C4O3)n. CO и CO2 – являются наиболее распространенными оксидами. CO – бесцветный, малорастворимый в воде газ, без запаха. Очень ядовитый «угарный газ». В лабораторных условиях СО получают, действуя на муравьиную кислоту водоотнимающими средствами H2SO4 и P2O5.
Cлайд 10
 CO – несолеобразующий оксид, образуется при горении угля при недостатке О2 или при очень высоких t˚. Получение: 1) промышленное: пропускают воздух через слой расплавленного угля. Смесь СО с азотом воздуха – генераторный газ. СО – сильный восстановитель (используется в металлических процессах).
CO – несолеобразующий оксид, образуется при горении угля при недостатке О2 или при очень высоких t˚. Получение: 1) промышленное: пропускают воздух через слой расплавленного угля. Смесь СО с азотом воздуха – генераторный газ. СО – сильный восстановитель (используется в металлических процессах).
Cлайд 11
 СО образует ряд реакций присоединения: с хлором (COCl2 – фосген, оксохлорид углерода) COCl2 – бурый газ, очень ядовит. с серой: с водородом под давлением, t˚
СО образует ряд реакций присоединения: с хлором (COCl2 – фосген, оксохлорид углерода) COCl2 – бурый газ, очень ядовит. с серой: с водородом под давлением, t˚
Cлайд 12
 Для поглощения СО используется конц. водный раствор. Продукты присоединения СО к атомам металлов многочисленны, их известно около 1000. Связь в них, как у комплексных соединений. Имеют широкое применение в препаративной химии. СО2 – газ. Две sp-гибридные орбитали углерода образуют две σ-связи с О2, а оставшиеся негибридизованными р-орбитали углерода дают с двумя р-орбиталями О2 π-связи. СО2 имеет линейное строение. Твердый СО2 испаряется при 78˚С, не плавясь (сухой лед). 10 % содержание СО2 в воздухе смертельно.
Для поглощения СО используется конц. водный раствор. Продукты присоединения СО к атомам металлов многочисленны, их известно около 1000. Связь в них, как у комплексных соединений. Имеют широкое применение в препаративной химии. СО2 – газ. Две sp-гибридные орбитали углерода образуют две σ-связи с О2, а оставшиеся негибридизованными р-орбитали углерода дают с двумя р-орбиталями О2 π-связи. СО2 имеет линейное строение. Твердый СО2 испаряется при 78˚С, не плавясь (сухой лед). 10 % содержание СО2 в воздухе смертельно.
Cлайд 13
 Получение: 1) в промышленности обжигом известняка 2) в лаборатории (в аппарате Кипна) СО2 растворим в воде: но реакция смещена влево, H2CO3 – угольная кислота слабая.
Получение: 1) в промышленности обжигом известняка 2) в лаборатории (в аппарате Кипна) СО2 растворим в воде: но реакция смещена влево, H2CO3 – угольная кислота слабая.
Cлайд 14
 Молекулы H2CO3 находятся только в растворе. Соли угольной кислоты – карбонаты, мало растворимы в воде. Для щелочных металлов известны гидрокарбонаты – NaHCO3, которые при t˚ разлагаются: 1) при t˚ углерод реагируют с серой: 2) углерод имеет много соединений с галогенами: простейшие СГ4. Практическое применение имеют CCl4 и CF4. CF2Cl2 (газ)– фрион (холодильники)
Молекулы H2CO3 находятся только в растворе. Соли угольной кислоты – карбонаты, мало растворимы в воде. Для щелочных металлов известны гидрокарбонаты – NaHCO3, которые при t˚ разлагаются: 1) при t˚ углерод реагируют с серой: 2) углерод имеет много соединений с галогенами: простейшие СГ4. Практическое применение имеют CCl4 и CF4. CF2Cl2 (газ)– фрион (холодильники)
Cлайд 15
 3) с азотом при t˚: HCN – летучая жидкость – сильный яд, слабая кислота, состоит из двух видов, находится таутомерном равновесии: Соли цианиды подвержены гидролизу, KCN, NaCN и т.д. При действии серы на цианиды щелочных металлов, образуются роданиды: соли роданистоводородной кислоты:
3) с азотом при t˚: HCN – летучая жидкость – сильный яд, слабая кислота, состоит из двух видов, находится таутомерном равновесии: Соли цианиды подвержены гидролизу, KCN, NaCN и т.д. При действии серы на цианиды щелочных металлов, образуются роданиды: соли роданистоводородной кислоты:
Cлайд 16
 соли называются роданиды. (AgCNS, NaCNS и т.д.) HCNS – сильная кислота, соли гидролизу не подвергаются. 4) карбиды – это соединения углерода с элементами имеющими меньшую электроотрицательность, чем С. карбиды делят на 3 группы: а) солеподобные связь ковалентная – ионная, Be2C, Mg2C3, CaC2, Al4C3, Mn3C и т.д. б) внедрения – металлоподобные, очень прочные, TiC, VC и т.д. в) ковалентные SiC, B4C – ковалентная связь.
соли называются роданиды. (AgCNS, NaCNS и т.д.) HCNS – сильная кислота, соли гидролизу не подвергаются. 4) карбиды – это соединения углерода с элементами имеющими меньшую электроотрицательность, чем С. карбиды делят на 3 группы: а) солеподобные связь ковалентная – ионная, Be2C, Mg2C3, CaC2, Al4C3, Mn3C и т.д. б) внедрения – металлоподобные, очень прочные, TiC, VC и т.д. в) ковалентные SiC, B4C – ковалентная связь.
Cлайд 17
 Применение Каменный уголь, нефть, природный газ -топливо. кокс. углерод – сталь. углеграфитовые материалы – граф. электроды, плавильные тигли, облицовка ванн в металлургии, в ядерных реакторах и т.д. графитовое волокно – детали самолетов и ракет. Активированный уголь – адсорбент. Сажа – наполнитель в резиновых изделиях. Алмазы для бурения и обработки твердых материалов.
Применение Каменный уголь, нефть, природный газ -топливо. кокс. углерод – сталь. углеграфитовые материалы – граф. электроды, плавильные тигли, облицовка ванн в металлургии, в ядерных реакторах и т.д. графитовое волокно – детали самолетов и ракет. Активированный уголь – адсорбент. Сажа – наполнитель в резиновых изделиях. Алмазы для бурения и обработки твердых материалов.
Cлайд 18
 Измеряя радиоактивность СО2, полученного сжиганием исследуемого образца органического происхождения (дерево, ткань и т.д.) определяют соединение 14С (5569 лет полураспада). Зная период полураспада 14С и его соединение в атмосферном СО2, вычисляют возраст находки «археологические часы». СО2 – сухой лед для пищевых продуктов. СО2 – для тушения огня. цианиды – для извлечения золота из руд. СаС2 – карбид Са для получения ацетилена.
Измеряя радиоактивность СО2, полученного сжиганием исследуемого образца органического происхождения (дерево, ткань и т.д.) определяют соединение 14С (5569 лет полураспада). Зная период полураспада 14С и его соединение в атмосферном СО2, вычисляют возраст находки «археологические часы». СО2 – сухой лед для пищевых продуктов. СО2 – для тушения огня. цианиды – для извлечения золота из руд. СаС2 – карбид Са для получения ацетилена.
Cлайд 19
 Кремний – Si Степени окисления +4 – SiO2, Na2SiO3 и др. Природные ресурсы: 27,6 % кремния в природе, второй после О2 элемент. В свободном состоянии не встречается, входит в состав алюмо и силикатных материалов. SiO2 – сильно распространен кварц → горный хрусталь (некоторые весят десятки тонн) песок SiO2 – кизельгур (инфузорная земля), остатки водорослей диатомовых. гранит содержит SiO2
Кремний – Si Степени окисления +4 – SiO2, Na2SiO3 и др. Природные ресурсы: 27,6 % кремния в природе, второй после О2 элемент. В свободном состоянии не встречается, входит в состав алюмо и силикатных материалов. SiO2 – сильно распространен кварц → горный хрусталь (некоторые весят десятки тонн) песок SiO2 – кизельгур (инфузорная земля), остатки водорослей диатомовых. гранит содержит SiO2
Cлайд 20
 Получение: 1) в лаборатории восстановлением SiO2 магнием. поджигают горящую ленту магния MgO удаляют HCl. 2) в промышленности: SiO2 восстанавливают углеродом в эл. печи. Кремний высокой чистоты готовят восстановлением водородом соединений SiCl4 или разложением SiH4 силана.
Получение: 1) в лаборатории восстановлением SiO2 магнием. поджигают горящую ленту магния MgO удаляют HCl. 2) в промышленности: SiO2 восстанавливают углеродом в эл. печи. Кремний высокой чистоты готовят восстановлением водородом соединений SiCl4 или разложением SiH4 силана.
Cлайд 21
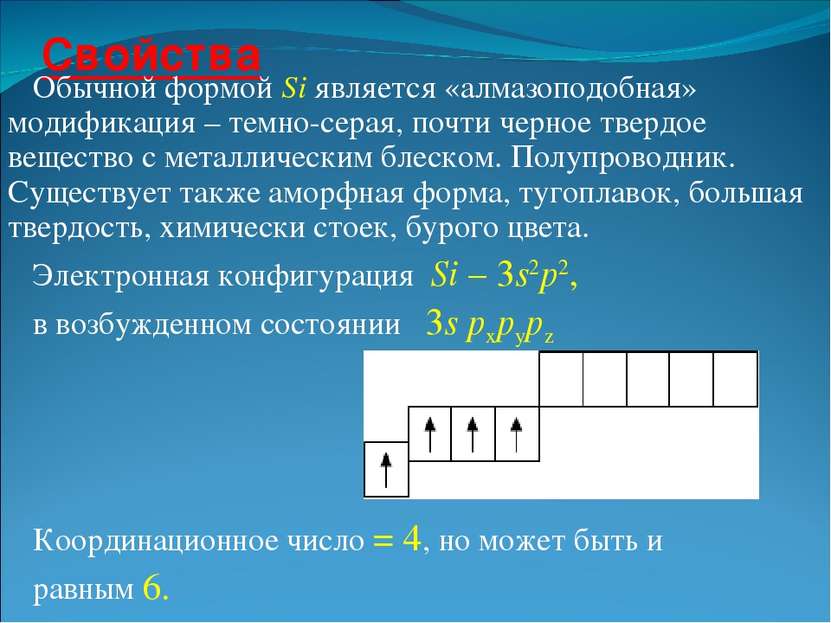
 Свойства Обычной формой Si является «алмазоподобная» модификация – темно-серая, почти черное твердое вещество с металлическим блеском. Полупроводник. Существует также аморфная форма, тугоплавок, большая твердость, химически стоек, бурого цвета. Электронная конфигурация Si – 3s2p2, в возбужденном состоянии 3s pxpypz Координационное число = 4, но может быть и равным 6.
Свойства Обычной формой Si является «алмазоподобная» модификация – темно-серая, почти черное твердое вещество с металлическим блеском. Полупроводник. Существует также аморфная форма, тугоплавок, большая твердость, химически стоек, бурого цвета. Электронная конфигурация Si – 3s2p2, в возбужденном состоянии 3s pxpypz Координационное число = 4, но может быть и равным 6.
Cлайд 22
 По многим свойствам Si похож на бор (диагональное сходство). Оба неметаллы, имеют высокие температуры плавления, образуют кислотные оксиды, ковалентные гидриды и т.д. 1) Si не реагируют с водородом кремневодороды (силаны) получают косвенными методами: Силаны – легколетучие ядовитые вещества, являются сильными восстановителями.
По многим свойствам Si похож на бор (диагональное сходство). Оба неметаллы, имеют высокие температуры плавления, образуют кислотные оксиды, ковалентные гидриды и т.д. 1) Si не реагируют с водородом кремневодороды (силаны) получают косвенными методами: Силаны – легколетучие ядовитые вещества, являются сильными восстановителями.
Cлайд 23
 2) с галогенами силаны реагируют бурно (со взрывом), получаются SiГ4 3) При t˚ Si реагируют с О2, получают SiO2, или SiO при высокой температуре. SiO2 существует в нескольких модификациях: β - кварц α - кварц – обычная форма. При охлаждении SiO2 образуется стекловидная форма. кварц. Стекло На SiO2 не действуют никакие кислоты кроме HF а)
2) с галогенами силаны реагируют бурно (со взрывом), получаются SiГ4 3) При t˚ Si реагируют с О2, получают SiO2, или SiO при высокой температуре. SiO2 существует в нескольких модификациях: β - кварц α - кварц – обычная форма. При охлаждении SiO2 образуется стекловидная форма. кварц. Стекло На SiO2 не действуют никакие кислоты кроме HF а)
Cлайд 24
 б) в) кислотный оксид SiO2 реагирует: В воде хорошо растворимы только силикаты щелочных металлов. Na2SiO3 – при сплавлении образуется жидкое стекло.
б) в) кислотный оксид SiO2 реагирует: В воде хорошо растворимы только силикаты щелочных металлов. Na2SiO3 – при сплавлении образуется жидкое стекло.
Cлайд 25
 Если этот осадок высушить, то при t°, то образуется силикагель SiO2 в виде прозрачных крупинок. Он обладает пористостью и имеет огромную удельную поверхность. Силикагель – широко испол. адсорбент и носитель катализатора. Кремниевые кислоты слабее угольной. Они выпадают в осадок при действии CO2 сильно гидролизуются. H2SiO3 – метакремниевая кислота (силикаты) H4SiO4 – ортокремневая кислота (ортосиликаты) 1) Si реагируют с водой при t° высокой:
Если этот осадок высушить, то при t°, то образуется силикагель SiO2 в виде прозрачных крупинок. Он обладает пористостью и имеет огромную удельную поверхность. Силикагель – широко испол. адсорбент и носитель катализатора. Кремниевые кислоты слабее угольной. Они выпадают в осадок при действии CO2 сильно гидролизуются. H2SiO3 – метакремниевая кислота (силикаты) H4SiO4 – ортокремневая кислота (ортосиликаты) 1) Si реагируют с водой при t° высокой:
Cлайд 26
 2) Si вытесняет из соединений некоторые Me 3) Si реагирует с галогенами 4) с серой образуется SiS2 5) с азотом Si3N4 6) с углеродом SiC (карборунд) при t° 1300°С Известно очень много кремнийорганических веществ. 7) с металлами образует силициды (Mg2Si, FeSi, Cr3Si и т.д.) похожи по свойствам на интерметаллиды
2) Si вытесняет из соединений некоторые Me 3) Si реагирует с галогенами 4) с серой образуется SiS2 5) с азотом Si3N4 6) с углеродом SiC (карборунд) при t° 1300°С Известно очень много кремнийорганических веществ. 7) с металлами образует силициды (Mg2Si, FeSi, Cr3Si и т.д.) похожи по свойствам на интерметаллиды
Cлайд 27
 Применение Si используется для получения сплавов 2-4 % Si увеличивает магнитную проницаемость Si связывает О2 в стали и т.д. Особо чистый кремний применяется для изготовления раб. элементов полупроводниковых устройств (ЭВМ, солнечные батареи и т.д.) Из кварца делают аппаратуру в лабораториях и на производстве.
Применение Si используется для получения сплавов 2-4 % Si увеличивает магнитную проницаемость Si связывает О2 в стали и т.д. Особо чистый кремний применяется для изготовления раб. элементов полупроводниковых устройств (ЭВМ, солнечные батареи и т.д.) Из кварца делают аппаратуру в лабораториях и на производстве.