X
Код презентации скопируйте его
Углерод
Скачать эту презентациюПрезентация на тему Углерод
Скачать эту презентациюCлайд 2
 Цели урока Образовательная -- рассмотрение строения атома, аллотропии углерода; формирование представлений о строении, свойствах и применении алмаза и графита; ознакомление с явлением адсорбции, характеристика физических и химических свойств углерода. Развивающая – установление причинно-следственных связей (строение – свойства – применение). Воспитательная – воспитание культуры общения, культуры труда.
Цели урока Образовательная -- рассмотрение строения атома, аллотропии углерода; формирование представлений о строении, свойствах и применении алмаза и графита; ознакомление с явлением адсорбции, характеристика физических и химических свойств углерода. Развивающая – установление причинно-следственных связей (строение – свойства – применение). Воспитательная – воспитание культуры общения, культуры труда.
Cлайд 3
 +6С )2)4 +14Si )2)8)4 +32Ge )2)8)18)4 +50Sn )2)8)18)18)4 +82Pb )2)8)18)32)18)4 Общая электронная формула внешнего слоя S2 P2 Р - элементы ↑↓ ↑ ↑
+6С )2)4 +14Si )2)8)4 +32Ge )2)8)18)4 +50Sn )2)8)18)18)4 +82Pb )2)8)18)32)18)4 Общая электронная формула внешнего слоя S2 P2 Р - элементы ↑↓ ↑ ↑
Cлайд 4
 Изменение свойств в группе С Si Ge Sn Pb Металлические свойства увеличиваются На внешнем слое 4 электрона, значит, являются неметаллами
Изменение свойств в группе С Si Ge Sn Pb Металлические свойства увеличиваются На внешнем слое 4 электрона, значит, являются неметаллами
Cлайд 5
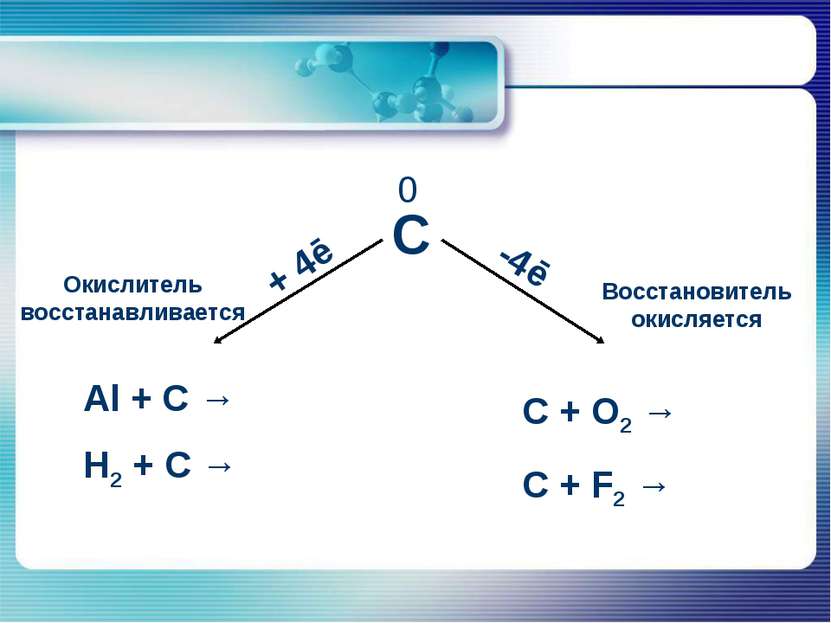
 Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических уровней – 2 Число электронов на последнем уровне – 4 Максимальная степень окисления + 4 Минимальная степень окисления -4 Углерод
Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических уровней – 2 Число электронов на последнем уровне – 4 Максимальная степень окисления + 4 Минимальная степень окисления -4 Углерод
Cлайд 12
 Г Р А Ф И Т Применение графита: Электроды для электролиза Облицовка сопел ракетных двигателей Смазка для трущихся поверхностей, работающих при очень высоких и очень низких температурах Стержни для карандашей Замедлители нейтронов в ядерных реакторах
Г Р А Ф И Т Применение графита: Электроды для электролиза Облицовка сопел ракетных двигателей Смазка для трущихся поверхностей, работающих при очень высоких и очень низких температурах Стержни для карандашей Замедлители нейтронов в ядерных реакторах
Cлайд 13
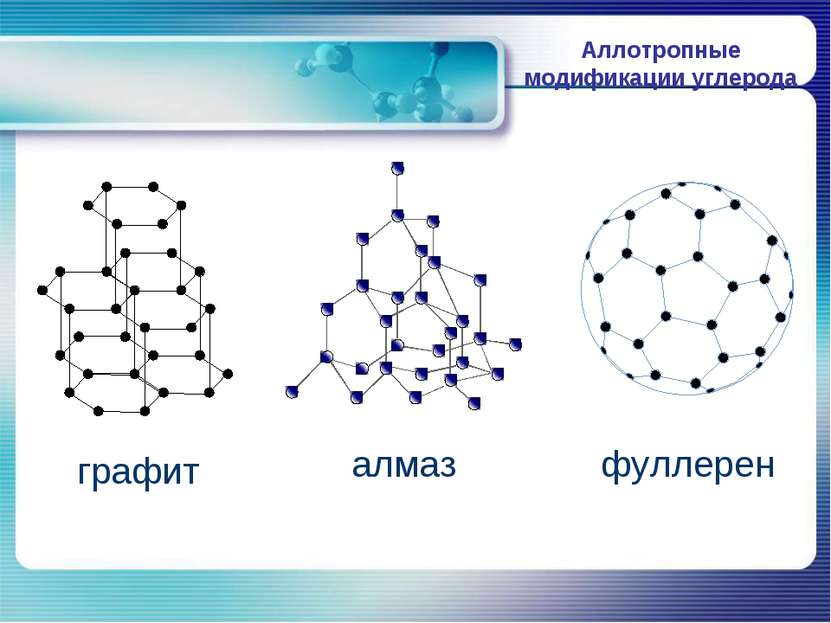
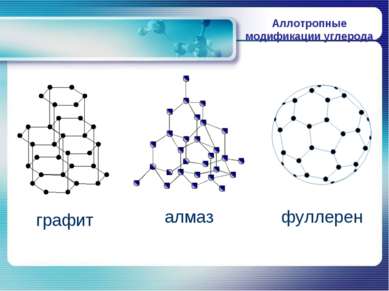
 П О Ч Е М У А Л М А З - очень твердый, Г Р А Ф И Т – очень мягкий ? Кристаллическая решетка алмаза Кристаллическая решетка графита
П О Ч Е М У А Л М А З - очень твердый, Г Р А Ф И Т – очень мягкий ? Кристаллическая решетка алмаза Кристаллическая решетка графита
Cлайд 14
 А Л М А З Алмаз имеет атомную кристаллическую решетку, в которой каждый атом углерода связан с четырьмя атомами. В пространстве эти атомы располагаются в центре и углах тетраэдров, соединенных своими вершинами. Это очень симметричная и прочная решетка.
А Л М А З Алмаз имеет атомную кристаллическую решетку, в которой каждый атом углерода связан с четырьмя атомами. В пространстве эти атомы располагаются в центре и углах тетраэдров, соединенных своими вершинами. Это очень симметричная и прочная решетка.
Cлайд 15
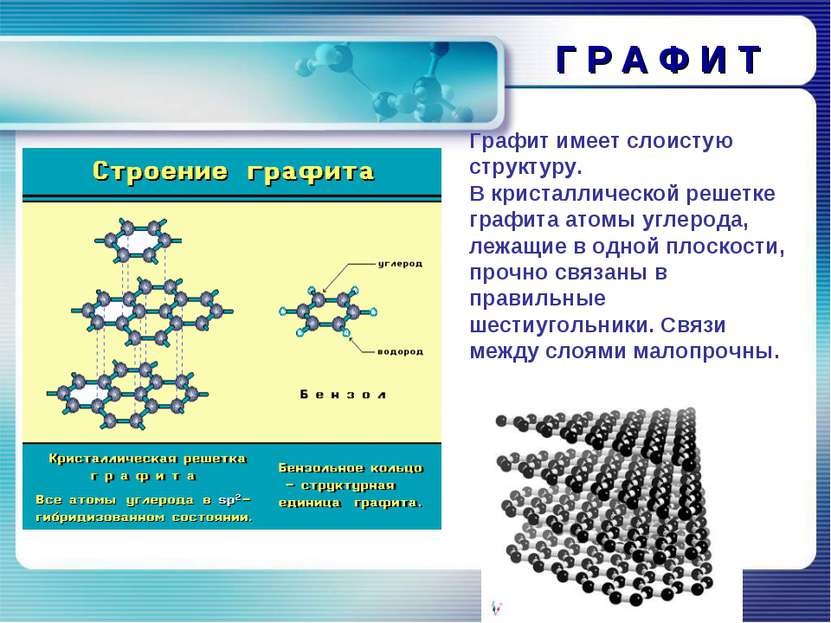
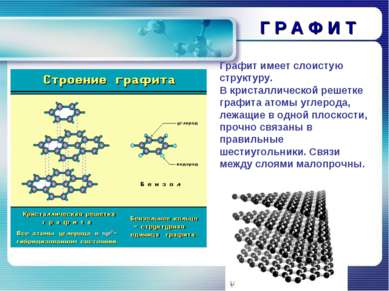 Г Р А Ф И Т Графит имеет слоистую структуру. В кристаллической решетке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями малопрочны.
Г Р А Ф И Т Графит имеет слоистую структуру. В кристаллической решетке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями малопрочны.
Cлайд 16
 Г Р А Ф И Т Сходное с графитом строение имеют: Сажа Древесный уголь Кокс типографская краска, картриджи, резина, косметическая тушь восстановитель при выплавке чугуна из руд твердое топливо, адсорбент для очистки газов и жидкостей
Г Р А Ф И Т Сходное с графитом строение имеют: Сажа Древесный уголь Кокс типографская краска, картриджи, резина, косметическая тушь восстановитель при выплавке чугуна из руд твердое топливо, адсорбент для очистки газов и жидкостей
Cлайд 18
 Угольные фильтры В бытовых фильтрах, в промышленном производстве, на очистных сооружениях – уголь поглощает вредные вещества из воды
Угольные фильтры В бытовых фильтрах, в промышленном производстве, на очистных сооружениях – уголь поглощает вредные вещества из воды
Cлайд 20
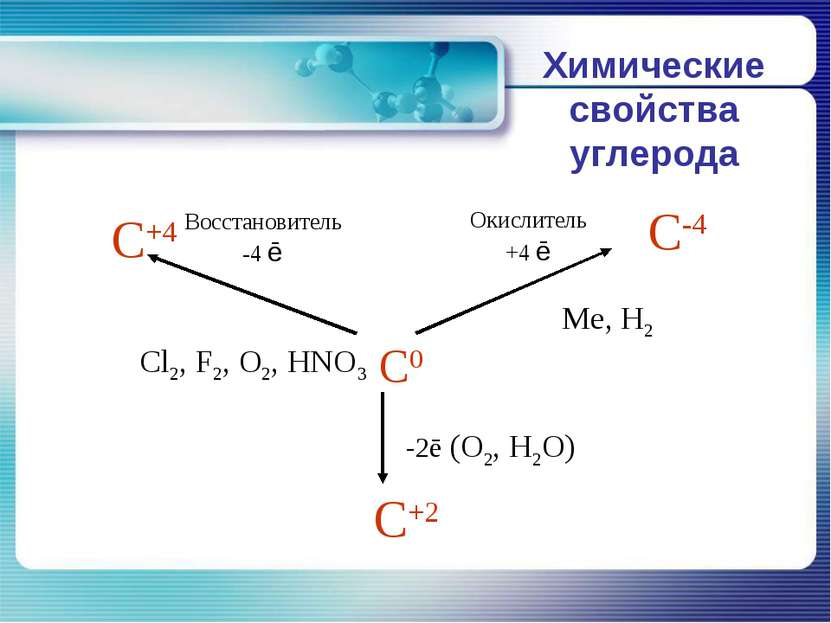
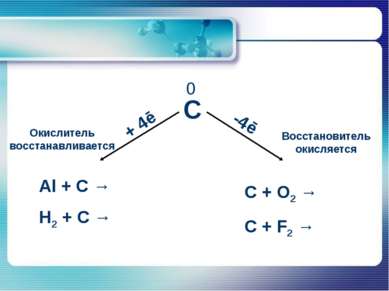
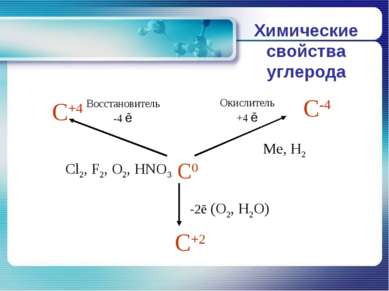
 Химические свойства углерода В реакциях с активными неметаллами углерод легко окисляется: C+O2=CO2 2C+O2=2CO C+2S=CS2 C+2F2=CF4 Углерод может проявлять восстановительные свойства и при взаимодействии со сложными веществами: C+2CuO=2Cu+CО2 C+2H2SO4(конц.)=CO2+2SO2+H2O 2C+BaSO4=BaS+2CO2 В реакциях с металлами и менее активными неметаллами углерод - окислитель: 2C+H2=C2H2 C+Si=SiC 2C+Ca=CaC2 3C+4Al=Al4C3
Химические свойства углерода В реакциях с активными неметаллами углерод легко окисляется: C+O2=CO2 2C+O2=2CO C+2S=CS2 C+2F2=CF4 Углерод может проявлять восстановительные свойства и при взаимодействии со сложными веществами: C+2CuO=2Cu+CО2 C+2H2SO4(конц.)=CO2+2SO2+H2O 2C+BaSO4=BaS+2CO2 В реакциях с металлами и менее активными неметаллами углерод - окислитель: 2C+H2=C2H2 C+Si=SiC 2C+Ca=CaC2 3C+4Al=Al4C3
Cлайд 21
 Т е с т 1. Конфигурация внешнего электронного уровня элементов подгруппы углерода: а) ns2np2 б) ns2np3 в) ns2np4 г) ns1np2 2. Наиболее характерная валентность элементов подгруппы углерода: а) II б) III в) IV г) V 3. Неметаллические свойства элементов подгруппы углерода в группе сверху вниз: а) уменьшаются б) уменьшаются, затем возрастают в) возрастают г) не изменяются 4. Углерод является: а) восстановителем б) восстановителем и окислителем в) окислителем г) не проявляет окислительно-восстановительных свойств 5. Атомную слоистую кристаллическую решетку имеет: а) алмаз б) фуллерен в) графит г) карбин 6. Наибольшей прочностью отличается кристаллическая решетка: а) атомная б) ионная в) атомная слоистая г) молекулярная 7. Наиболее химически активна аллотропная модификация углерода: а) алмаз б) фуллерен в) графит г) карбин
Т е с т 1. Конфигурация внешнего электронного уровня элементов подгруппы углерода: а) ns2np2 б) ns2np3 в) ns2np4 г) ns1np2 2. Наиболее характерная валентность элементов подгруппы углерода: а) II б) III в) IV г) V 3. Неметаллические свойства элементов подгруппы углерода в группе сверху вниз: а) уменьшаются б) уменьшаются, затем возрастают в) возрастают г) не изменяются 4. Углерод является: а) восстановителем б) восстановителем и окислителем в) окислителем г) не проявляет окислительно-восстановительных свойств 5. Атомную слоистую кристаллическую решетку имеет: а) алмаз б) фуллерен в) графит г) карбин 6. Наибольшей прочностью отличается кристаллическая решетка: а) атомная б) ионная в) атомная слоистая г) молекулярная 7. Наиболее химически активна аллотропная модификация углерода: а) алмаз б) фуллерен в) графит г) карбин