X
Код презентации скопируйте его
Углерод
Скачать эту презентациюПрезентация на тему Углерод
Скачать эту презентациюCлайд 1
 Углерод Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Барсуков Д. Б. г. Кемерово
Углерод Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Барсуков Д. Б. г. Кемерово
Cлайд 2
 Строение атома В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы. Углерод (С) — неметалл. Возможные степени окисления: -4; 0; +2; +4. Формулы высшего оксида и гидроксида: СО2 и Н2СО3. Оба соединения проявляют кислотные свойства. 6 Углерод C 12,011 2s22p2
Строение атома В периодической таблице химических элементов углерод (С) расположен во втором периоде, в IV группе главной подгруппы. Углерод (С) — неметалл. Возможные степени окисления: -4; 0; +2; +4. Формулы высшего оксида и гидроксида: СО2 и Н2СО3. Оба соединения проявляют кислотные свойства. 6 Углерод C 12,011 2s22p2
Cлайд 3
 Нахождение в природе Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
Нахождение в природе Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
Cлайд 5
 Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. Графит (от др.-греч. γράφω — пишу) — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью. Плотность 2,08—2,23 г/см³. Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. В кислотах не растворяется. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах). Аллотропия углерода
Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. Графит (от др.-греч. γράφω — пишу) — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью. Плотность 2,08—2,23 г/см³. Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. В кислотах не растворяется. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах). Аллотропия углерода
Cлайд 6
 Аллотропия углерода Алма з (от араб. ألماس , ’almās, тур. elmas, которое идёт через арабск. из др.-греч. ἀδάμας — «несокрушимый») —минерал, кубическая аллотропная форма углерода. Главные отличительные черты алмаза — высочайшая среди минералов твёрдость, наиболее высокая теплопроводность среди всех твёрдых тел. Температура плавления алмаза составляет 3700—4000 °C. На воздухе алмаз сгорает при 850—1000 °C, а в струе чистого кислорода горит слабо-голубым пламенем при 720—800 °C, полностью превращаясь в конечном счёте в углекислый газ. При нагреве до 2000 °C без доступа воздуха алмаз переходит в графит за 15-30 минут
Аллотропия углерода Алма з (от араб. ألماس , ’almās, тур. elmas, которое идёт через арабск. из др.-греч. ἀδάμας — «несокрушимый») —минерал, кубическая аллотропная форма углерода. Главные отличительные черты алмаза — высочайшая среди минералов твёрдость, наиболее высокая теплопроводность среди всех твёрдых тел. Температура плавления алмаза составляет 3700—4000 °C. На воздухе алмаз сгорает при 850—1000 °C, а в струе чистого кислорода горит слабо-голубым пламенем при 720—800 °C, полностью превращаясь в конечном счёте в углекислый газ. При нагреве до 2000 °C без доступа воздуха алмаз переходит в графит за 15-30 минут
Cлайд 7
 Химические свойства Продукты горения углерода в кислороде являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). С + О2=СО2 При реакции углерода с серой получается сероуглерод CS2 С большинством металлов, бором и кремнием углерод образует карбиды, например: 4Al + 3C = Al4C3(карбид алюминия); Ca + 2C = CaC2(карбид кальция). Важна в промышленности реакция углерода с водяным паром: C + H2O = CO + H2
Химические свойства Продукты горения углерода в кислороде являются CO и CO2 (монооксид углерода и диоксид углерода соответственно). С + О2=СО2 При реакции углерода с серой получается сероуглерод CS2 С большинством металлов, бором и кремнием углерод образует карбиды, например: 4Al + 3C = Al4C3(карбид алюминия); Ca + 2C = CaC2(карбид кальция). Важна в промышленности реакция углерода с водяным паром: C + H2O = CO + H2
Cлайд 8
 Применение Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах. Алмаз, благодаря исключительной твёрдости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области.
Применение Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах. Алмаз, благодаря исключительной твёрдости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области.
Cлайд 9
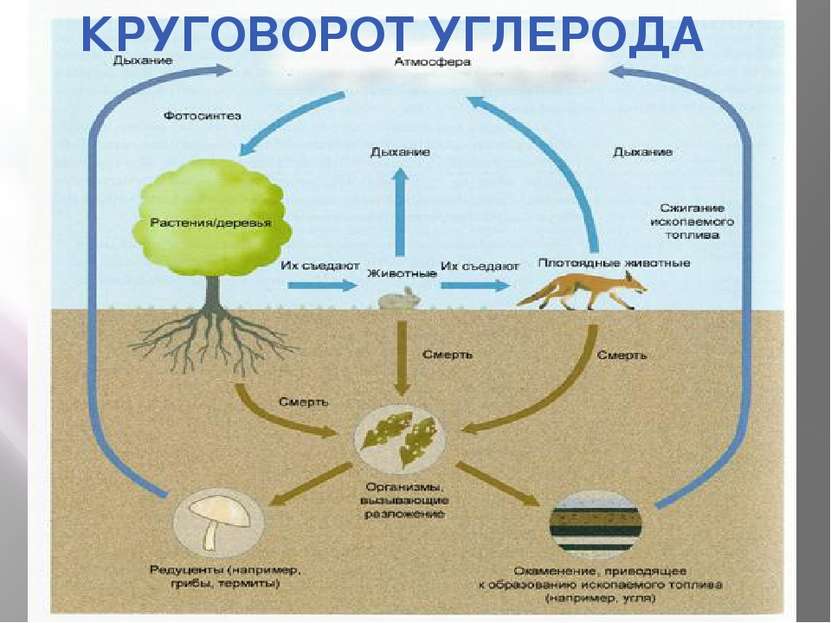
 Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.) Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти. Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человесества.
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.) Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти. Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человесества.