X
Код презентации скопируйте его
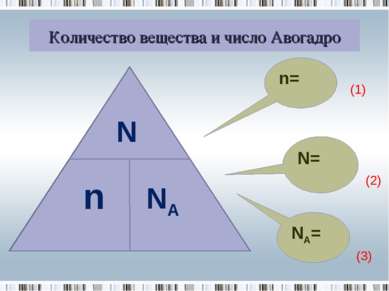
Количество вещества
Скачать эту презентациюПрезентация на тему Количество вещества
Скачать эту презентациюCлайд 1
 Количество вещества Урок изучения нового материала в 8 классе Автор: Ким Н.В. Учитель химии МОУ СОШ №: Г. Нягани ХМАО-Югры Тюменской области Количество вещества
Количество вещества Урок изучения нового материала в 8 классе Автор: Ким Н.В. Учитель химии МОУ СОШ №: Г. Нягани ХМАО-Югры Тюменской области Количество вещества
Cлайд 2
 Расскажу сегодня, что ли, О зловредной роли моли. Моль съедает шерсть и мех – Просто паника у всех…. Ну а в химии – изволь! Есть другое слово “моль” Прост, как небо и трава, Моль любого вещества. Но трудна его дорога: В моле так частичек много!
Расскажу сегодня, что ли, О зловредной роли моли. Моль съедает шерсть и мех – Просто паника у всех…. Ну а в химии – изволь! Есть другое слово “моль” Прост, как небо и трава, Моль любого вещества. Но трудна его дорога: В моле так частичек много!
Cлайд 3
 Моль Моль – это такое количество вещества, в котором содержится 6*10 23 молекул (или других структурных частиц) этого вещества. Например, 1 моль воды имеет массу, равную 18 грамм, так как Мr(Н2О)= 18. Тогда: 1 моль кислорода имеет массу - …, 5 моль алюминия - …., 0,1 моль натрия - ….. .
Моль Моль – это такое количество вещества, в котором содержится 6*10 23 молекул (или других структурных частиц) этого вещества. Например, 1 моль воды имеет массу, равную 18 грамм, так как Мr(Н2О)= 18. Тогда: 1 моль кислорода имеет массу - …, 5 моль алюминия - …., 0,1 моль натрия - ….. .
Cлайд 4
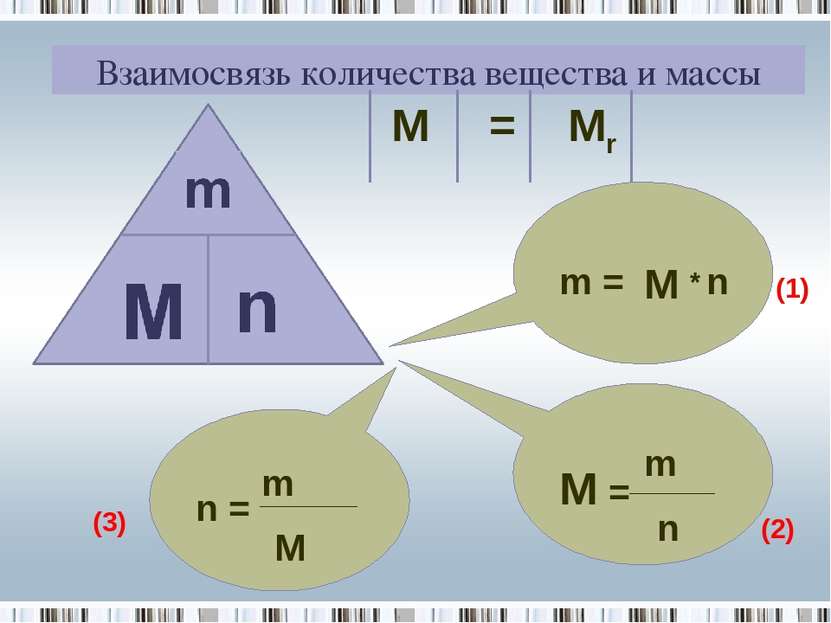
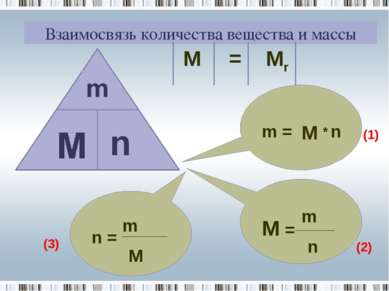
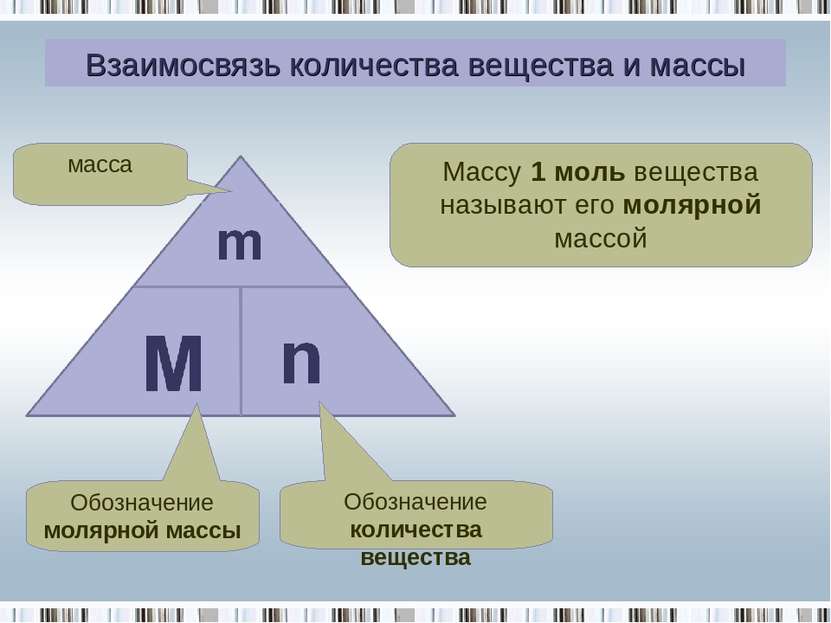
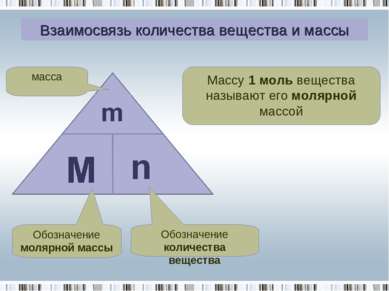 Взаимосвязь количества вещества и массы Массу 1 моль вещества называют его молярной массой Обозначение молярной массы Обозначение количества вещества масса
Взаимосвязь количества вещества и массы Массу 1 моль вещества называют его молярной массой Обозначение молярной массы Обозначение количества вещества масса
Cлайд 5
![Единицы измерения [ М] – г/моль, [ m] – г, кг/кмоль, кг, мг/ммоль. мг. [ n] –... Единицы измерения [ М] – г/моль, [ m] – г, кг/кмоль, кг, мг/ммоль. мг. [ n] –...](https://bigslide.ru/images/53/52472/389/img4.jpg) Единицы измерения [ М] – г/моль, [ m] – г, кг/кмоль, кг, мг/ммоль. мг. [ n] –моль, кмоль, ммоль.
Единицы измерения [ М] – г/моль, [ m] – г, кг/кмоль, кг, мг/ммоль. мг. [ n] –моль, кмоль, ммоль.
Cлайд 7
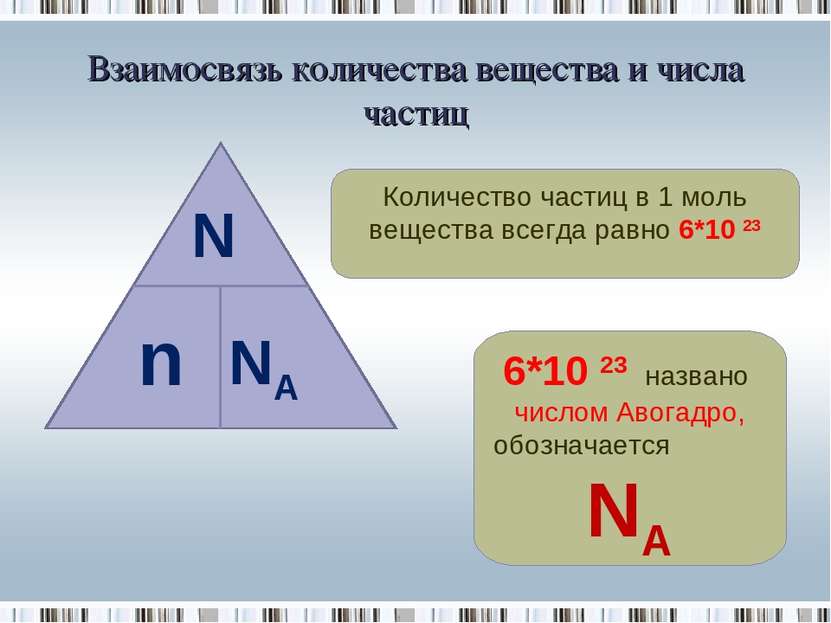
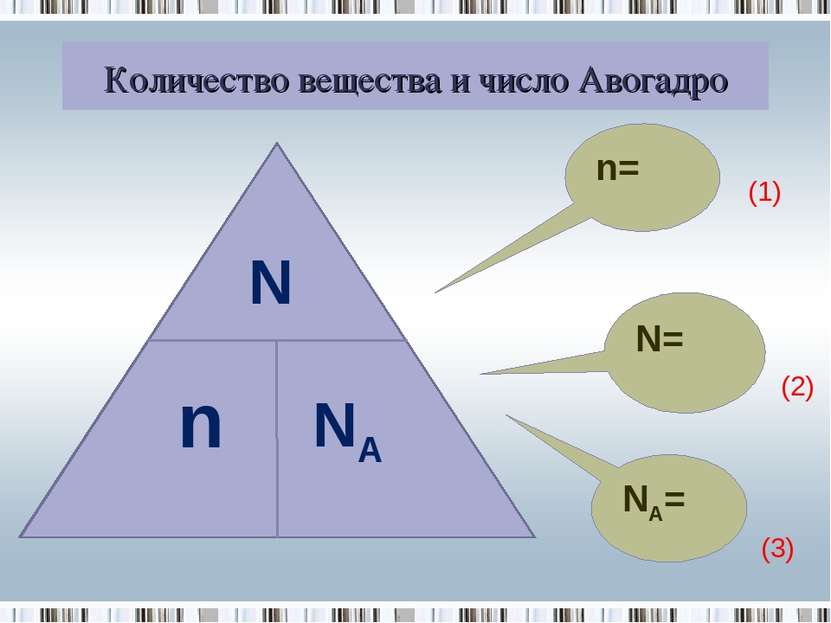
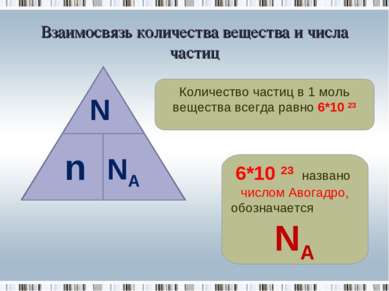 Взаимосвязь количества вещества и числа частиц Количество частиц в 1 моль вещества всегда равно 6*10 23 6*10 23 названо числом Авогадро, обозначается NA
Взаимосвязь количества вещества и числа частиц Количество частиц в 1 моль вещества всегда равно 6*10 23 6*10 23 названо числом Авогадро, обозначается NA
Cлайд 8
 Куча песка, засыпавшая большой завод, содержит песчинок в 22400 раз меньше, чем число частиц в 1 моль вещества (например, в чайной ложке воды, массой 18 г.
Куча песка, засыпавшая большой завод, содержит песчинок в 22400 раз меньше, чем число частиц в 1 моль вещества (например, в чайной ложке воды, массой 18 г.
Cлайд 10
 Число Авогадро - NA Некоторое представление о величине числа Авогадро даёт следующий пример. Количество воды, которое низвергается с ниагарского водопада (США) – при длине 1279 м и высоте 40 м - составляет 6500 м3/с. В капле воды содержится больше молекул, чем капель, упавших с Ниагарского водопада за 400 лет при условии постоянного полноводья.
Число Авогадро - NA Некоторое представление о величине числа Авогадро даёт следующий пример. Количество воды, которое низвергается с ниагарского водопада (США) – при длине 1279 м и высоте 40 м - составляет 6500 м3/с. В капле воды содержится больше молекул, чем капель, упавших с Ниагарского водопада за 400 лет при условии постоянного полноводья.




![Единицы измерения [ М] – г/моль, [ m] – г, кг/кмоль, кг, мг/ммоль. мг. [ n] –... Единицы измерения [ М] – г/моль, [ m] – г, кг/кмоль, кг, мг/ммоль. мг. [ n] –...](https://bigslide.ru/images/53/52472/831/img4.jpg)