X
Код презентации скопируйте его
Степень окисления
Скачать эту презентациюПрезентация на тему Степень окисления
Скачать эту презентациюCлайд 1
 Степень окисления Автор Акимова Ольга Васильевна учитель химии, высшая квалификационная категория МАОУ Барыбинская СОШ г.Домодедово, Московской области
Степень окисления Автор Акимова Ольга Васильевна учитель химии, высшая квалификационная категория МАОУ Барыбинская СОШ г.Домодедово, Московской области
Cлайд 2
 Цель урока: Разобраться, что такое «степень окисления» Научиться находить степень окисления по формуле
Цель урока: Разобраться, что такое «степень окисления» Научиться находить степень окисления по формуле
Cлайд 3
 Поваренная соль NaCl «Хлеб да соль» - пожелание добра «Надо вместе съесть пуд соли, чтобы узнать человека» За какое время это можно сделать? Пуд – 16 кг 3,5 – 5,5 кг в год Примерно 2 года
Поваренная соль NaCl «Хлеб да соль» - пожелание добра «Надо вместе съесть пуд соли, чтобы узнать человека» За какое время это можно сделать? Пуд – 16 кг 3,5 – 5,5 кг в год Примерно 2 года
Cлайд 4
 Влияние Na на организм человека Хранят простое вещество «натрий» как Кощееву смерть. Как может повлиять натрий на организм человека?
Влияние Na на организм человека Хранят простое вещество «натрий» как Кощееву смерть. Как может повлиять натрий на организм человека?
Cлайд 5
 Влияние Cl2 на организм человека Хлор – отравляющее вещество, применявшееся во время первой мировой войны
Влияние Cl2 на организм человека Хлор – отравляющее вещество, применявшееся во время первой мировой войны
Cлайд 6
 Образование сложного вещества Na0 +11 2е,8е,1е Cl0 +17 2e,8e,7e Какой вид связи может образоваться между этими атомами? Na0 + Cl0 → Na+ + Cl- → Na+Cl-
Образование сложного вещества Na0 +11 2е,8е,1е Cl0 +17 2e,8e,7e Какой вид связи может образоваться между этими атомами? Na0 + Cl0 → Na+ + Cl- → Na+Cl-
Cлайд 7
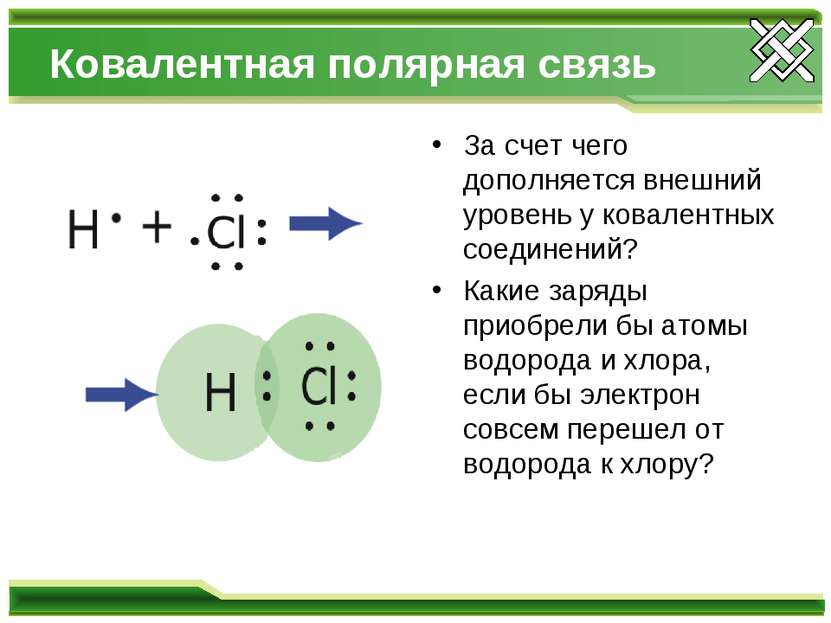
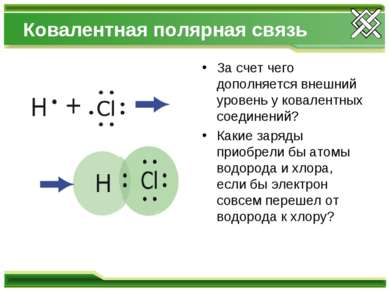 Ковалентная полярная связь За счет чего дополняется внешний уровень у ковалентных соединений? Какие заряды приобрели бы атомы водорода и хлора, если бы электрон совсем перешел от водорода к хлору?
Ковалентная полярная связь За счет чего дополняется внешний уровень у ковалентных соединений? Какие заряды приобрели бы атомы водорода и хлора, если бы электрон совсем перешел от водорода к хлору?
Cлайд 8
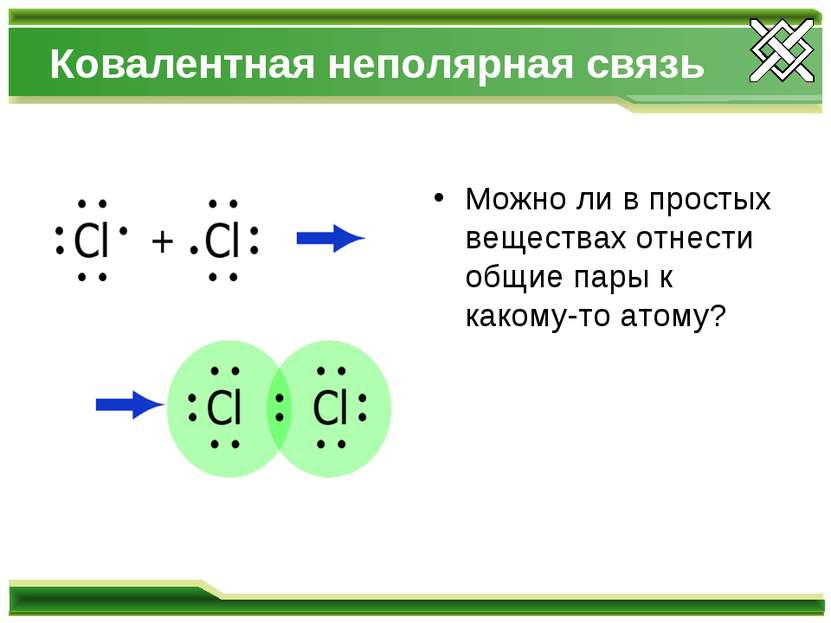
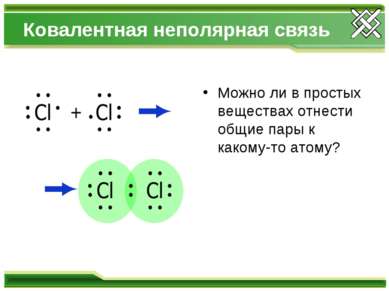 Ковалентная неполярная связь Можно ли в простых веществах отнести общие пары к какому-то атому?
Ковалентная неполярная связь Можно ли в простых веществах отнести общие пары к какому-то атому?
Cлайд 9
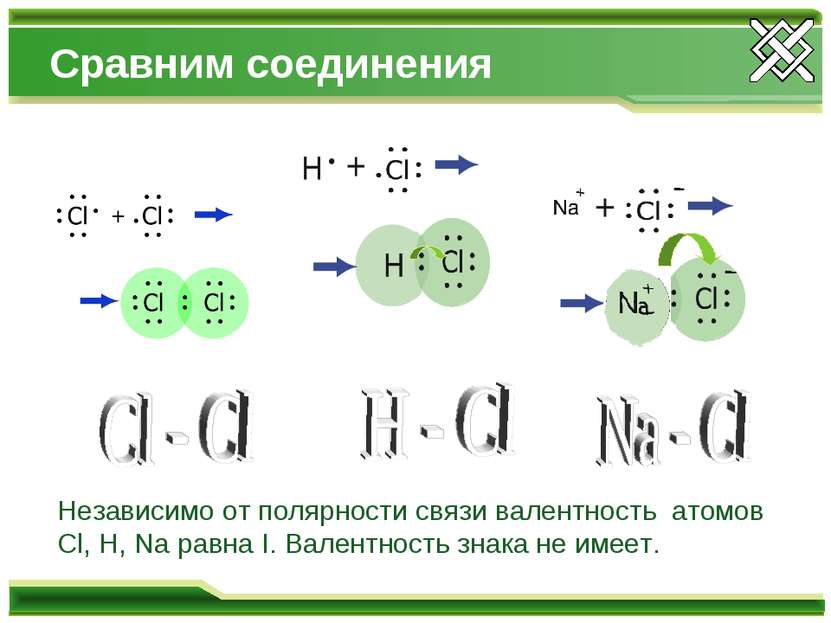
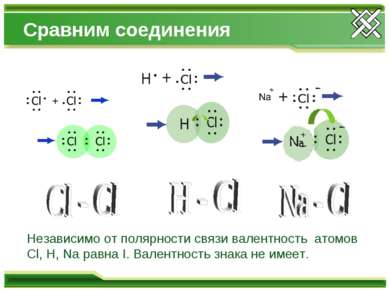 Сравним соединения Независимо от полярности связи валентность атомов Cl, H, Na равна I. Валентность знака не имеет.
Сравним соединения Независимо от полярности связи валентность атомов Cl, H, Na равна I. Валентность знака не имеет.
Cлайд 10
 Степень окисления – это условный заряд атомов химических элементов в соединении, вычисленный на основе предположения, что все соединения состоят из ионов
Степень окисления – это условный заряд атомов химических элементов в соединении, вычисленный на основе предположения, что все соединения состоят из ионов
Cлайд 11
 Правила определения с.о. С.о. атомов в простых веществах = 0 С.о. фтора = -1 С.о. кислорода = -2 (кроме Н2О2-1, O+2F2) С.о. водорода = +1 (кроме МеН-1) С.о.Ме I, II, III групп = номеру группы С.о неМе «+» = номеру группы С.о. неМе «-» = 8 – номер группы
Правила определения с.о. С.о. атомов в простых веществах = 0 С.о. фтора = -1 С.о. кислорода = -2 (кроме Н2О2-1, O+2F2) С.о. водорода = +1 (кроме МеН-1) С.о.Ме I, II, III групп = номеру группы С.о неМе «+» = номеру группы С.о. неМе «-» = 8 – номер группы
Cлайд 12
 Возможные с.о. Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру группы Отрицательная «-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
Возможные с.о. Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру группы Отрицательная «-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
Cлайд 13
 Промежуточные с.о. Рассмотрим возможные с.о. серы – S Максимальная +6 SO3 Минимальная -2 H2S Сера может проявлять с.о. 0,+2,+4 – это промежуточные с.о.
Промежуточные с.о. Рассмотрим возможные с.о. серы – S Максимальная +6 SO3 Минимальная -2 H2S Сера может проявлять с.о. 0,+2,+4 – это промежуточные с.о.