X
Код презентации скопируйте его
Соединения азота
Скачать эту презентациюПрезентация на тему Соединения азота
Скачать эту презентациюCлайд 1
 соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю.
соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю.
Cлайд 2
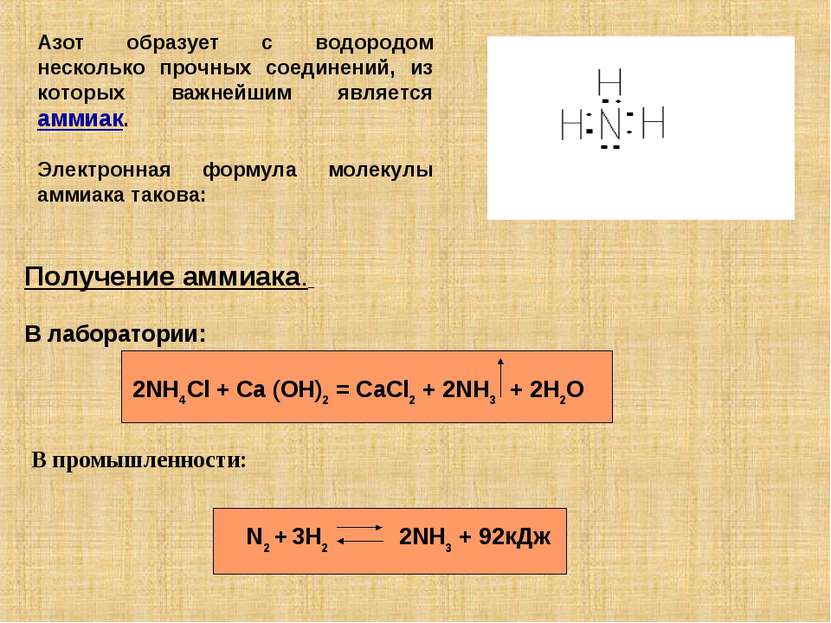
 Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова: Получение аммиака. В лаборатории: 2NH4Cl + Ca (OH)2 = CaCl2 + 2NH3 + 2H2O В промышленности: N2 + 3H2 2NH3 + 92кДж
Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова: Получение аммиака. В лаборатории: 2NH4Cl + Ca (OH)2 = CaCl2 + 2NH3 + 2H2O В промышленности: N2 + 3H2 2NH3 + 92кДж
Cлайд 3
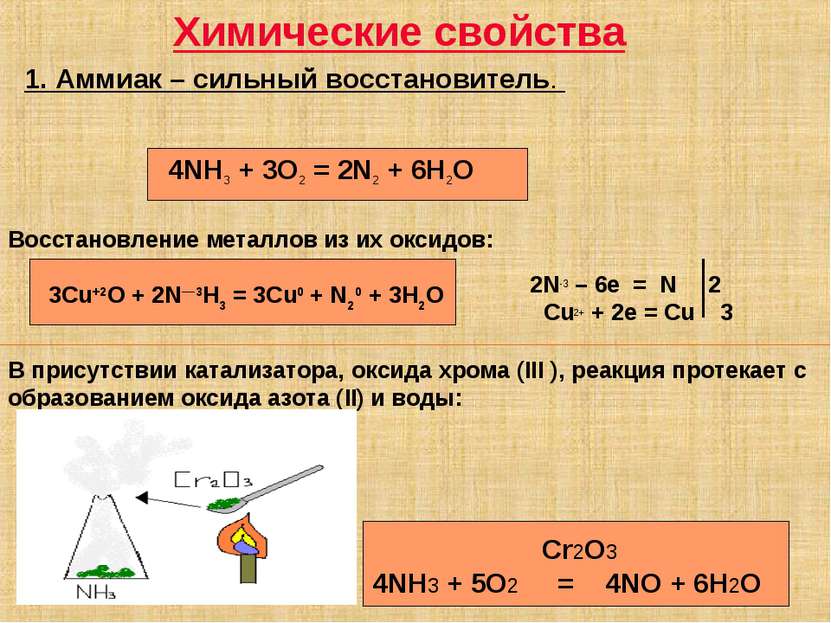
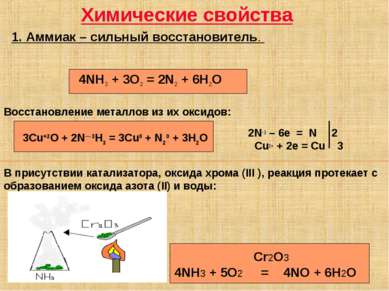 Химические свойства 1. Аммиак – сильный восстановитель. 3Cu+2O + 2N—3H3 = 3Cu0 + N20 + 3H2O 2N-3 – 6e = N 2 Cu2+ + 2e = Cu 3 4NH3 + 3O2 = 2N2 + 6H2O В присутствии катализатора, оксида хрома (III ), реакция протекает с образованием оксида азота (II) и воды: Cr2O3 4NH3 + 5O2 = 4NO + 6H2O Восстановление металлов из их оксидов:
Химические свойства 1. Аммиак – сильный восстановитель. 3Cu+2O + 2N—3H3 = 3Cu0 + N20 + 3H2O 2N-3 – 6e = N 2 Cu2+ + 2e = Cu 3 4NH3 + 3O2 = 2N2 + 6H2O В присутствии катализатора, оксида хрома (III ), реакция протекает с образованием оксида азота (II) и воды: Cr2O3 4NH3 + 5O2 = 4NO + 6H2O Восстановление металлов из их оксидов:
Cлайд 4
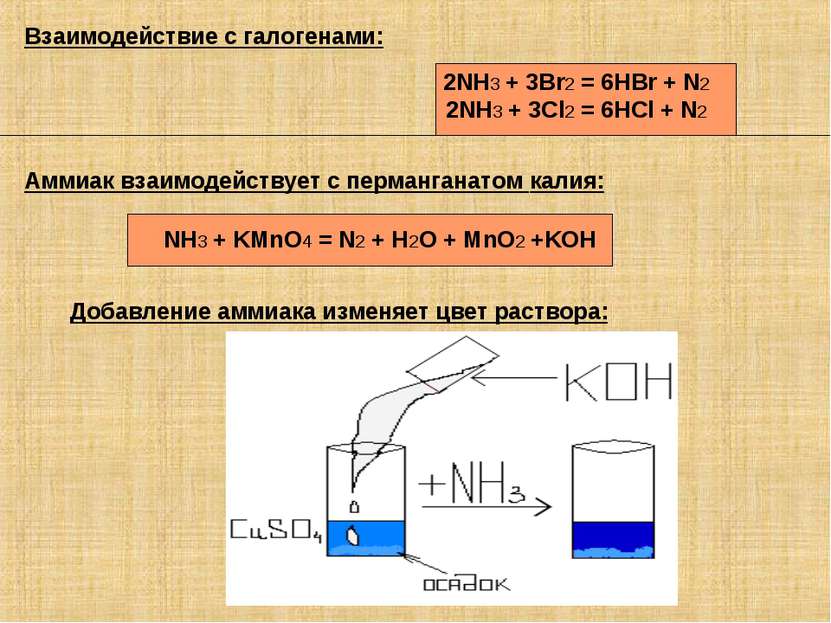
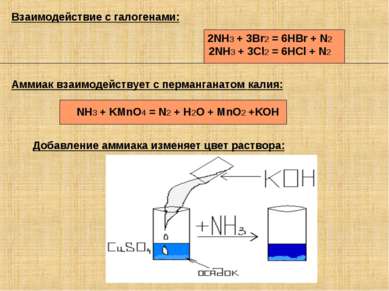 Аммиак взаимодействует с перманганатом калия: NH3 + KMnO4 = N2 + H2O + MnO2 +KOH Взаимодействие с галогенами: 2NH3 + 3Br2 = 6HBr + N2 2NH3 + 3Cl2 = 6HCl + N2 Добавление аммиака изменяет цвет раствора:
Аммиак взаимодействует с перманганатом калия: NH3 + KMnO4 = N2 + H2O + MnO2 +KOH Взаимодействие с галогенами: 2NH3 + 3Br2 = 6HBr + N2 2NH3 + 3Cl2 = 6HCl + N2 Добавление аммиака изменяет цвет раствора:
Cлайд 5
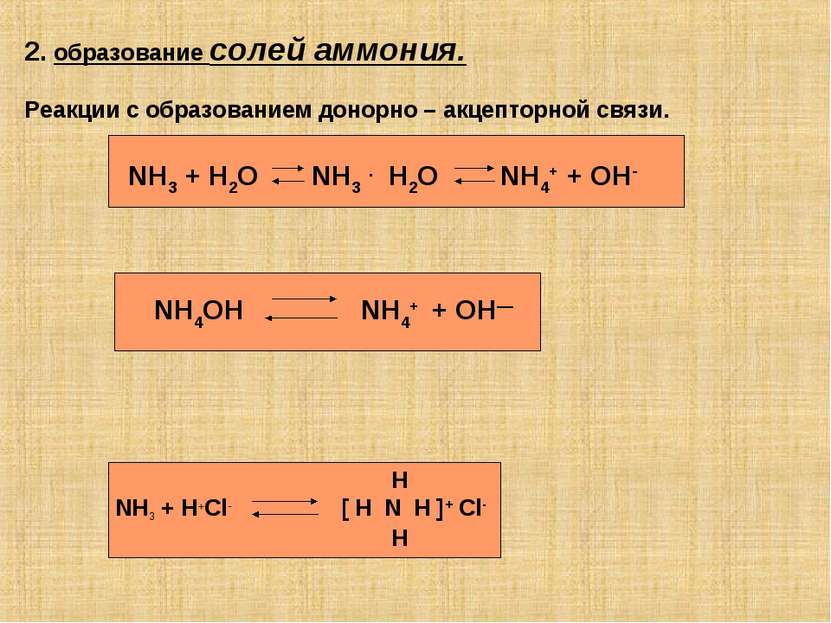
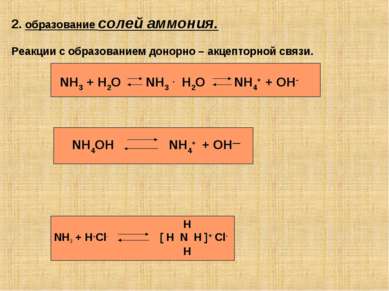 2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH3 + H2O NH3 . H2O NH4+ + OH- NH4OH NH4+ + OH— Н NH3 + H+Cl- [ H N H ]+ Cl- H
2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH3 + H2O NH3 . H2O NH4+ + OH- NH4OH NH4+ + OH— Н NH3 + H+Cl- [ H N H ]+ Cl- H
Cлайд 6
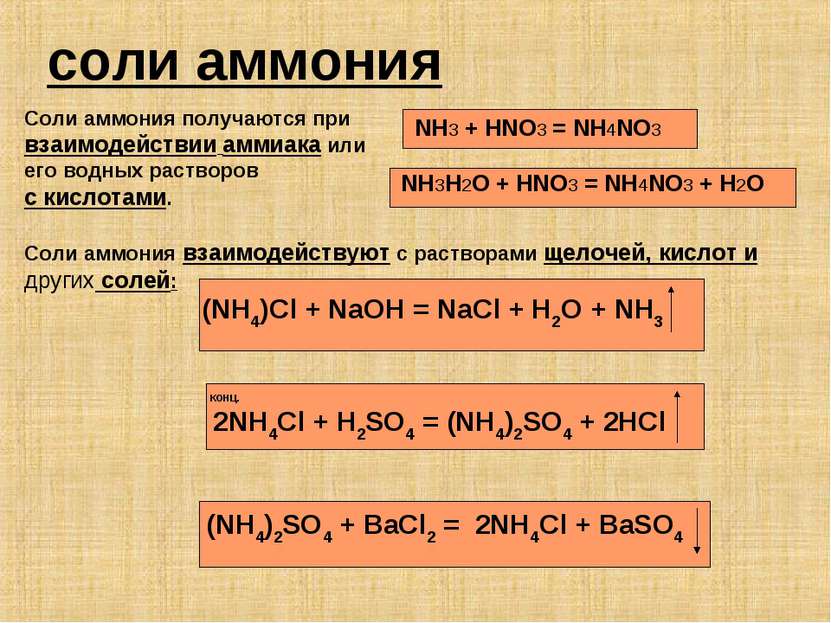
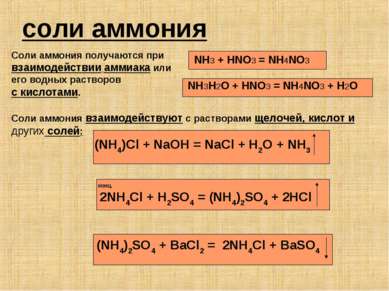 соли аммония Соли аммония получаются при взаимодействии аммиака или его водных растворов с кислотами. NH3 + HNO3 = NH4NO3 NH3H2O + HNO3 = NH4NO3 + H2O Соли аммония взаимодействуют с растворами щелочей, кислот и других солей: (NH4)Cl + NaOH = NaCl + H2O + NH3 КОНЦ. 2NH4Cl + H2SO4 = (NH4)2SO4 + 2HCl (NH4)2SO4 + BaCl2 = 2NH4Cl + BaSO4
соли аммония Соли аммония получаются при взаимодействии аммиака или его водных растворов с кислотами. NH3 + HNO3 = NH4NO3 NH3H2O + HNO3 = NH4NO3 + H2O Соли аммония взаимодействуют с растворами щелочей, кислот и других солей: (NH4)Cl + NaOH = NaCl + H2O + NH3 КОНЦ. 2NH4Cl + H2SO4 = (NH4)2SO4 + 2HCl (NH4)2SO4 + BaCl2 = 2NH4Cl + BaSO4
Cлайд 7
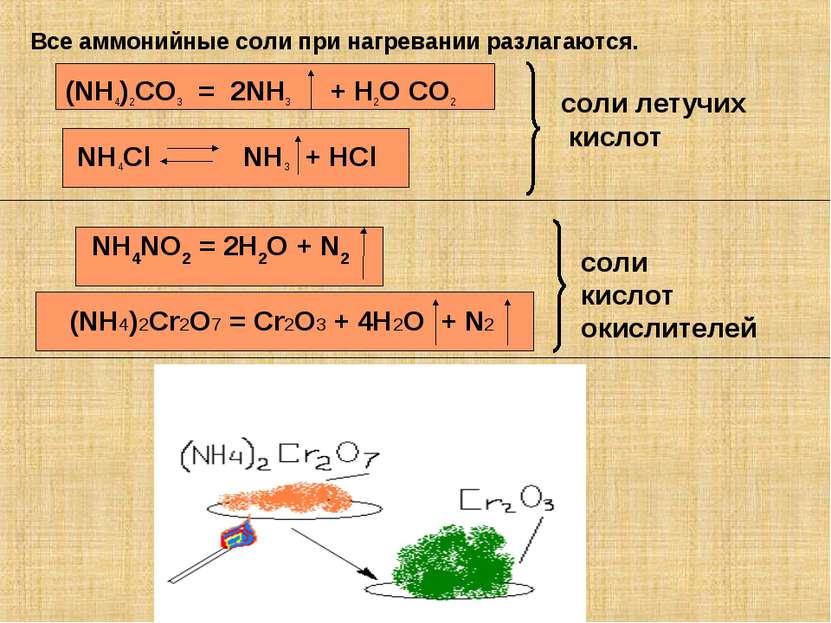
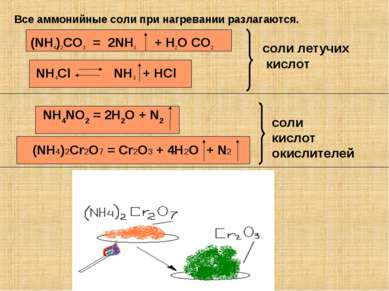 Все аммонийные соли при нагревании разлагаются. (NH4)2CO3 = 2NH3 + H2O CO2 NH4NO2 = 2H2O + N2 NH4Cl NH3 + HCl (NH4)2Cr2O7 = Cr2O3 + 4H2O + N2 соли летучих кислот соли кислот окислителей
Все аммонийные соли при нагревании разлагаются. (NH4)2CO3 = 2NH3 + H2O CO2 NH4NO2 = 2H2O + N2 NH4Cl NH3 + HCl (NH4)2Cr2O7 = Cr2O3 + 4H2O + N2 соли летучих кислот соли кислот окислителей
Cлайд 8
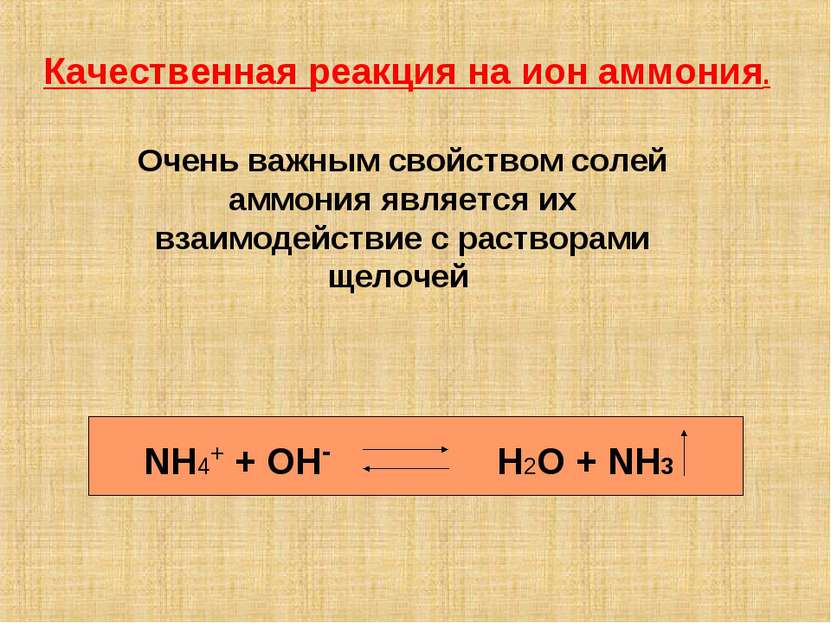
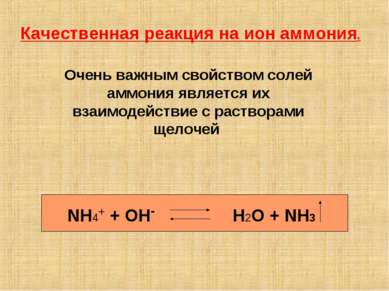 Качественная реакция на ион аммония. NH4+ + OH- H2O + NH3 Очень важным свойством солей аммония является их взаимодействие с растворами щелочей
Качественная реакция на ион аммония. NH4+ + OH- H2O + NH3 Очень важным свойством солей аммония является их взаимодействие с растворами щелочей
Cлайд 9
 Оксиды азота. Азот образует шесть кислородных соединений. степени окисления +1 N2O +2 NO +3 N2O3 +4 NO2, N2O4 +5 N2O5
Оксиды азота. Азот образует шесть кислородных соединений. степени окисления +1 N2O +2 NO +3 N2O3 +4 NO2, N2O4 +5 N2O5
Cлайд 10
 N2O Получение: NH4NO = N2O +2H2O Химические свойства: 1. разложение при нагревании 2N2+1O = 2N20+O2 2. с водородом N2+1O +H2 = N20 +H2O несолеобразующий +1
N2O Получение: NH4NO = N2O +2H2O Химические свойства: 1. разложение при нагревании 2N2+1O = 2N20+O2 2. с водородом N2+1O +H2 = N20 +H2O несолеобразующий +1
Cлайд 11
 NO +2 Получение: 1. В природе: N2 + O2 = 2NO 2. В промышленности: 4NH3 + 5O2 = 4NO +6H2O Химические свойства: 1. легко окисляется: 2N+2O + O2 = 2N+4O2 2. окислитель: 2N+2O + 2SO2 = 2SO3 +N20 несолеобразующий
NO +2 Получение: 1. В природе: N2 + O2 = 2NO 2. В промышленности: 4NH3 + 5O2 = 4NO +6H2O Химические свойства: 1. легко окисляется: 2N+2O + O2 = 2N+4O2 2. окислитель: 2N+2O + 2SO2 = 2SO3 +N20 несолеобразующий
Cлайд 12
 N2O3 +3 Химические свойства: NO2 + NO N2O3 Получение: ВСЕ свойства кислотных оксидов. кислотный оксид
N2O3 +3 Химические свойства: NO2 + NO N2O3 Получение: ВСЕ свойства кислотных оксидов. кислотный оксид
Cлайд 13
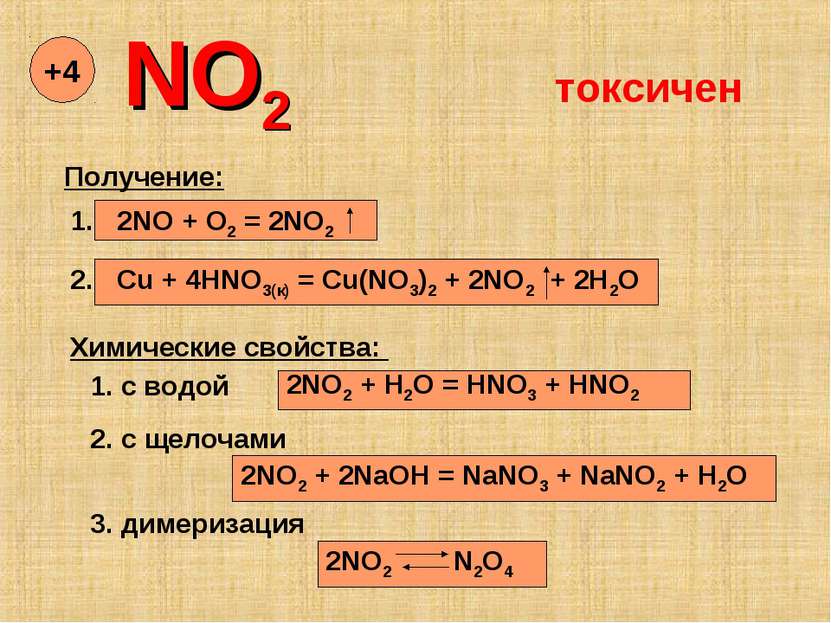
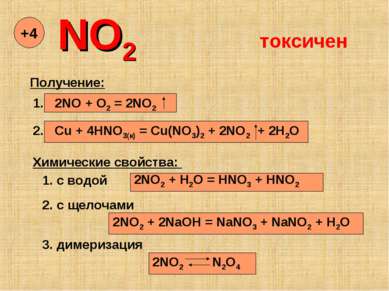 NO2 +4 Получение: 1. 2NO + O2 = 2NO2 2. Cu + 4HNO3(к) = Cu(NO3)2 + 2NO2 + 2H2O Химические свойства: 1. с водой 2NO2 + H2O = HNO3 + HNO2 2. с щелочами 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O 3. димеризация 2NO2 N2O4 токсичен
NO2 +4 Получение: 1. 2NO + O2 = 2NO2 2. Cu + 4HNO3(к) = Cu(NO3)2 + 2NO2 + 2H2O Химические свойства: 1. с водой 2NO2 + H2O = HNO3 + HNO2 2. с щелочами 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O 3. димеризация 2NO2 N2O4 токсичен
Cлайд 14
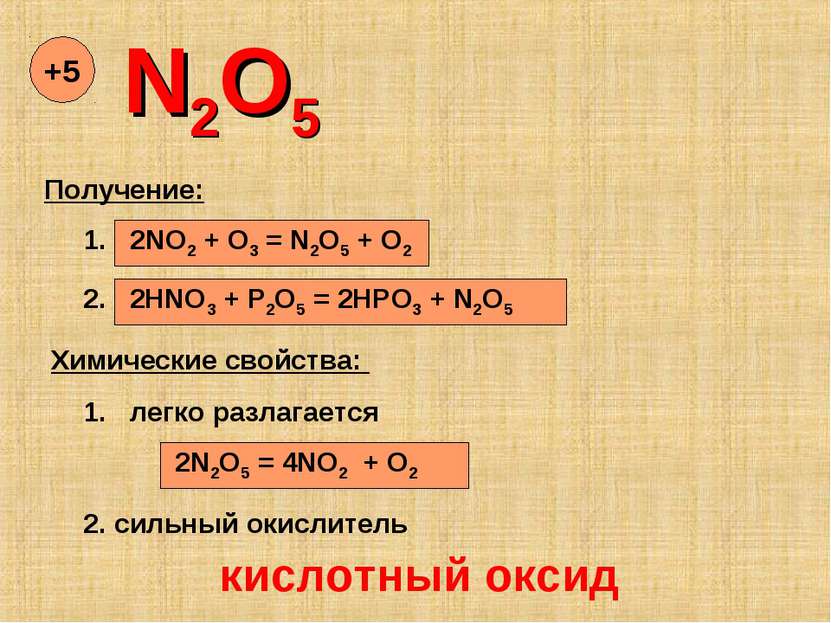
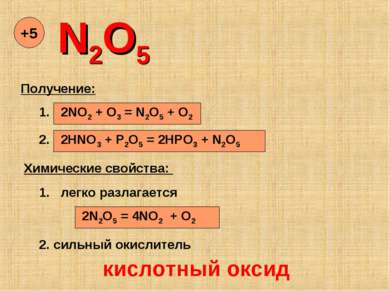 N2O5 +5 Получение: 1. 2NO2 + O3 = N2O5 + O2 2. 2HNO3 + P2O5 = 2HPO3 + N2O5 Химические свойства: 1. легко разлагается 2N2O5 = 4NO2 + O2 2. сильный окислитель кислотный оксид
N2O5 +5 Получение: 1. 2NO2 + O3 = N2O5 + O2 2. 2HNO3 + P2O5 = 2HPO3 + N2O5 Химические свойства: 1. легко разлагается 2N2O5 = 4NO2 + O2 2. сильный окислитель кислотный оксид
Cлайд 15
 Азотная кислота. Получение азотной кислоты: KNO3 + H2SO4 = HNO3 + KHSO4 В лаборатории, при слабом нагревании: В промышленности процесс получения азотной кислоты можно разбить на три этапа: 1.Окисление аммиака на платиновом катализаторе до NO: 4NH3 + 5O2 = 4NO +6H2O 2.Окисление кислородом воздуха NO до NO2: 2NO + O2 =2NO2 3.Поглощение NO2 водой в присутствии избытка кислорода: 4NO2 + 2H2O + O2 = 4HNO3
Азотная кислота. Получение азотной кислоты: KNO3 + H2SO4 = HNO3 + KHSO4 В лаборатории, при слабом нагревании: В промышленности процесс получения азотной кислоты можно разбить на три этапа: 1.Окисление аммиака на платиновом катализаторе до NO: 4NH3 + 5O2 = 4NO +6H2O 2.Окисление кислородом воздуха NO до NO2: 2NO + O2 =2NO2 3.Поглощение NO2 водой в присутствии избытка кислорода: 4NO2 + 2H2O + O2 = 4HNO3
Cлайд 16
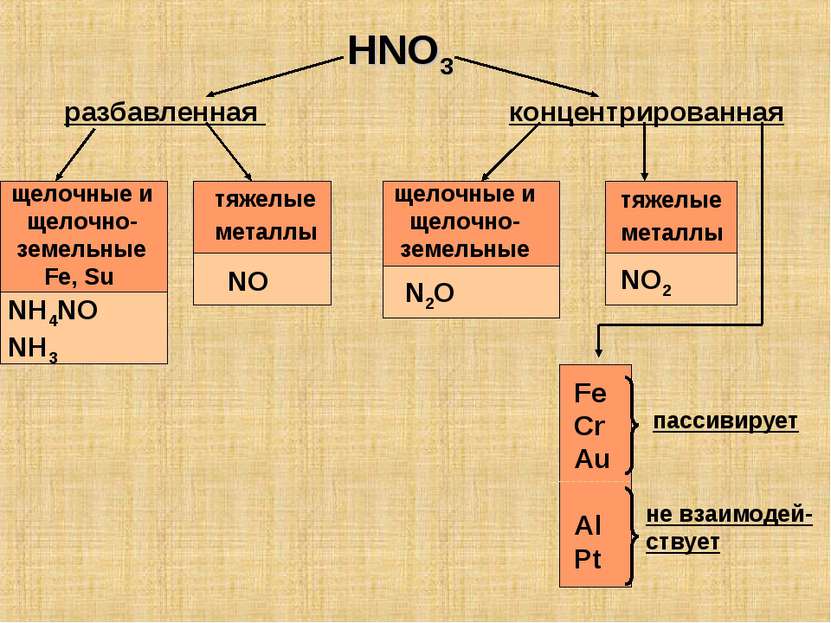
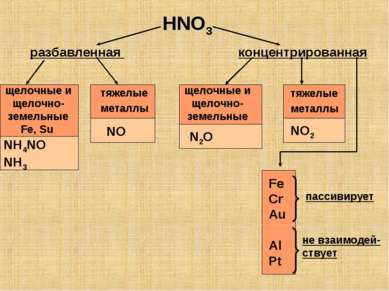 HNO3 разбавленная концентрированная щелочные и щелочно-земельные Fe, Su тяжелые металлы NH4NO NH3 NO щелочные и щелочно-земельные тяжелые металлы N2O NO2 Fe Cr Au Al Pt пассивирует не взаимодей- ствует
HNO3 разбавленная концентрированная щелочные и щелочно-земельные Fe, Su тяжелые металлы NH4NO NH3 NO щелочные и щелочно-земельные тяжелые металлы N2O NO2 Fe Cr Au Al Pt пассивирует не взаимодей- ствует
Cлайд 17
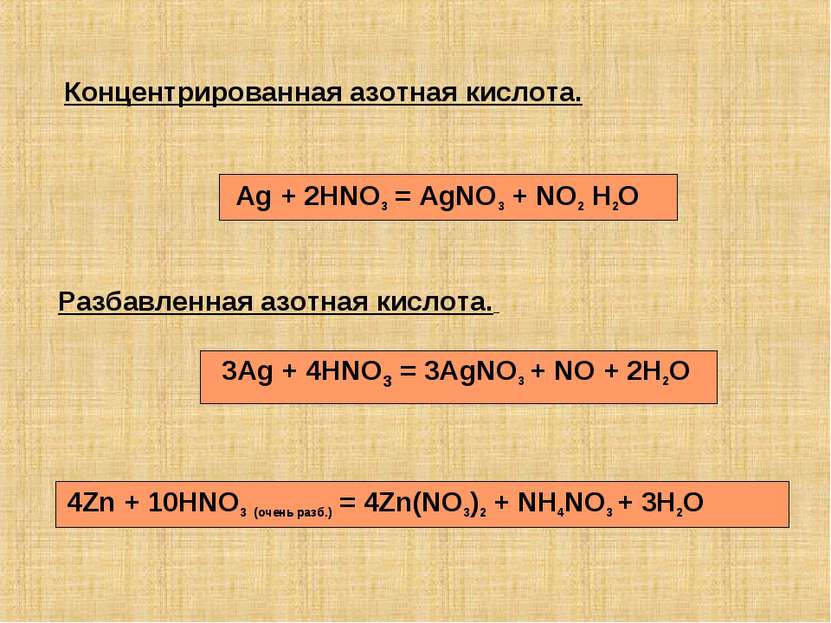
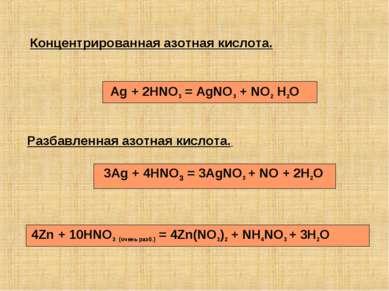 Разбавленная азотная кислота. Концентрированная азотная кислота. Ag + 2HNO3 = AgNO3 + NO2 H2O 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O 4Zn + 10HNO3 (очень разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Разбавленная азотная кислота. Концентрированная азотная кислота. Ag + 2HNO3 = AgNO3 + NO2 H2O 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O 4Zn + 10HNO3 (очень разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Cлайд 18
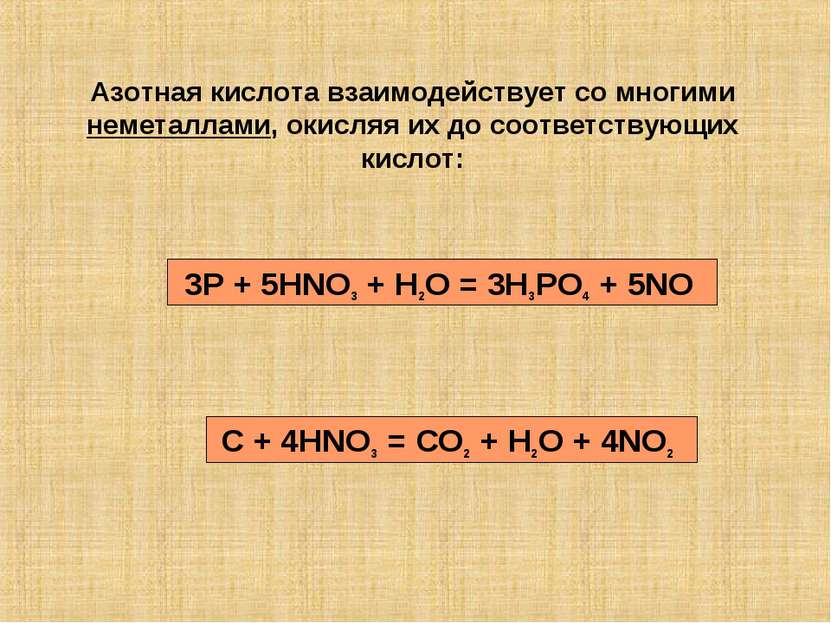
 Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот: 3P + 5HNO3 + H2O = 3H3PO4 + 5NO C + 4HNO3 = CO2 + H2O + 4NO2
Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот: 3P + 5HNO3 + H2O = 3H3PO4 + 5NO C + 4HNO3 = CO2 + H2O + 4NO2
Cлайд 19
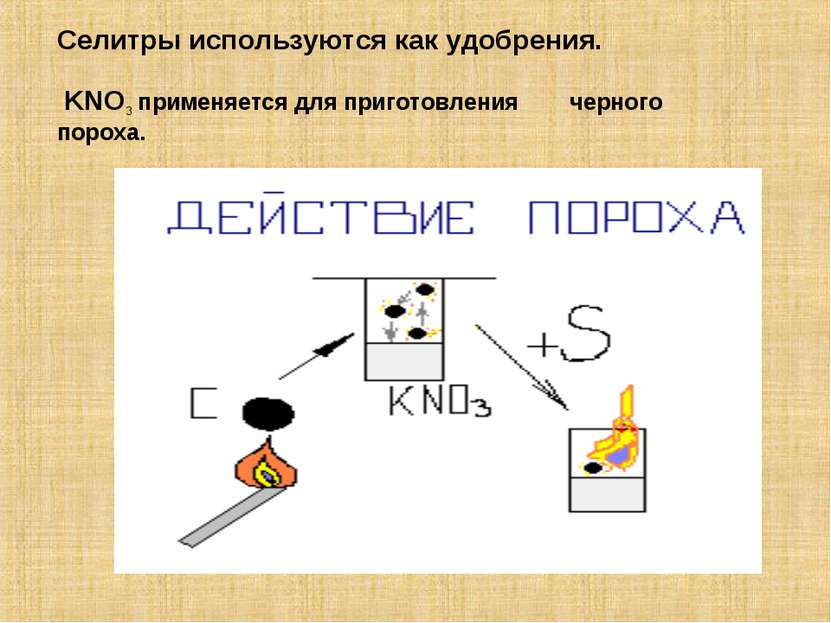
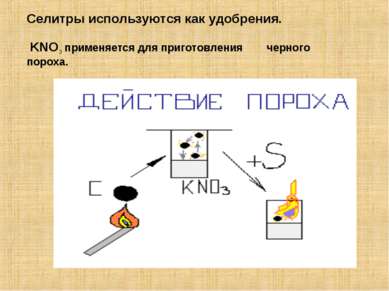
 Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды. Селитры – соли азотной кислоты и щелочных металлов. NaNO3 – натриевая селитра KNO3 – калийная селитра NH4NO3 – аммиачная селитра Ca(NO3)2 – кальциевая селитра Свойства: ВСЕ растворимы в воде.
Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды. Селитры – соли азотной кислоты и щелочных металлов. NaNO3 – натриевая селитра KNO3 – калийная селитра NH4NO3 – аммиачная селитра Ca(NO3)2 – кальциевая селитра Свойства: ВСЕ растворимы в воде.
Cлайд 20
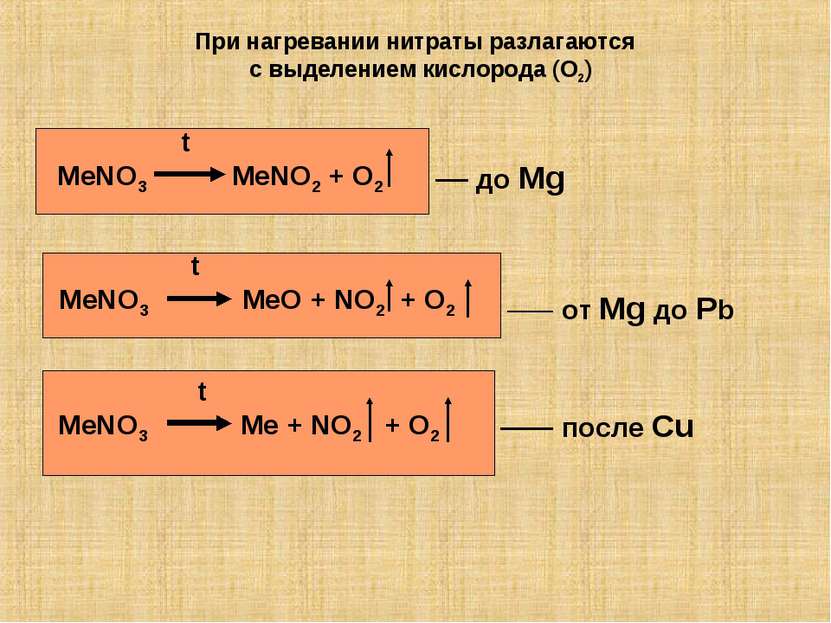
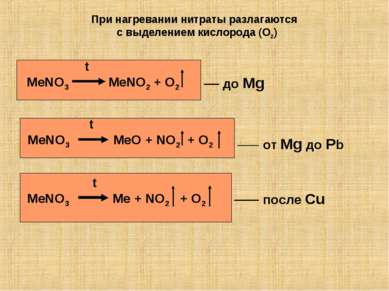 При нагревании нитраты разлагаются с выделением кислорода (O2) t MeNO3 MeNO2 + O2 t MeNO3 MeO + NO2 + O2 t MeNO3 Me + NO2 + O2 до Mg от Mg до Pb после Cu
При нагревании нитраты разлагаются с выделением кислорода (O2) t MeNO3 MeNO2 + O2 t MeNO3 MeO + NO2 + O2 t MeNO3 Me + NO2 + O2 до Mg от Mg до Pb после Cu
Cлайд 22
 1 Аммиак при нормальных условиях – это… 1) бесцветный газ без запаха 2) бурый, остро пахнущий газ 3) бесцветный, остро пахнущий газ 4) бесцветная жидкость Тесты: 2 С концентрированной азотной кислотой не взаимодействует… 1) Hg 2) Al 3) Cu 4) Zn 3 В промышленности азотную кислоту получают по реакции: 1) NaNO3(K) + H2SO4(K) = NaHSO4 + HNO3 2) Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3 3) 4NO2 + O2 + 2H2O = 4HNO3 4) N2O5 + H2O = 2HNO3 4 Соли аммония реагируют с щелочами, так как при этом… 1)образуется слабое основание гидроксид аммония 2)выделяется газ аммиак 3)образуется новая соль 4)образуется слабое основание и выделяется газ 5 Коэффициент перед формулой соли в уравнении реакции Mg +HNO3 NO + … + H2O равен… 1)3 2)4 3)6 4)8 6 При добавлении нитрата серебра к расствору некоторого минерального удобрения выпал белый осадок. Это удобрение… 1)нитрат кальция 2)нитрат калия 3)нитрат аммония 4)сильвинит 7 самая слабая из кислот, формула которых HNO3 2) H2SiO3 3) H2SO3 4)H3PO4 8 азотной кислоте соответствует оксид… 1) N2O 2) NO 3)NO2 4)N2O5 9 из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает: 1) Be 2)B 3) S 4)N 10 дополните фразу « селитры – это …» I вариант
1 Аммиак при нормальных условиях – это… 1) бесцветный газ без запаха 2) бурый, остро пахнущий газ 3) бесцветный, остро пахнущий газ 4) бесцветная жидкость Тесты: 2 С концентрированной азотной кислотой не взаимодействует… 1) Hg 2) Al 3) Cu 4) Zn 3 В промышленности азотную кислоту получают по реакции: 1) NaNO3(K) + H2SO4(K) = NaHSO4 + HNO3 2) Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3 3) 4NO2 + O2 + 2H2O = 4HNO3 4) N2O5 + H2O = 2HNO3 4 Соли аммония реагируют с щелочами, так как при этом… 1)образуется слабое основание гидроксид аммония 2)выделяется газ аммиак 3)образуется новая соль 4)образуется слабое основание и выделяется газ 5 Коэффициент перед формулой соли в уравнении реакции Mg +HNO3 NO + … + H2O равен… 1)3 2)4 3)6 4)8 6 При добавлении нитрата серебра к расствору некоторого минерального удобрения выпал белый осадок. Это удобрение… 1)нитрат кальция 2)нитрат калия 3)нитрат аммония 4)сильвинит 7 самая слабая из кислот, формула которых HNO3 2) H2SiO3 3) H2SO3 4)H3PO4 8 азотной кислоте соответствует оксид… 1) N2O 2) NO 3)NO2 4)N2O5 9 из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает: 1) Be 2)B 3) S 4)N 10 дополните фразу « селитры – это …» I вариант
Cлайд 23
 II вариант 1 азотная кислота – это сильная кислота, так как она… 1)полностью диссоциирована в водном растворе 2)растворяет даже серебро 3)сильный окилитель 4)хорошо растворима в воде 6 Плохо растворяется а воде минеральное удобрение… 1)хлорид аммония 2)нитрат клия 3)сильвинит 4)суперфосфат 4 соли аммони по по отношению к воде… 1)хорошо растворимы 2)плохо растворимы 3)нерастворимы 4)есть растворимые и нерастворимые 3 аммиак в промышленности получают… 1) N2 + 3H2 2NH3 2) 4NO2 + O2 + 2H2O = 4HNO3 3) N2O5 + H2O = 2HNO3 4) NaNO3(K) + H2SO4(K) = NaHSO4 + HNO3 8 азотной кислоте соответствует оксид… 1) N2O 2) NO 3)NO2 4)N2O5 5 коэффициент перед формулой восстановителя в уравнении реакции Zn + HNO3 N2O +… + H2O равен 1) 1 2) 2 3) 3 4) 4 2 минимальная степень олисления азота соединении… 1) N2 2) NO 3) NO2 4) HNO3 7 самая слабая из кислот, формула которых HNO3 2) H2SO4 3) H2CO3 4) H3SiO3 9 из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает: 1) B 2)P 3)N 4)F 10 дополните фразу «нитраты – это …»
II вариант 1 азотная кислота – это сильная кислота, так как она… 1)полностью диссоциирована в водном растворе 2)растворяет даже серебро 3)сильный окилитель 4)хорошо растворима в воде 6 Плохо растворяется а воде минеральное удобрение… 1)хлорид аммония 2)нитрат клия 3)сильвинит 4)суперфосфат 4 соли аммони по по отношению к воде… 1)хорошо растворимы 2)плохо растворимы 3)нерастворимы 4)есть растворимые и нерастворимые 3 аммиак в промышленности получают… 1) N2 + 3H2 2NH3 2) 4NO2 + O2 + 2H2O = 4HNO3 3) N2O5 + H2O = 2HNO3 4) NaNO3(K) + H2SO4(K) = NaHSO4 + HNO3 8 азотной кислоте соответствует оксид… 1) N2O 2) NO 3)NO2 4)N2O5 5 коэффициент перед формулой восстановителя в уравнении реакции Zn + HNO3 N2O +… + H2O равен 1) 1 2) 2 3) 3 4) 4 2 минимальная степень олисления азота соединении… 1) N2 2) NO 3) NO2 4) HNO3 7 самая слабая из кислот, формула которых HNO3 2) H2SO4 3) H2CO3 4) H3SiO3 9 из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает: 1) B 2)P 3)N 4)F 10 дополните фразу «нитраты – это …»
Cлайд 24
 1. Рассчитайте массу аммиака, который требуется для получения 200 кг азотной кислоты с массовой долей HNO3 60%. При расчёте учтите, что массовая доля выхода конечного продукта при синтезе составляет 80%. Задачи: 2. При нагревании нитрата натрия образовался кислород объемом 280 мл (нормальные условия). Какая масса соли подверглась разложению. 3. Рассчитайте массу гидроксида кальция(II), который можно нейтрализовать с помощью 630 г раствора азотной кислоты, в которой массовая доля HNO3 равна 20% 4.При пропускании избытка аммиака через раствор массой 600 г с массовой долей азотной кислоты 42% получили нитрат аммония массой 300 г. Определите массовую долю выхода нитрата аммония. 5. На смесь меди и оксида меди (II) массой 75 г подействовали избытком HNO3 (концентрированная). При этом образовался газ объемом 26,88 л (нормальные условия). Определите массовую долю оксида меди(II) в исходной смеси. 6.Аммиак объемом 7,84 л (нормальные условия) подвергли каталитическому окислению и дальнейшему превращению в азотную кислоту. В результате получили раствор массой 200г. Считая выход HNO3 равным 40%, определите массовую долю её в полученном растворе.
1. Рассчитайте массу аммиака, который требуется для получения 200 кг азотной кислоты с массовой долей HNO3 60%. При расчёте учтите, что массовая доля выхода конечного продукта при синтезе составляет 80%. Задачи: 2. При нагревании нитрата натрия образовался кислород объемом 280 мл (нормальные условия). Какая масса соли подверглась разложению. 3. Рассчитайте массу гидроксида кальция(II), который можно нейтрализовать с помощью 630 г раствора азотной кислоты, в которой массовая доля HNO3 равна 20% 4.При пропускании избытка аммиака через раствор массой 600 г с массовой долей азотной кислоты 42% получили нитрат аммония массой 300 г. Определите массовую долю выхода нитрата аммония. 5. На смесь меди и оксида меди (II) массой 75 г подействовали избытком HNO3 (концентрированная). При этом образовался газ объемом 26,88 л (нормальные условия). Определите массовую долю оксида меди(II) в исходной смеси. 6.Аммиак объемом 7,84 л (нормальные условия) подвергли каталитическому окислению и дальнейшему превращению в азотную кислоту. В результате получили раствор массой 200г. Считая выход HNO3 равным 40%, определите массовую долю её в полученном растворе.