X
Код презентации скопируйте его
Кислоты (8 класс)
Скачать эту презентациюПрезентация на тему Кислоты (8 класс)
Скачать эту презентациюCлайд 2
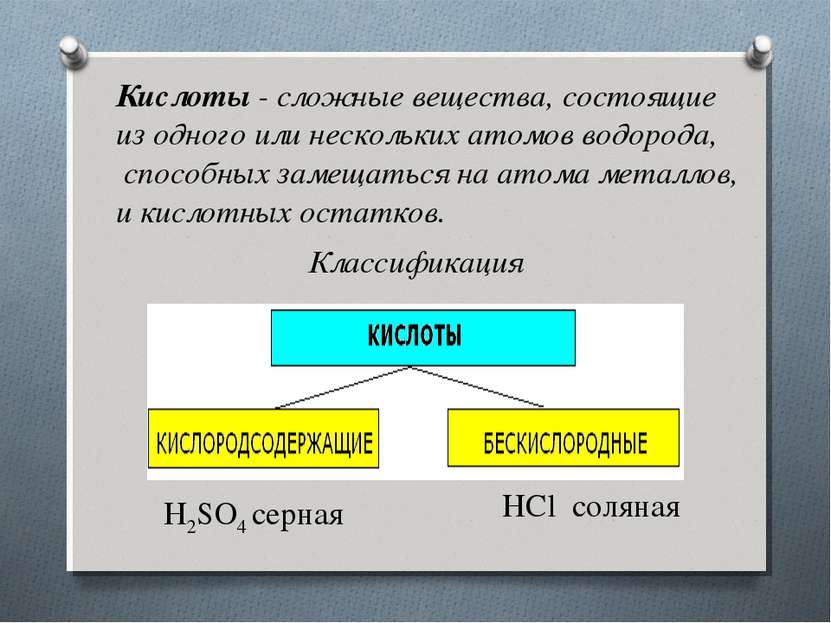
 Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Классификация H2SO4 серная HCl соляная
Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков. Классификация H2SO4 серная HCl соляная
Cлайд 3
 Физические свойства кислот Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Физические свойства кислот Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Cлайд 4
 Способы получения кислот 1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl 2. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 3. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl
Способы получения кислот 1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl 2. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 3. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl
Cлайд 5
 Химические свойства Изменяют окраску индикаторов Название индикатора Нейтральная среда Кислая среда Лакмус Фиолетовый Красный Фенолфталеин Бесцветный Бесцветный Метилоранж Оранжевый Красный Универсальная индикаторная бумага Оранжевая Красная
Химические свойства Изменяют окраску индикаторов Название индикатора Нейтральная среда Кислая среда Лакмус Фиолетовый Красный Фенолфталеин Бесцветный Бесцветный Метилоранж Оранжевый Красный Универсальная индикаторная бумага Оранжевая Красная
Cлайд 6
 2. Взаимодействуют с металлами в ряду активности до H2 Zn + 2 HCl = ZnCl2 + H2 3. Взаимодействуют с оксидами металлов CuO + H2SO4 = Cu SO4 + H2O 4. Взаимодействуют с гидроксидами металлов H3PO4 + 3NaOH = Na3PO4 + 3H2O 5. Взаимодействуют с солями, если образуется газ или осадок BaCl2 + H2SO4 = BaSO4↓ + 2HCl CaCO3 + 2HCl = CaCl2 + CO2 ↑ +H2O
2. Взаимодействуют с металлами в ряду активности до H2 Zn + 2 HCl = ZnCl2 + H2 3. Взаимодействуют с оксидами металлов CuO + H2SO4 = Cu SO4 + H2O 4. Взаимодействуют с гидроксидами металлов H3PO4 + 3NaOH = Na3PO4 + 3H2O 5. Взаимодействуют с солями, если образуется газ или осадок BaCl2 + H2SO4 = BaSO4↓ + 2HCl CaCO3 + 2HCl = CaCl2 + CO2 ↑ +H2O