X
Код презентации скопируйте его
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Скачать эту презентациюПрезентация на тему ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Скачать эту презентациюCлайд 2
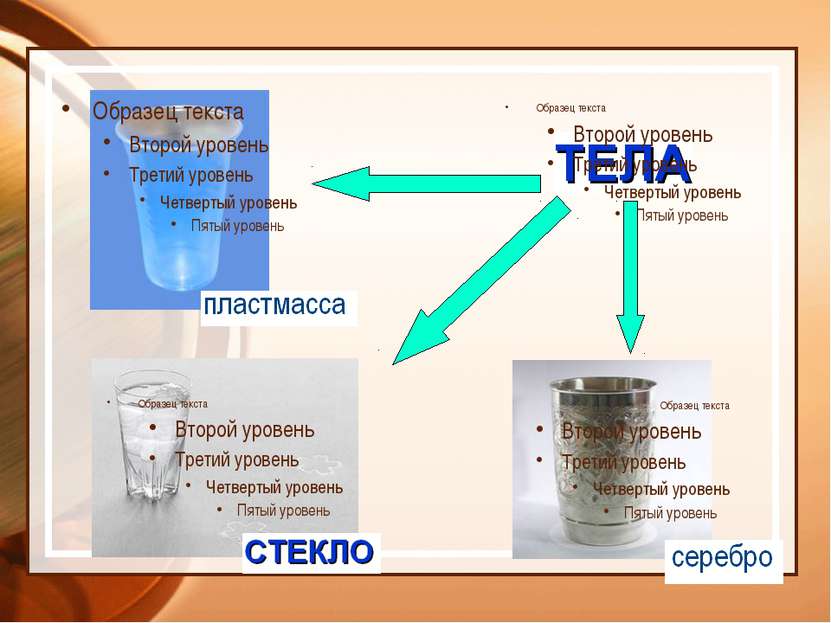
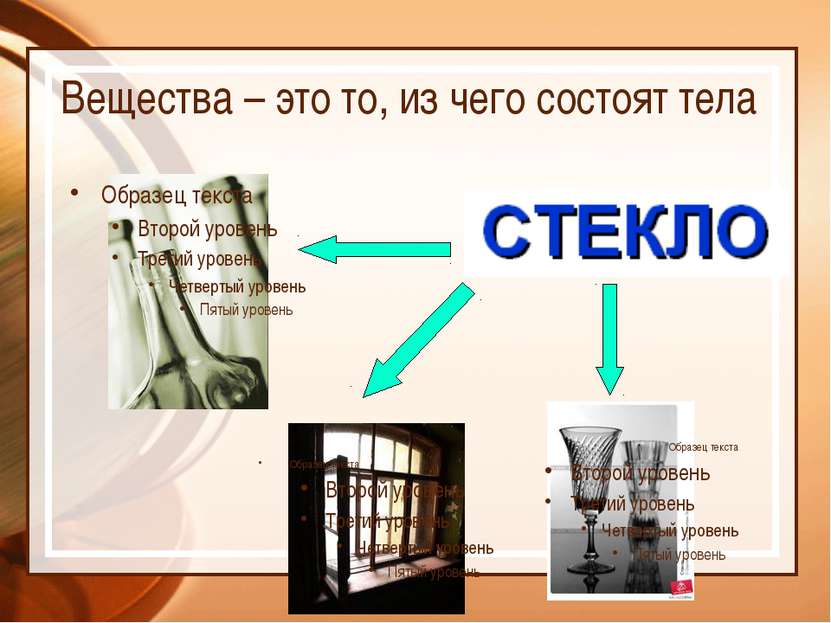
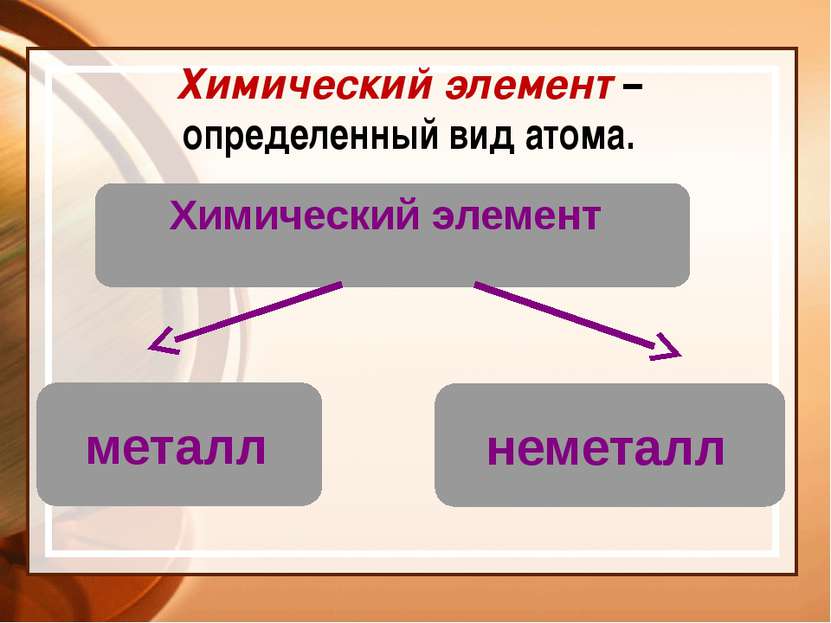
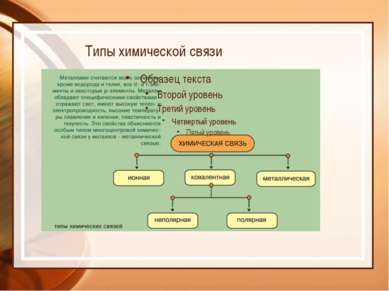
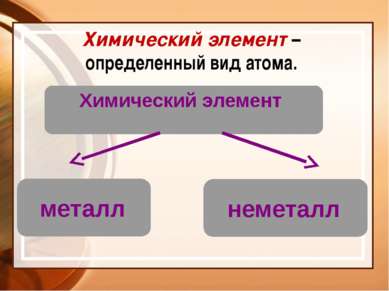
 Химия – это наука о веществах, их свойствах и превращениях Физическое тело вещество Химический элемент - определенный вид атомов
Химия – это наука о веществах, их свойствах и превращениях Физическое тело вещество Химический элемент - определенный вид атомов
Cлайд 5
 План характеристики элемента: 1. Символ и название. 2. Положение в ПСХЭ. 3. Строение атома. 4. Электронная конфигурация. 5. Структурная конфигурация. 6. Формула и характер высшего оксида. 7. Формула гидроксидного соединения.
План характеристики элемента: 1. Символ и название. 2. Положение в ПСХЭ. 3. Строение атома. 4. Электронная конфигурация. 5. Структурная конфигурация. 6. Формула и характер высшего оксида. 7. Формула гидроксидного соединения.
Cлайд 7
 это вещества, состоящие из атомов одного химического элемента это вещества, состоящие из атомов двух или нескольких химических элементов Вещества Простые Сложные H H Cu H Cl
это вещества, состоящие из атомов одного химического элемента это вещества, состоящие из атомов двух или нескольких химических элементов Вещества Простые Сложные H H Cu H Cl
Cлайд 8
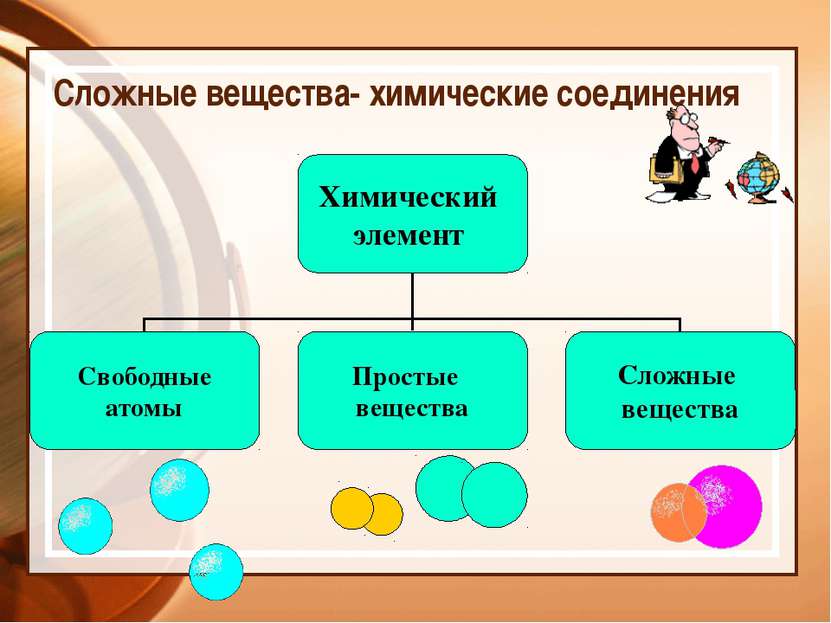
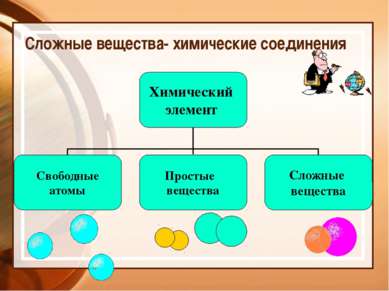
 Сложные вещества- химические соединения Химический элемент Свободные атомы Простые вещества Сложные вещества
Сложные вещества- химические соединения Химический элемент Свободные атомы Простые вещества Сложные вещества
Cлайд 9
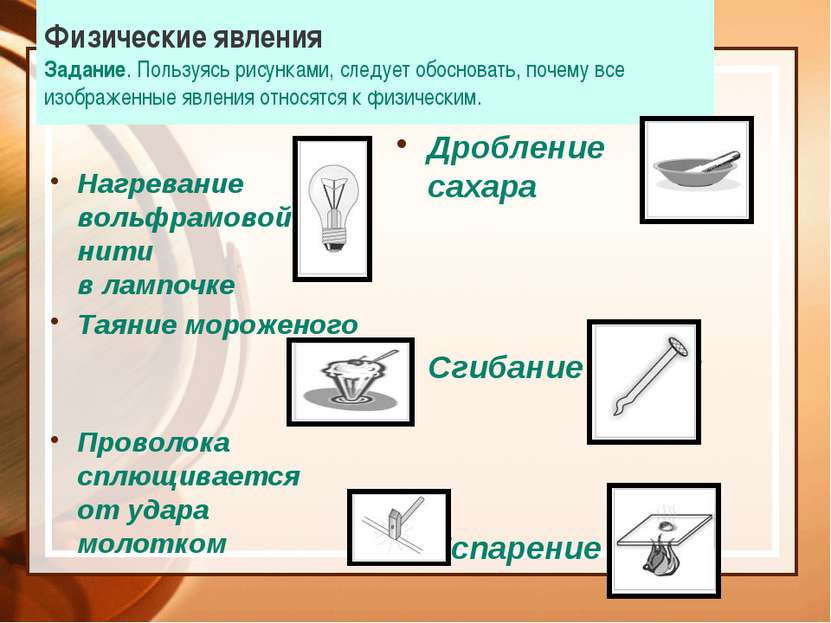
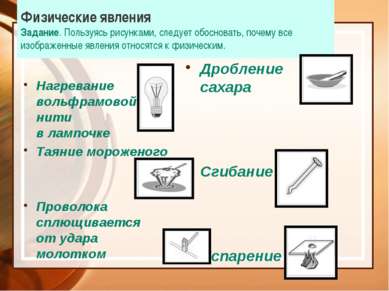
 Физические явления Задание. Пользуясь рисунками, следует обосновать, почему все изображенные явления относятся к физическим. Нагревание вольфрамовой нити в лампочке Таяние мороженого Проволока сплющивается от удара молотком Дробление сахара Сгибание гвоздя Испарение воды
Физические явления Задание. Пользуясь рисунками, следует обосновать, почему все изображенные явления относятся к физическим. Нагревание вольфрамовой нити в лампочке Таяние мороженого Проволока сплющивается от удара молотком Дробление сахара Сгибание гвоздя Испарение воды
Cлайд 10
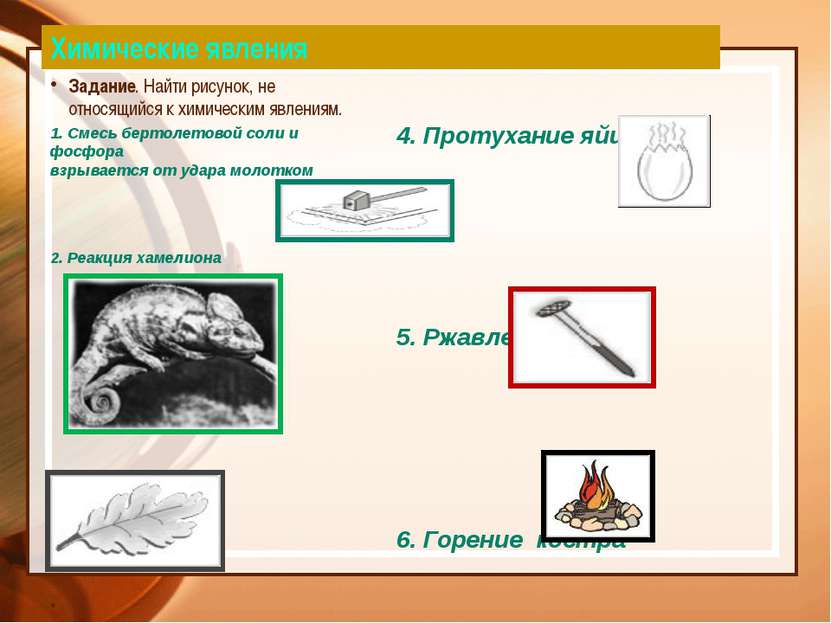
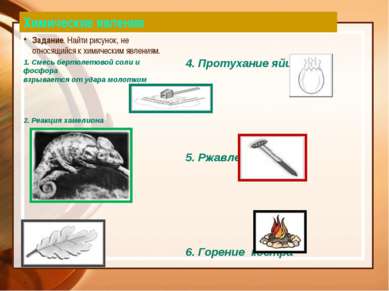
 Химические явления Задание. Найти рисунок, не относящийся к химическим явлениям. 1. Смесь бертолетовой соли и фосфора взрывается от удара молотком 2. Реакция хамелиона 3. Листопад 4. Протухание яйца 5. Ржавление гвоздя 6. Горение костра
Химические явления Задание. Найти рисунок, не относящийся к химическим явлениям. 1. Смесь бертолетовой соли и фосфора взрывается от удара молотком 2. Реакция хамелиона 3. Листопад 4. Протухание яйца 5. Ржавление гвоздя 6. Горение костра
Cлайд 11
 Признаки химической реакции Изменение окраски. Выделение или поглощение теплоты. Появление запаха. Образования осадка. Выделение газа.
Признаки химической реакции Изменение окраски. Выделение или поглощение теплоты. Появление запаха. Образования осадка. Выделение газа.
Cлайд 12
 ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ: В пределах одного периода слева направо металлические свойства ослабевают; А неметаллические возрастают. ПОТОМУ ЧТО: Растет число электронов на внешнем уровне; Радиус атома уменьшается; Число энергетических уровней постоянно. ПЕРИОДИЧНОСТЬ СВОЙСТВ В ГЛАВНЫХ ПОДРУППАХ: В пределах одной и той же группы сверху вниз металлические свойства усиливаются; А неметаллические уменьшаются. ПОТОМУ ЧТО: Число электронов на внешнем уровне одинаково; Радиус атома увеличивается; Число энергетических уровней в атомах растет.
ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ: В пределах одного периода слева направо металлические свойства ослабевают; А неметаллические возрастают. ПОТОМУ ЧТО: Растет число электронов на внешнем уровне; Радиус атома уменьшается; Число энергетических уровней постоянно. ПЕРИОДИЧНОСТЬ СВОЙСТВ В ГЛАВНЫХ ПОДРУППАХ: В пределах одной и той же группы сверху вниз металлические свойства усиливаются; А неметаллические уменьшаются. ПОТОМУ ЧТО: Число электронов на внешнем уровне одинаково; Радиус атома увеличивается; Число энергетических уровней в атомах растет.
Cлайд 13
 Под ВАЛЕНТНОСТЬ (сила) понимают свойства атомов образовывать химические связи с другими атомами, а также число одинарных связей. Валентность у элементов бывает: постоянная, переменная. Определять валентность можно также с помощью ПСХЭ. ВАЛЕНТНОСТЬ 1 П Ш ЭЛЕМЕНТЫ H, Na, Li, K, Ag Mg, O, Ca,Ba, Zn Al
Под ВАЛЕНТНОСТЬ (сила) понимают свойства атомов образовывать химические связи с другими атомами, а также число одинарных связей. Валентность у элементов бывает: постоянная, переменная. Определять валентность можно также с помощью ПСХЭ. ВАЛЕНТНОСТЬ 1 П Ш ЭЛЕМЕНТЫ H, Na, Li, K, Ag Mg, O, Ca,Ba, Zn Al
Cлайд 16
 Закон постоянства состава вещества или закон Пруста. каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
Закон постоянства состава вещества или закон Пруста. каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
Cлайд 17
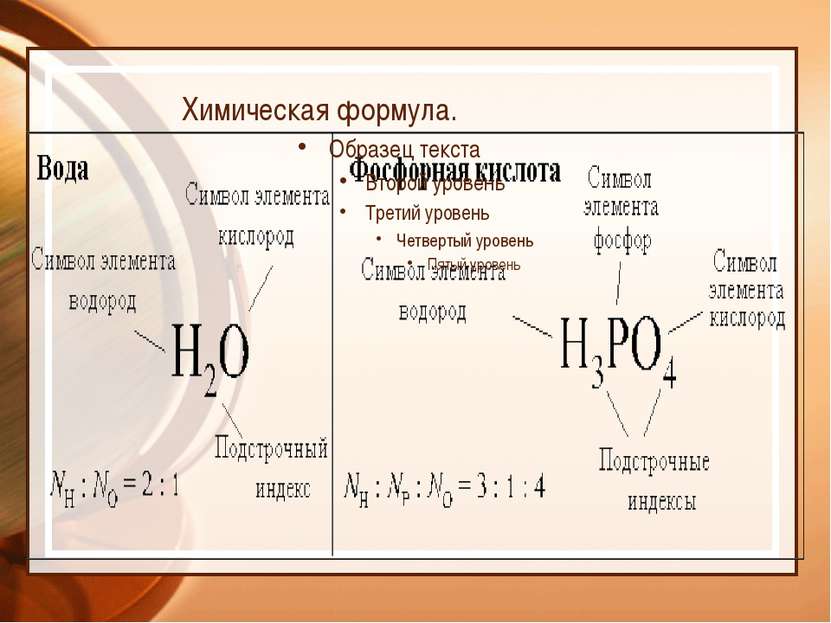
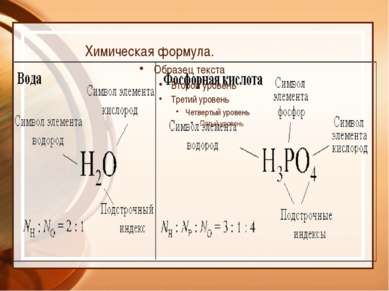
 Индекс показывает количество атомов данного элемента в молекуле. Итак, состав веществ выражается химическими формулами с целочисленными индексами, например Н2О, НСl, СН4, HNO3, CuS, Na3PO4, P2O5, Na2SO4
Индекс показывает количество атомов данного элемента в молекуле. Итак, состав веществ выражается химическими формулами с целочисленными индексами, например Н2О, НСl, СН4, HNO3, CuS, Na3PO4, P2O5, Na2SO4
Cлайд 20
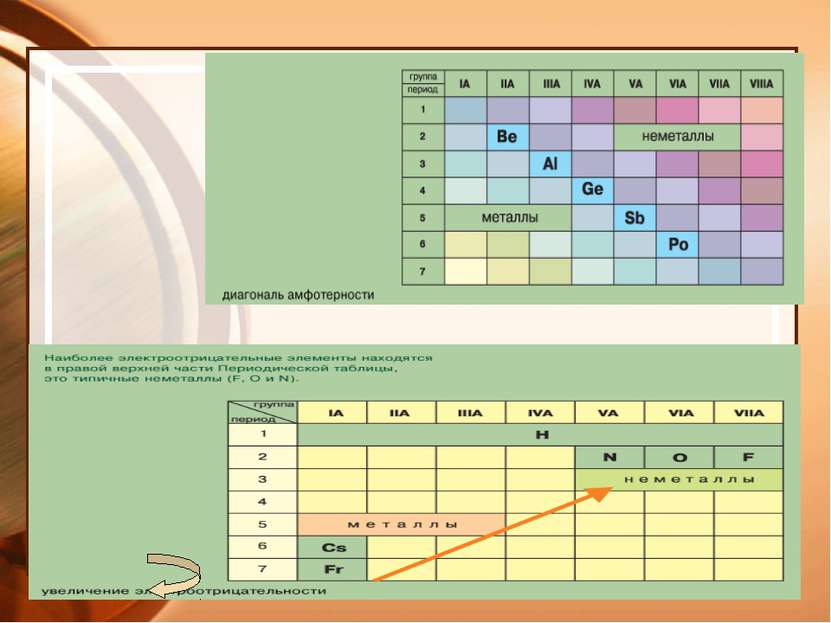
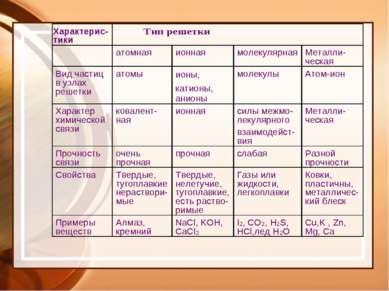 Электроотрицательность - способность атомов оттягивать на себя электроны. Ряд ЭО: Si H P C S Br Cl N O F ЭО –увеличивается
Электроотрицательность - способность атомов оттягивать на себя электроны. Ряд ЭО: Si H P C S Br Cl N O F ЭО –увеличивается
Cлайд 22
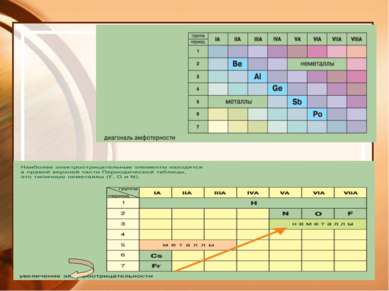 Металлы Na K Ca Ba Cu Ag Au Zn Pb Hg Al Mg Mn Fe натрий натрий железо феррум свинец плюмбум цинк цинк барий барий ртуть гидраргирум алюминий алюминий калий калий серебро аргентум марганец марганец медь купрум кальций кальций золото аурум магний магний Русское название Произношение ◄
Металлы Na K Ca Ba Cu Ag Au Zn Pb Hg Al Mg Mn Fe натрий натрий железо феррум свинец плюмбум цинк цинк барий барий ртуть гидраргирум алюминий алюминий калий калий серебро аргентум марганец марганец медь купрум кальций кальций золото аурум магний магний Русское название Произношение ◄
Cлайд 23
 Неметаллы S Cl Br C Si J N P O F H cера углерод водород кремний кислород фосфор бром хлор фтор йод азот бром йод хлор фтор эс эн аш о це пэ силициум Русское название Произношение ►
Неметаллы S Cl Br C Si J N P O F H cера углерод водород кремний кислород фосфор бром хлор фтор йод азот бром йод хлор фтор эс эн аш о це пэ силициум Русское название Произношение ►
Cлайд 24
 Au 79 196, 97 число, показывающее во сколько раз масса данного атома больше массы атома водорода (округляем до целого) Относительная атомная масса Аr- Порядковый (атомный) номер
Au 79 196, 97 число, показывающее во сколько раз масса данного атома больше массы атома водорода (округляем до целого) Относительная атомная масса Аr- Порядковый (атомный) номер
Cлайд 25
 Массовые доли элементов. ФОРМУЛА: Ar (эл.)• n W(эл.) Mr (в-ва) Единицы измерения [доли] или [%], в этом случае умножаем на 100 %.
Массовые доли элементов. ФОРМУЛА: Ar (эл.)• n W(эл.) Mr (в-ва) Единицы измерения [доли] или [%], в этом случае умножаем на 100 %.
Cлайд 26
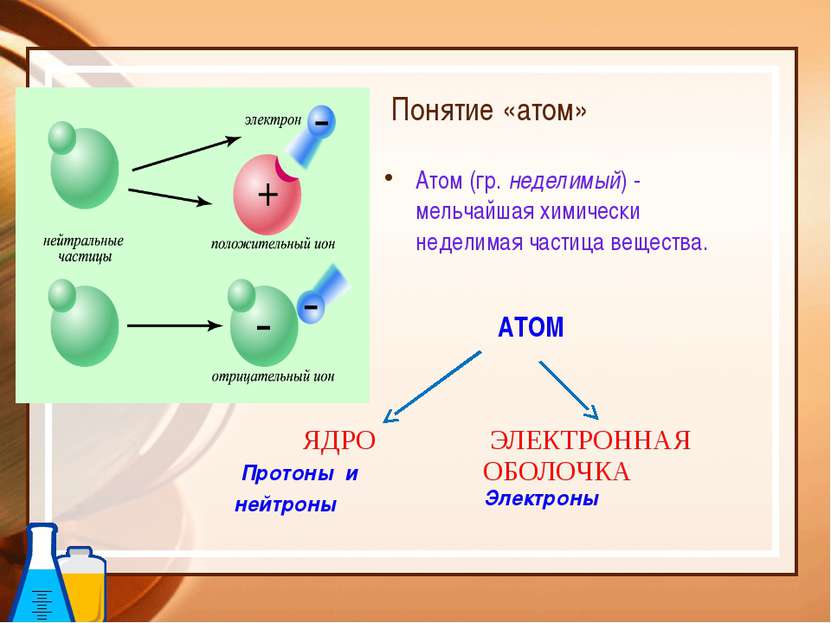
 Понятие «атом» Атом (гр. неделимый) - мельчайшая химически неделимая частица вещества. АТОМ ЯДРО Протоны и нейтроны ЭЛЕКТРОННАЯ ОБОЛОЧКА Электроны
Понятие «атом» Атом (гр. неделимый) - мельчайшая химически неделимая частица вещества. АТОМ ЯДРО Протоны и нейтроны ЭЛЕКТРОННАЯ ОБОЛОЧКА Электроны
Cлайд 27
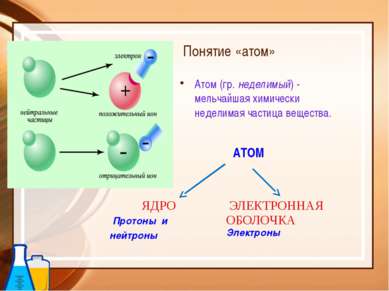 ОСНОВНЫЕ ПОЛОЖЕНИЯ ПЛАНЕТАРНОЙ МОДЕЛИ: Атом – это микрочастица, которая имеет форму шара. Атом – это сложная система, состоящая из ядра и электронов. Ядра находятся в центре атома и имеют очень маленький размер. Ядро имеет положительный заряд, величина которого определяется числом протонов в нем. Электроны движутся вокруг ядра, имеют ничтожно малую массу и размеры, обладают отрицательным зарядом. Атом электронейтрален, поэтому число протонов и электронов в нем одинаково.
ОСНОВНЫЕ ПОЛОЖЕНИЯ ПЛАНЕТАРНОЙ МОДЕЛИ: Атом – это микрочастица, которая имеет форму шара. Атом – это сложная система, состоящая из ядра и электронов. Ядра находятся в центре атома и имеют очень маленький размер. Ядро имеет положительный заряд, величина которого определяется числом протонов в нем. Электроны движутся вокруг ядра, имеют ничтожно малую массу и размеры, обладают отрицательным зарядом. Атом электронейтрален, поэтому число протонов и электронов в нем одинаково.
Cлайд 28
 Как измерить вещество? Необходимо точно знать число частиц вещества, т.е. его количество Единица количества вещества – 1 моль, т.е. 6 ● 10 23 частиц
Как измерить вещество? Необходимо точно знать число частиц вещества, т.е. его количество Единица количества вещества – 1 моль, т.е. 6 ● 10 23 частиц
Cлайд 29
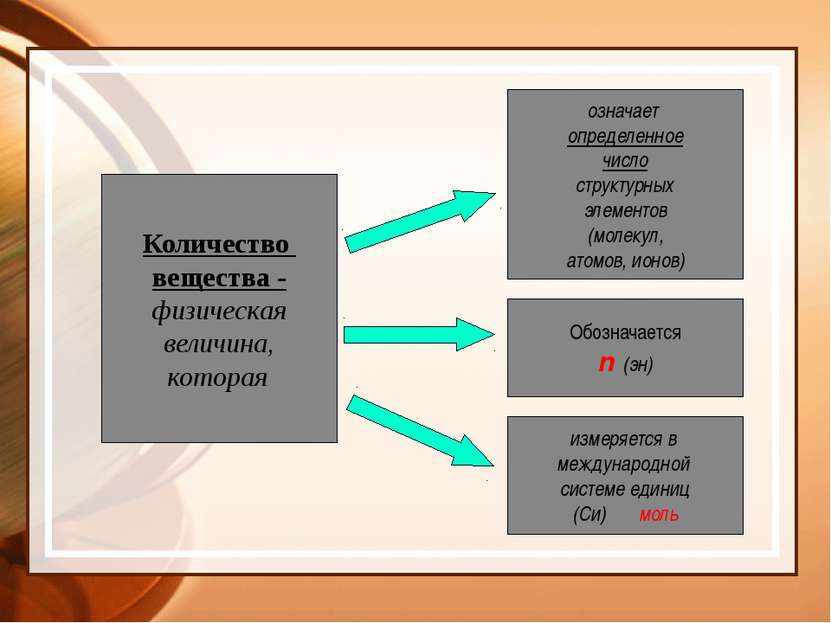
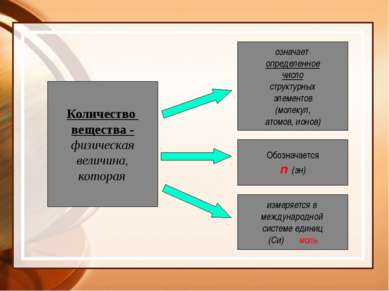
 Количество вещества - физическая величина, которая означает определенное число структурных элементов (молекул, атомов, ионов) Обозначается n (эн) измеряется в международной системе единиц (Си) моль
Количество вещества - физическая величина, которая означает определенное число структурных элементов (молекул, атомов, ионов) Обозначается n (эн) измеряется в международной системе единиц (Си) моль
Cлайд 30
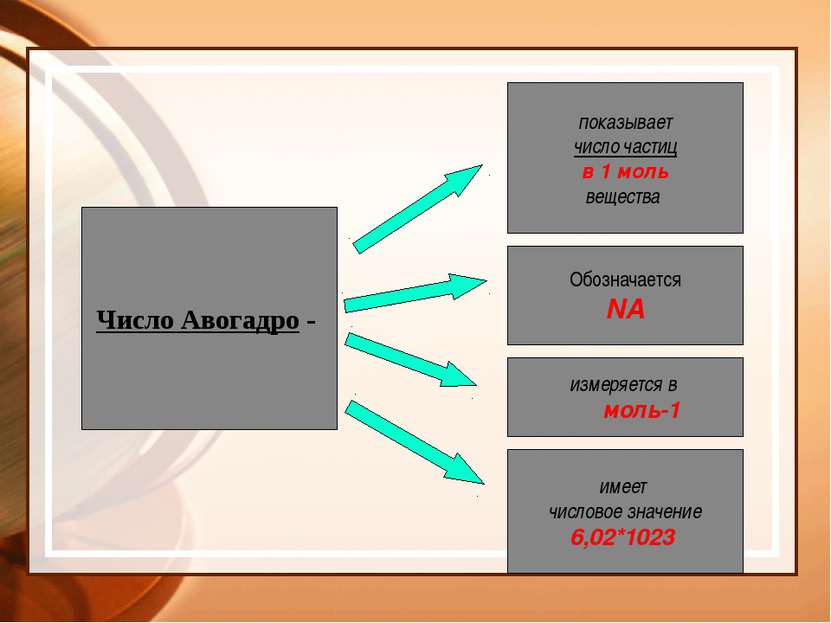
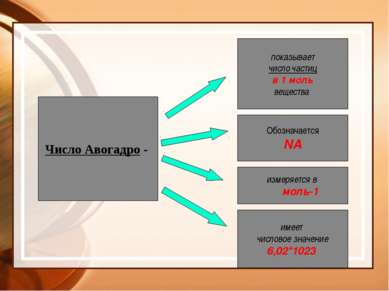
 Число Авогадро - показывает число частиц в 1 моль вещества Обозначается NA измеряется в моль-1 имеет числовое значение 6,02*1023
Число Авогадро - показывает число частиц в 1 моль вещества Обозначается NA измеряется в моль-1 имеет числовое значение 6,02*1023
Cлайд 31
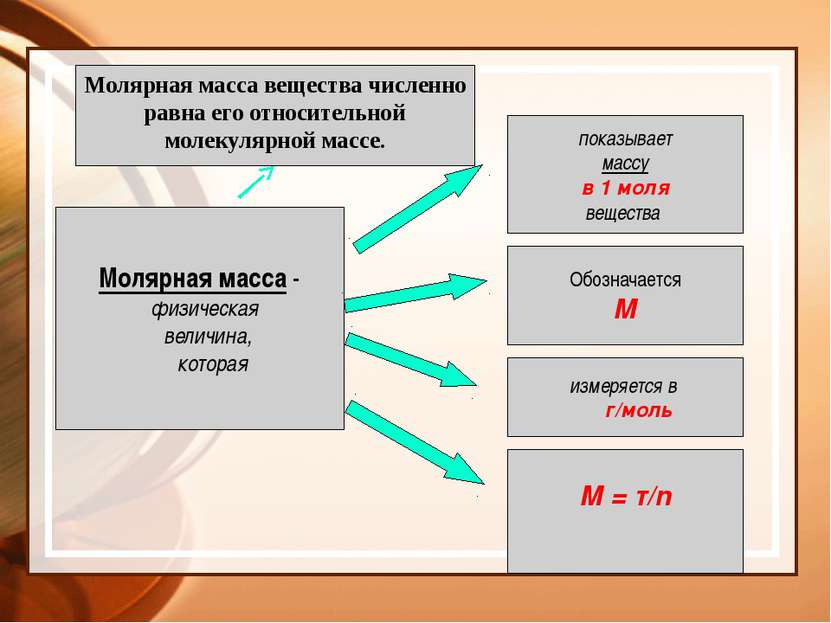
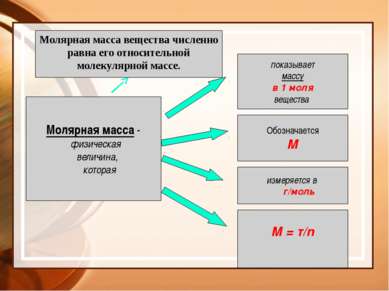
 Молярная масса - физическая величина, которая показывает массу в 1 моля вещества Обозначается М измеряется в г/моль М = т/n Молярная масса вещества численно равна его относительной молекулярной массе.
Молярная масса - физическая величина, которая показывает массу в 1 моля вещества Обозначается М измеряется в г/моль М = т/n Молярная масса вещества численно равна его относительной молекулярной массе.
Cлайд 33
 Но если число частиц известно? В 1 моле содержится 6 ● 10 23 частиц Эта величина называется число Авогадро n =N / Na
Но если число частиц известно? В 1 моле содержится 6 ● 10 23 частиц Эта величина называется число Авогадро n =N / Na
Cлайд 34
 Амедео Авогадро высказал предположение в 1811 году, что В равных объемах различных газов при одинаковых условиях (температура, давление) содержится одинаковое число молекул.
Амедео Авогадро высказал предположение в 1811 году, что В равных объемах различных газов при одинаковых условиях (температура, давление) содержится одинаковое число молекул.
Cлайд 35
 Молярный объем газа Vm — величина, определяемая отношением объема данной порции газа V к химическому количеству вещества n в этой порции: Нормальные условия: температура — 0°С давление — 101,325 кПа
Молярный объем газа Vm — величина, определяемая отношением объема данной порции газа V к химическому количеству вещества n в этой порции: Нормальные условия: температура — 0°С давление — 101,325 кПа
Cлайд 36
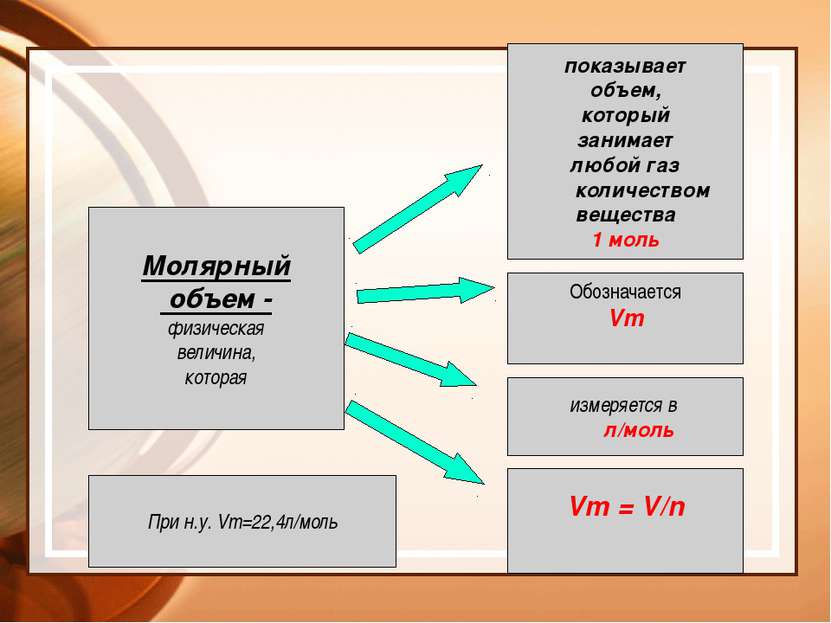
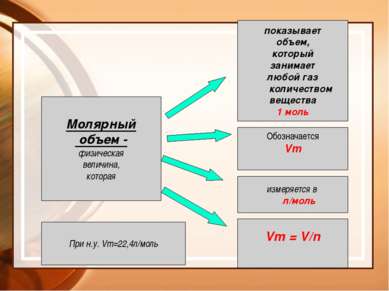
 Молярный объем - физическая величина, которая показывает объем, который занимает любой газ количеством вещества 1 моль Обозначается Vm измеряется в л/моль Vm = V/n При н.у. Vm=22,4л/моль
Молярный объем - физическая величина, которая показывает объем, который занимает любой газ количеством вещества 1 моль Обозначается Vm измеряется в л/моль Vm = V/n При н.у. Vm=22,4л/моль
Cлайд 38
 Отношение массы растворимого вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой W (омега) и выражают в долях единицы или процентах.
Отношение массы растворимого вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой W (омега) и выражают в долях единицы или процентах.