X
Код презентации скопируйте его
Фосфорная кислота и ее свойства
Скачать эту презентациюПрезентация на тему Фосфорная кислота и ее свойства
Скачать эту презентациюCлайд 3
 Сегодня на уроке мы должны: Образовательные: Изучить физические и химические свойства фосфорной кислоты через проведение химического эксперимента; На основе Интернет-ресурсов, специальной литературы проиллюстрировать применение и получение фосфорной кислоты. развивающие: Пробудить интерес к самостоятельному поиску информации в Интернете, специальной литературе; Выразить свое отношение к проблемам экологии при промышленном получении фосфорной кислоты и ее применение. воспитательные: На основе материала данной темы, эксперимента умения обучающихся наблюдать, сравнивать, делать выводы.
Сегодня на уроке мы должны: Образовательные: Изучить физические и химические свойства фосфорной кислоты через проведение химического эксперимента; На основе Интернет-ресурсов, специальной литературы проиллюстрировать применение и получение фосфорной кислоты. развивающие: Пробудить интерес к самостоятельному поиску информации в Интернете, специальной литературе; Выразить свое отношение к проблемам экологии при промышленном получении фосфорной кислоты и ее применение. воспитательные: На основе материала данной темы, эксперимента умения обучающихся наблюдать, сравнивать, делать выводы.
Cлайд 4
 Сегодня на уроке мы должны: План: 1. Молекулярная формула фосфорной кислоты. 2. Получение и физические свойства. 3. Химические свойства характерные для всех кислот и специфические для фосфорной кислоты. 4. Применение.
Сегодня на уроке мы должны: План: 1. Молекулярная формула фосфорной кислоты. 2. Получение и физические свойства. 3. Химические свойства характерные для всех кислот и специфические для фосфорной кислоты. 4. Применение.
Cлайд 6
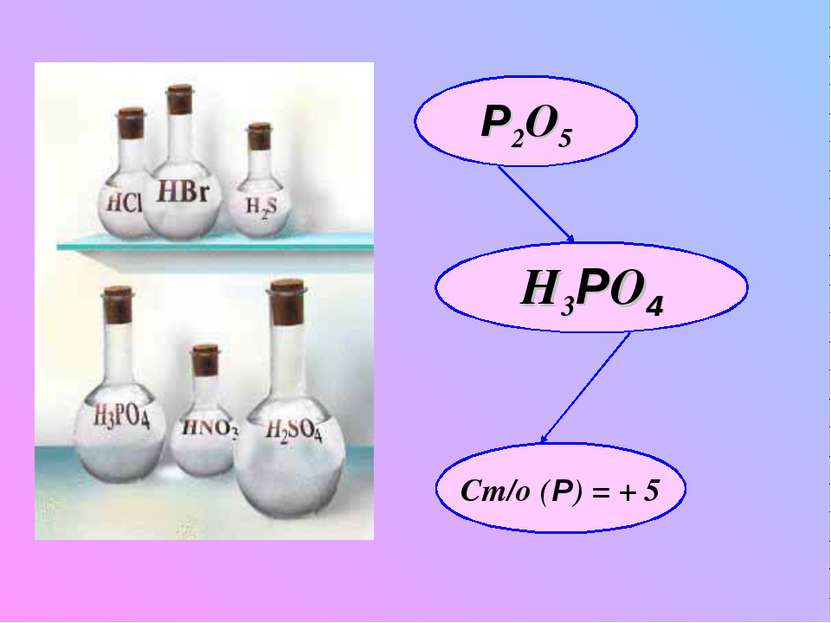
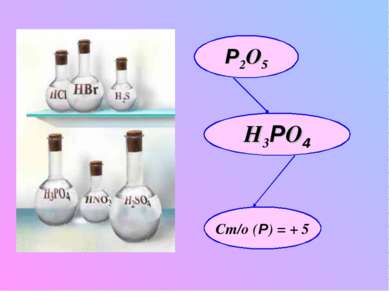
 Молекулярная формула фосфорной кислоты и физические свойства: твердое бесцветное, кристаллическое вещество, хорошо растворимое в воде в любых соотношениях; Сильная кислота – сильный окислитель (ст/о = +5) Mr(H3РO4) = 98 2H3 РO4 H2O +Н4Р2O7
Молекулярная формула фосфорной кислоты и физические свойства: твердое бесцветное, кристаллическое вещество, хорошо растворимое в воде в любых соотношениях; Сильная кислота – сильный окислитель (ст/о = +5) Mr(H3РO4) = 98 2H3 РO4 H2O +Н4Р2O7
Cлайд 7
 Производство фосфорной кислоты. а) Горение фосфора в ложечке, которую вносят в колбу. 2Р+5О2 = Р2О5 После заполнения колбы дымом частичек оксида фосфора, приливают немного воды до полного растворения Р2O5. Р2O5 +3 Н2О = 2Н3РО4 Для доказательства образования кислоты в колбе, добавляем несколько капель индикатора – лакмуса или метилового оранжевого. Р2O5 является кислотным. б) Взаимодействием природной соли с серной кислоты при нагревании Са3(РO4)2 +3 Н2SО4 = 2Н3РО4 + 3 СаSО4
Производство фосфорной кислоты. а) Горение фосфора в ложечке, которую вносят в колбу. 2Р+5О2 = Р2О5 После заполнения колбы дымом частичек оксида фосфора, приливают немного воды до полного растворения Р2O5. Р2O5 +3 Н2О = 2Н3РО4 Для доказательства образования кислоты в колбе, добавляем несколько капель индикатора – лакмуса или метилового оранжевого. Р2O5 является кислотным. б) Взаимодействием природной соли с серной кислоты при нагревании Са3(РO4)2 +3 Н2SО4 = 2Н3РО4 + 3 СаSО4
Cлайд 8
 Химические свойства общие с другими кислотами: Водный раствор кислоты изменяет окраску индикаторов. Диссоциирует в 3 ступени: I) Н3РО4 = Н+ + Н2РО42- II) Н2РО4- = Н+ + НРО42- III) НРО42- = Н+ + РО4 3- 2. Взаимодействие с металлами, расположенными в вытеснительном ряду до водорода: 3 Nа + Н3РО4 = 3Н2 + Nа3РО4 3. Взаимодействие с оксидами металлов. Оксид фосфора растворяется. Напишите уравнение реакции. 3 CaO + 2 Н3РО4 = 3 Н2O + Ca 3(РО4 )2 4. Взаимодействие с основаниями и аммиаком. 3 NaOH + Н3РО4 = 3Н2O + Na3РО4 5. Реагирует с солями: 3 Na2CO3 + 2Н3РО4 = 3Н2O + 3 CO2 + 2Na 3РО4
Химические свойства общие с другими кислотами: Водный раствор кислоты изменяет окраску индикаторов. Диссоциирует в 3 ступени: I) Н3РО4 = Н+ + Н2РО42- II) Н2РО4- = Н+ + НРО42- III) НРО42- = Н+ + РО4 3- 2. Взаимодействие с металлами, расположенными в вытеснительном ряду до водорода: 3 Nа + Н3РО4 = 3Н2 + Nа3РО4 3. Взаимодействие с оксидами металлов. Оксид фосфора растворяется. Напишите уравнение реакции. 3 CaO + 2 Н3РО4 = 3 Н2O + Ca 3(РО4 )2 4. Взаимодействие с основаниями и аммиаком. 3 NaOH + Н3РО4 = 3Н2O + Na3РО4 5. Реагирует с солями: 3 Na2CO3 + 2Н3РО4 = 3Н2O + 3 CO2 + 2Na 3РО4
Cлайд 9
 Специфические свойства фосфорной кислоты: 6 а) При нагревании постепенно превращается в метафосфорную кислоту 2Н3РО4 = Н4Р2О7 + Н2O Н4Р2О7 =2НРО3 + Н2O б) Качественная реакция на фосфорную кислоту нитрат серебра – появляется желтый осадок 3 AgNO3 + Н3РО4 = 3НNO3 + Ag3РО4 в) Играет большую роль в жизнедеятельности животных и растений. Входит в состав АТФ при разложении которой выделяется большое количество энергии
Специфические свойства фосфорной кислоты: 6 а) При нагревании постепенно превращается в метафосфорную кислоту 2Н3РО4 = Н4Р2О7 + Н2O Н4Р2О7 =2НРО3 + Н2O б) Качественная реакция на фосфорную кислоту нитрат серебра – появляется желтый осадок 3 AgNO3 + Н3РО4 = 3НNO3 + Ag3РО4 в) Играет большую роль в жизнедеятельности животных и растений. Входит в состав АТФ при разложении которой выделяется большое количество энергии
Cлайд 11
 Выберите вещества с которыми будет реагировать фосфорная кислота: КОН, Си, К2SО3, СО2, NО? 2. Какому молекулярному уравнению реакций соответствует ионное уравнение? 2Н+ + SО3 2- = Н2О + SО2 а) КОН + Н3РО4, = К3РО4 + Н2О б) К2SО3 + Н3РО4, = К3РО4 +Н2О + SО2 в) К2SО3 + Н3РО4, = К3РО4 +Н2О + SО3 Закрепление знаний учащихся
Выберите вещества с которыми будет реагировать фосфорная кислота: КОН, Си, К2SО3, СО2, NО? 2. Какому молекулярному уравнению реакций соответствует ионное уравнение? 2Н+ + SО3 2- = Н2О + SО2 а) КОН + Н3РО4, = К3РО4 + Н2О б) К2SО3 + Н3РО4, = К3РО4 +Н2О + SО2 в) К2SО3 + Н3РО4, = К3РО4 +Н2О + SО3 Закрепление знаний учащихся
Cлайд 12
 Сегодня на уроке мы: 1. Вспомнили молекулярная формула фосфорной кислоты. 2. Рассмотрели получение и физические свойства. 3. Химические свойства характерные для всех кислот и специфические для фосфорной кислоты. 4. Применение. Задание на дом: 28, стр.159 – 163; з. 2,7. Урок закончен. Всем огромное спасибо!
Сегодня на уроке мы: 1. Вспомнили молекулярная формула фосфорной кислоты. 2. Рассмотрели получение и физические свойства. 3. Химические свойства характерные для всех кислот и специфические для фосфорной кислоты. 4. Применение. Задание на дом: 28, стр.159 – 163; з. 2,7. Урок закончен. Всем огромное спасибо!