X
Код презентации скопируйте его
Классы органических веществ
Скачать эту презентациюПрезентация на тему Классы органических веществ
Скачать эту презентациюCлайд 2
 Деление на минеральные и органические вещества В начале XIX века ученые разделяли все вещества в природе на условно неживые и живые, включая в число последних царство животных и растений. Вещества первой группы получили название минеральных. А те, что вошли во вторую, стали называть органическими веществами. Однако в середине 19 в. полностью опровергли утверждение о том, что органические вещества могут образовываться только в живых организмах (А.В.Кольбе получил уксусную кислоту, М.Бертло синтезировал жир, и А.М.Бутлеров получил сахаристое вещество).
Деление на минеральные и органические вещества В начале XIX века ученые разделяли все вещества в природе на условно неживые и живые, включая в число последних царство животных и растений. Вещества первой группы получили название минеральных. А те, что вошли во вторую, стали называть органическими веществами. Однако в середине 19 в. полностью опровергли утверждение о том, что органические вещества могут образовываться только в живых организмах (А.В.Кольбе получил уксусную кислоту, М.Бертло синтезировал жир, и А.М.Бутлеров получил сахаристое вещество).
Cлайд 3
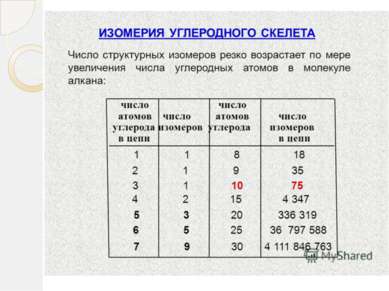
 Многочисленность органических веществ В настоящее время человечеству известно более 10 млн. веществ, из них около 70% относятся к органическим. Основными причинами многочисленности органических веществ считаются явления гомологии и изомерии.
Многочисленность органических веществ В настоящее время человечеству известно более 10 млн. веществ, из них около 70% относятся к органическим. Основными причинами многочисленности органических веществ считаются явления гомологии и изомерии.
Cлайд 4
 Определение класса органических соединений Наличие тех или иных функциональных групп либо атомов элементов определяет принадлежность соединения к соответствующему классу. Вещество относят к тому классу, который представлен самой старшей функциональной группой в молекуле.
Определение класса органических соединений Наличие тех или иных функциональных групп либо атомов элементов определяет принадлежность соединения к соответствующему классу. Вещество относят к тому классу, который представлен самой старшей функциональной группой в молекуле.
Cлайд 5
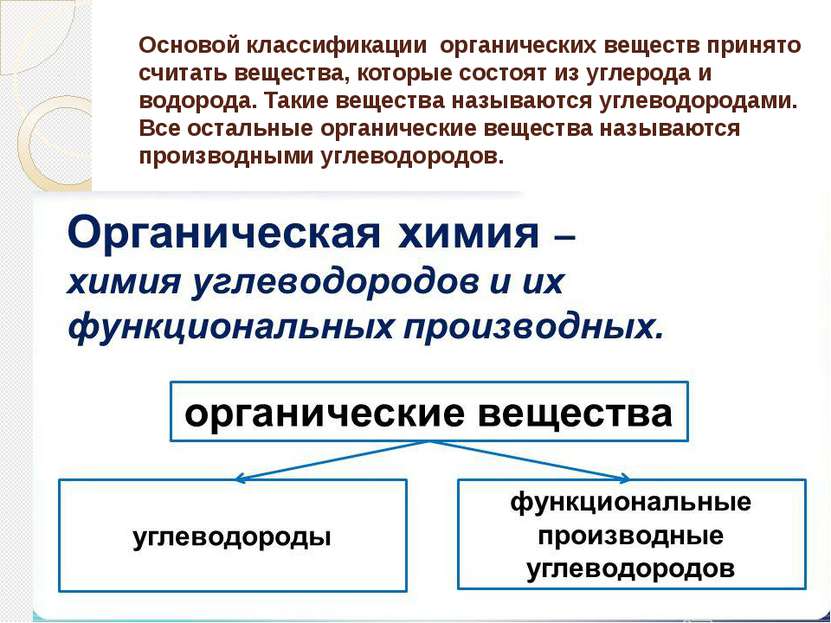
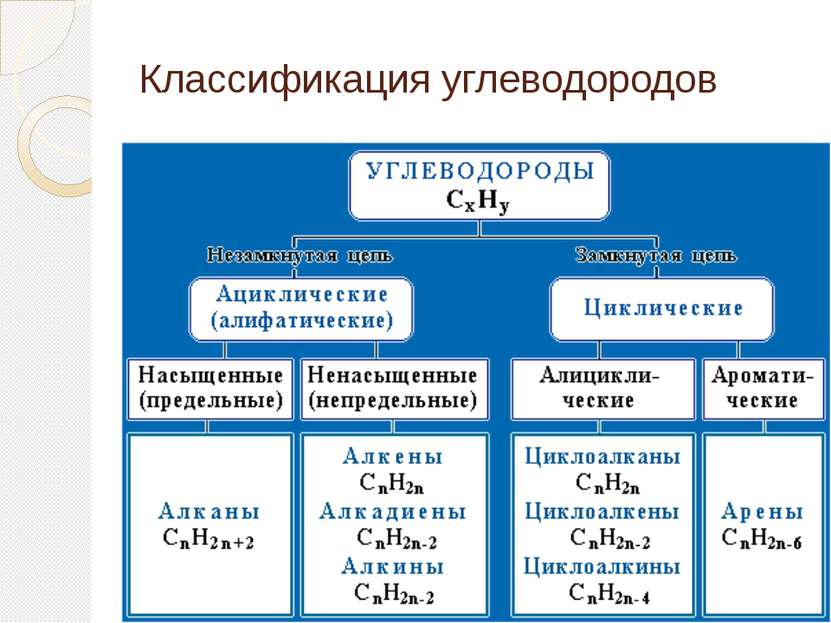
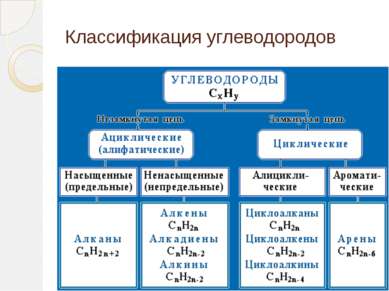
 Основой классификации органических веществ принято считать вещества, которые состоят из углерода и водорода. Такие вещества называются углеводородами. Все остальные органические вещества называются производными углеводородов.
Основой классификации органических веществ принято считать вещества, которые состоят из углерода и водорода. Такие вещества называются углеводородами. Все остальные органические вещества называются производными углеводородов.
Cлайд 6
 Классификация органических соединений Для классификации органических соединений по типам и построения их названий в молекуле органического соединения принято выделять углеродный скелет и функциональные группы.
Классификация органических соединений Для классификации органических соединений по типам и построения их названий в молекуле органического соединения принято выделять углеродный скелет и функциональные группы.
Cлайд 7
 Углеродный скелет Углеродный скелет представляет собой последовательность химически связанных между собой атомов углерода. Функциональные группы образуют все атомы, кроме водорода, или группы атомов, связанные с атомом углерода.
Углеродный скелет Углеродный скелет представляет собой последовательность химически связанных между собой атомов углерода. Функциональные группы образуют все атомы, кроме водорода, или группы атомов, связанные с атомом углерода.
Cлайд 8
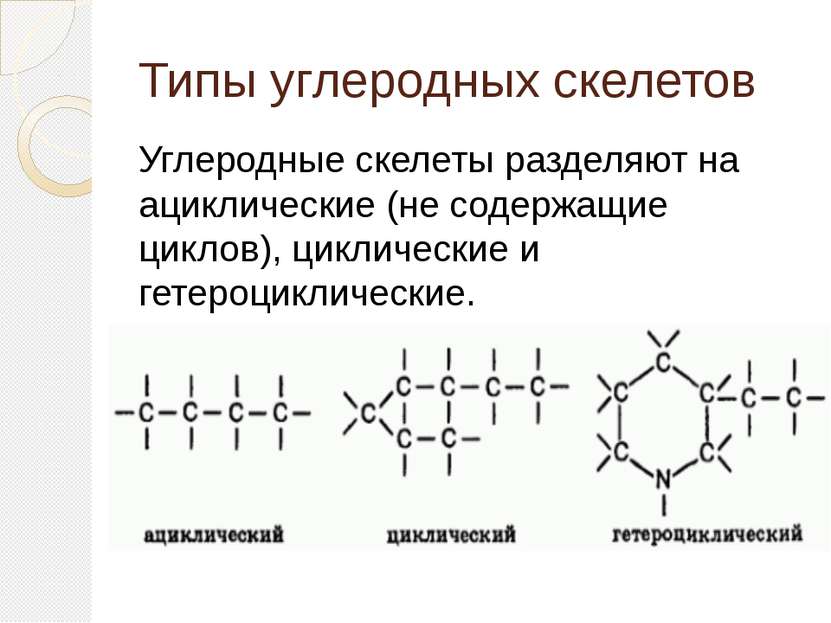
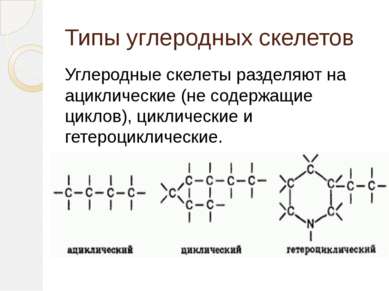 Типы углеродных скелетов Углеродные скелеты разделяют на ациклические (не содержащие циклов), циклические и гетероциклические.
Типы углеродных скелетов Углеродные скелеты разделяют на ациклические (не содержащие циклов), циклические и гетероциклические.
Cлайд 9
 Функциональные группы В большинстве органических соединений, кроме атомов углерода и водорода, содержатся атомы других элементов (не входящие в скелет). Эти атомы или их группировки, во многом определяющие химические и физические свойства органических соединений, называют функциональными группами.
Функциональные группы В большинстве органических соединений, кроме атомов углерода и водорода, содержатся атомы других элементов (не входящие в скелет). Эти атомы или их группировки, во многом определяющие химические и физические свойства органических соединений, называют функциональными группами.
Cлайд 11
 Номенклатура органических соединений В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура — номенклатура IUPAC (ИЮПАК) — International Union of Pure and Applied Chemistry (Международного союза теоретической и прикладной химии).
Номенклатура органических соединений В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура — номенклатура IUPAC (ИЮПАК) — International Union of Pure and Applied Chemistry (Международного союза теоретической и прикладной химии).
Cлайд 12
 Тривиальная (историческая) номенклатура первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие.
Тривиальная (историческая) номенклатура первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие.
Cлайд 13
 Рациональная номенклатура по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении
Рациональная номенклатура по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении
Cлайд 14
 Систематическая номенклатура ИЮПАК (IUPAC — Международный союз теоретической и прикладной химии) международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу.
Систематическая номенклатура ИЮПАК (IUPAC — Международный союз теоретической и прикладной химии) международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу.
Cлайд 15
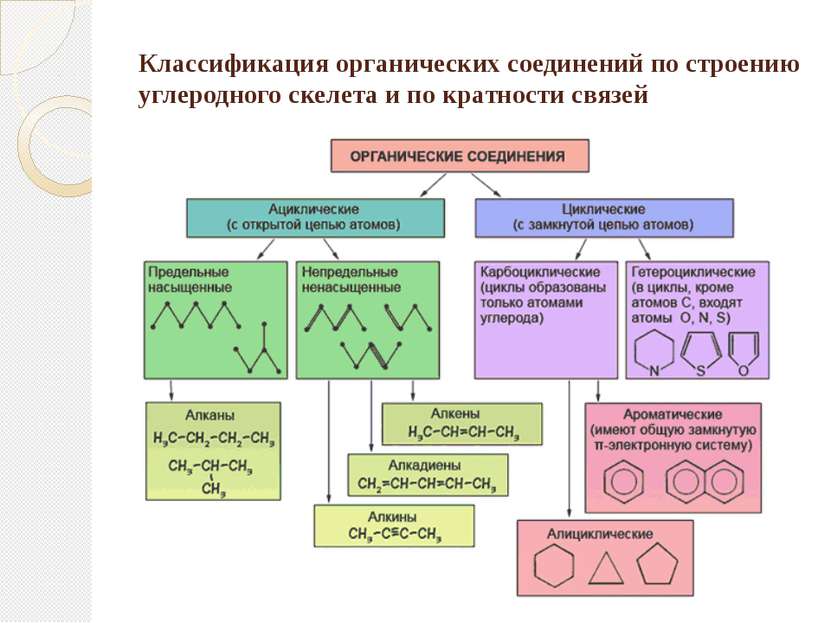
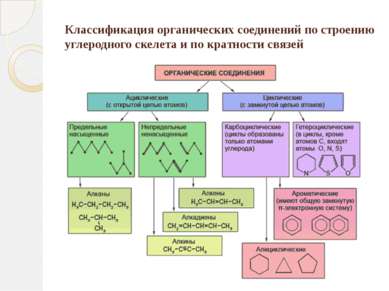 Классификация органических соединений по строению углеродного скелета и по кратности связей
Классификация органических соединений по строению углеродного скелета и по кратности связей
Cлайд 16
 Список основных классов органических веществ Алканы Алкины Алкены Бензолы Нитросоединения Нитрозопроизводные Галогенпроизводные Пероксиды Сульфиды Простые эфиры Имины Амины Тиолы Фураны Тиофены Пирролы Фенолы Пиридины Пиримидины Спирты Кетоны Адьдегиды Нитрилы Амиды Галогенангидриды Сложные эфиры Ангидриды Сульфоновые кислоты Карбоновые кислоты Кремнийорганические соединения Металлорганические соединения
Список основных классов органических веществ Алканы Алкины Алкены Бензолы Нитросоединения Нитрозопроизводные Галогенпроизводные Пероксиды Сульфиды Простые эфиры Имины Амины Тиолы Фураны Тиофены Пирролы Фенолы Пиридины Пиримидины Спирты Кетоны Адьдегиды Нитрилы Амиды Галогенангидриды Сложные эфиры Ангидриды Сульфоновые кислоты Карбоновые кислоты Кремнийорганические соединения Металлорганические соединения
Cлайд 17
 План разбора класса органических веществ 1. Общая формула 2.Строение 3.Гомологический ряд. 4. Изомерия 5. Физические свойства 6. Химические свойства 7. Получение 8. Применение
План разбора класса органических веществ 1. Общая формула 2.Строение 3.Гомологический ряд. 4. Изомерия 5. Физические свойства 6. Химические свойства 7. Получение 8. Применение
Cлайд 18
 Теория химического строения Теория химического строения - учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение (реакционную способность) данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т.д. Основные положения теории химического строения, являющейся фундаментом химии, были развиты русским химиком Бутлеровым А.М. Сам Бутлеров определял понятие химического строения так: "Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которой химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу“/
Теория химического строения Теория химического строения - учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение (реакционную способность) данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы и т.д. Основные положения теории химического строения, являющейся фундаментом химии, были развиты русским химиком Бутлеровым А.М. Сам Бутлеров определял понятие химического строения так: "Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которой химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу“/
Cлайд 19
 Основные положения теории химического строения органических соединений 1. Все атомы, образующие молекулы органических веществ, связаны в определенной последовательности согласно их валентностям. 2. Свойства веществ зависят не только от того, какие атомы и сколько их входит в состав молекул, но и от порядка соединения атомов в молекулах. 3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства. 4. Атомы и группы атомов в молекулах взаимно влияют друг на друга.
Основные положения теории химического строения органических соединений 1. Все атомы, образующие молекулы органических веществ, связаны в определенной последовательности согласно их валентностям. 2. Свойства веществ зависят не только от того, какие атомы и сколько их входит в состав молекул, но и от порядка соединения атомов в молекулах. 3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства. 4. Атомы и группы атомов в молекулах взаимно влияют друг на друга.
Cлайд 21
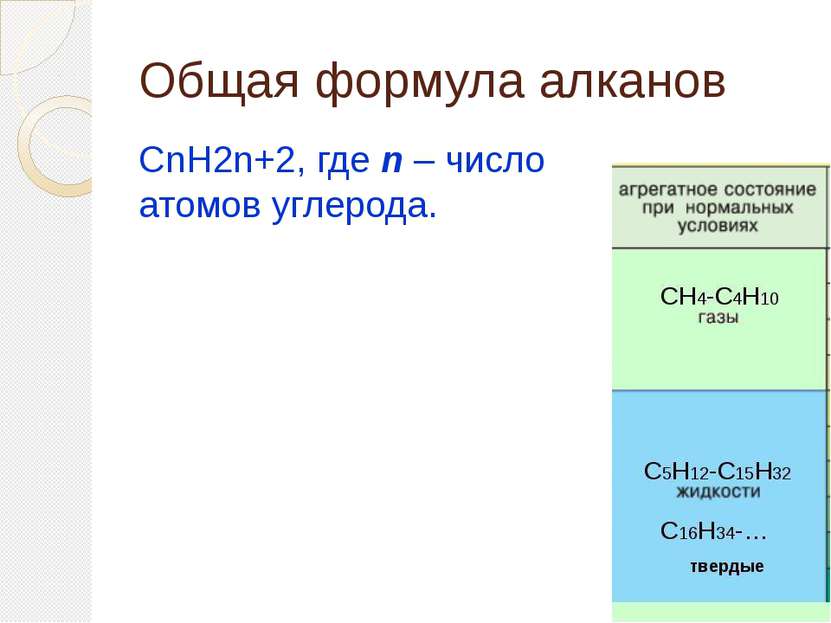
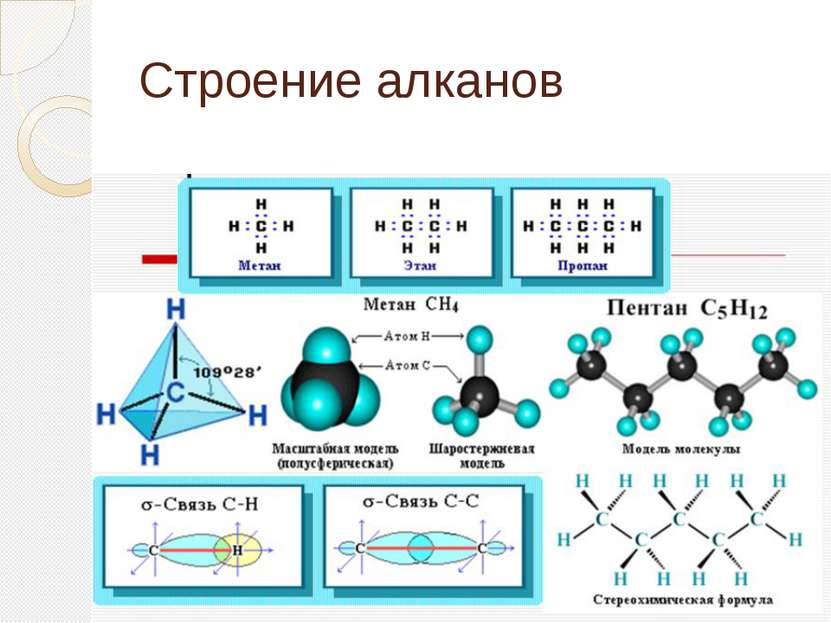
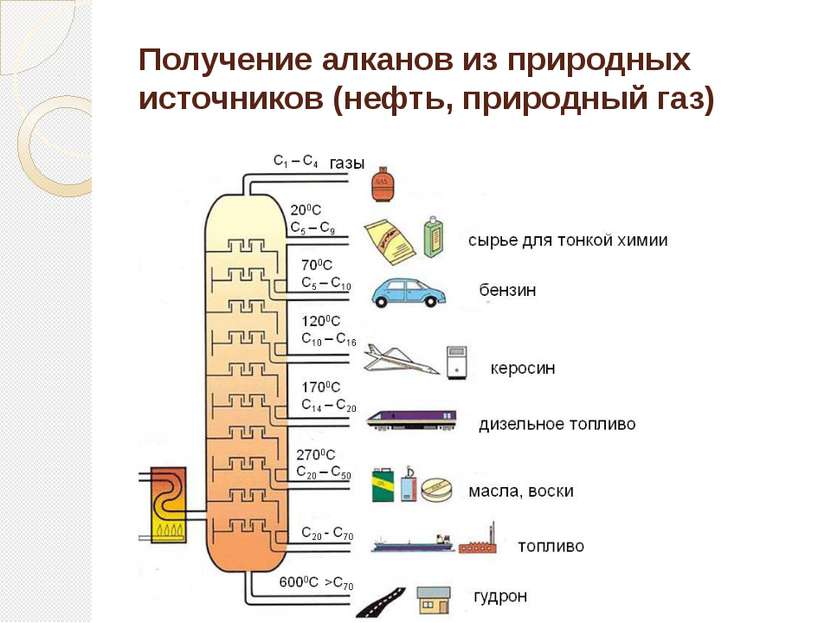
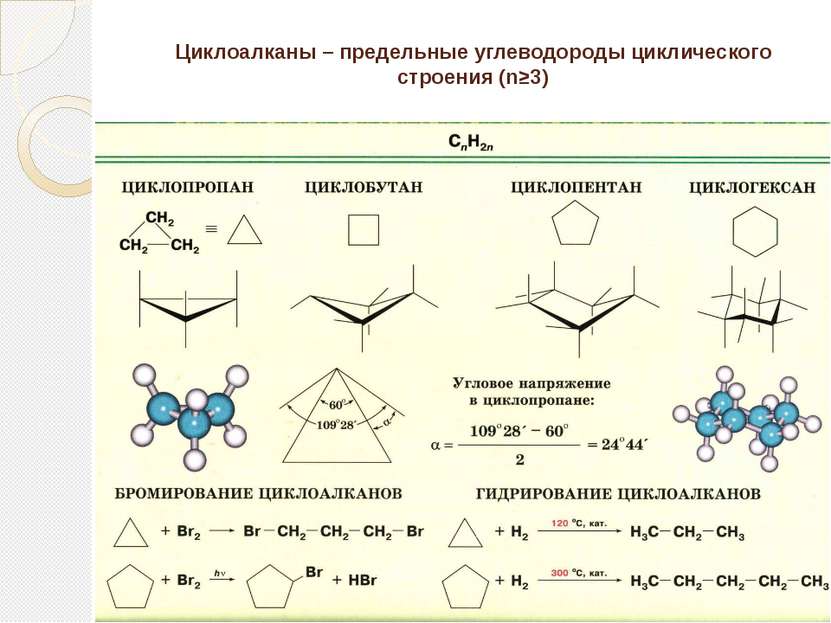
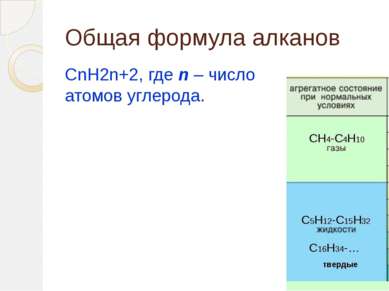
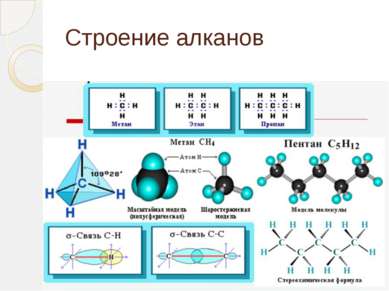
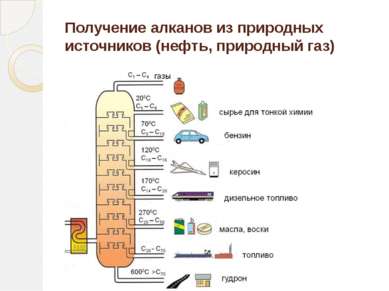
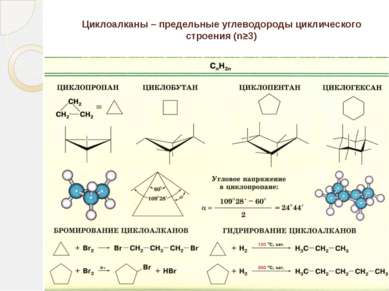
 Определение алканов Алканы (парафины) – алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи. (i) Алканы – название предельных углеводородов по международной номенклатуре. Парафины – исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – малоактивный). Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
Определение алканов Алканы (парафины) – алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи. (i) Алканы – название предельных углеводородов по международной номенклатуре. Парафины – исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – малоактивный). Предельными, или насыщенными, эти углеводороды называют в связи с полным насыщением углеродной цепи атомами водорода.
Cлайд 24
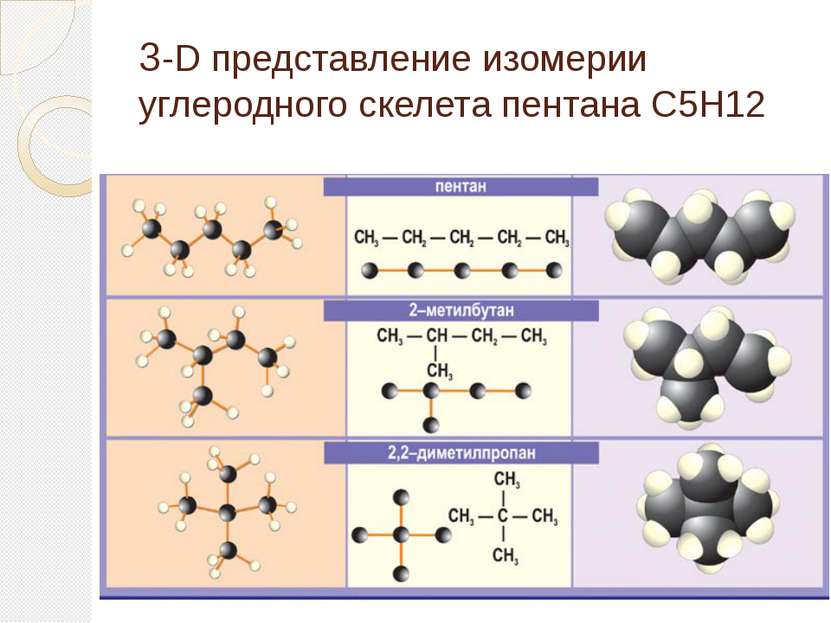
 Определение гомологического ряда Ряд химических соединений одного структурного типа, отличающихся друг от друга на одну или несколько структурных единиц (обычно на группу CH2), называется гомологическим рядом, а каждый из углеводов – членом гомологического ряда или гомологом. Если расположить гомологи в порядке возрастания их относительной молекулярной массы, они образуют гомологический ряд. Группа CH2 называется гомологической разностью или гомологической разницей.
Определение гомологического ряда Ряд химических соединений одного структурного типа, отличающихся друг от друга на одну или несколько структурных единиц (обычно на группу CH2), называется гомологическим рядом, а каждый из углеводов – членом гомологического ряда или гомологом. Если расположить гомологи в порядке возрастания их относительной молекулярной массы, они образуют гомологический ряд. Группа CH2 называется гомологической разностью или гомологической разницей.
Cлайд 25
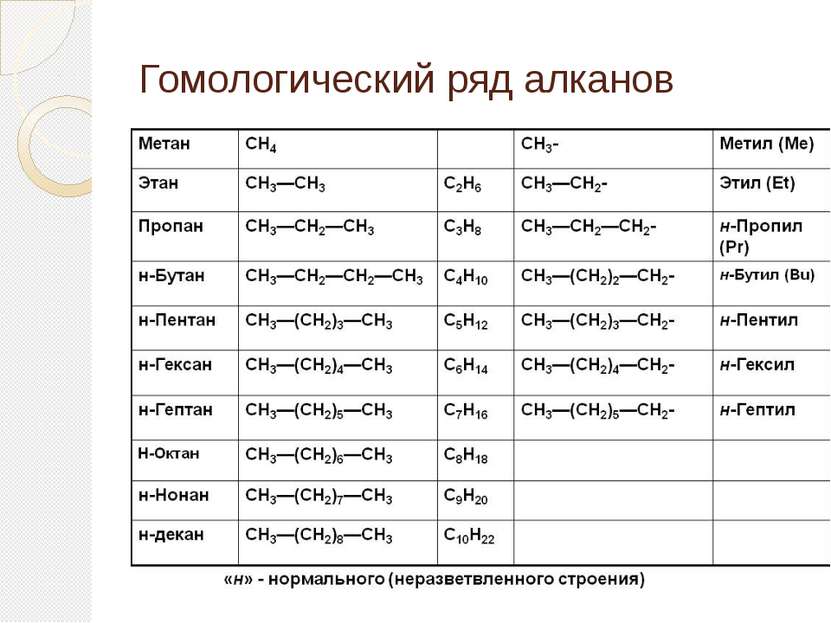
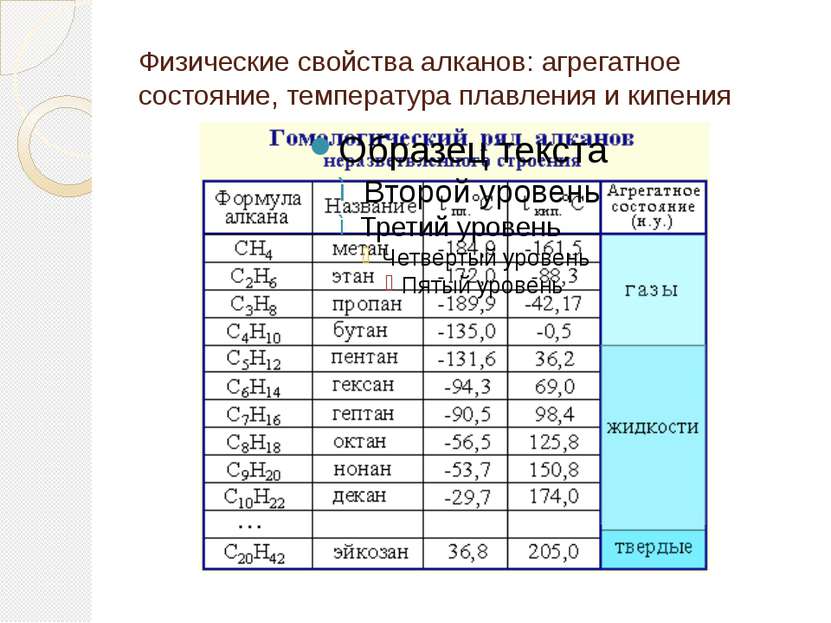
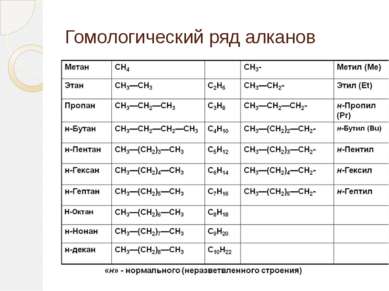
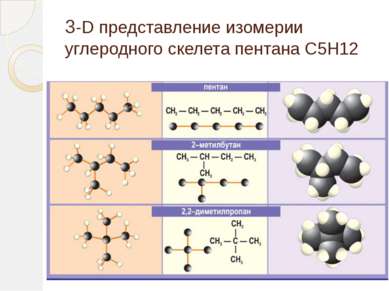
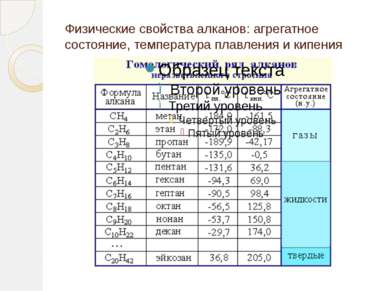
 Гомологический ряд алканов Простейший его представитель – метан СН4. Гомологами метана являются: этан C2H6; пропан C3H8; бутан C4H10; пентан C5H12; гексан C6H14, гептан C7H16, октан – С8Н18, нонан – С9Н20, декан – С10Н22,ундекан – С11Н24, нодекан – С12Н26, тридекан – С13Н28, тетрадекан – С14Н30, пентадекан – С15Н32, эйкозан – С20Н42, пентакозан – С25Н52, триаконтан – С30Н62, тетраконтан – С40Н82, гектан – С100Н202.
Гомологический ряд алканов Простейший его представитель – метан СН4. Гомологами метана являются: этан C2H6; пропан C3H8; бутан C4H10; пентан C5H12; гексан C6H14, гептан C7H16, октан – С8Н18, нонан – С9Н20, декан – С10Н22,ундекан – С11Н24, нодекан – С12Н26, тридекан – С13Н28, тетрадекан – С14Н30, пентадекан – С15Н32, эйкозан – С20Н42, пентакозан – С25Н52, триаконтан – С30Н62, тетраконтан – С40Н82, гектан – С100Н202.
Cлайд 40
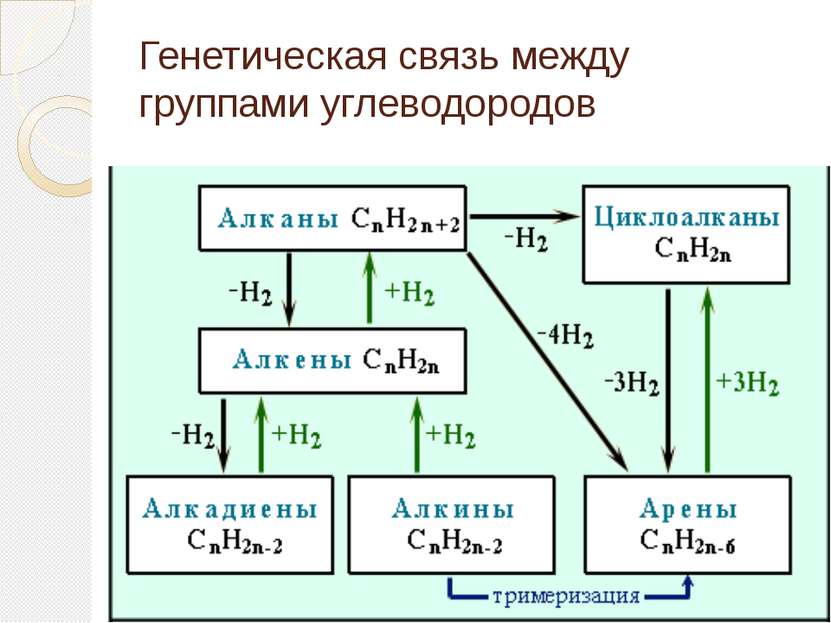
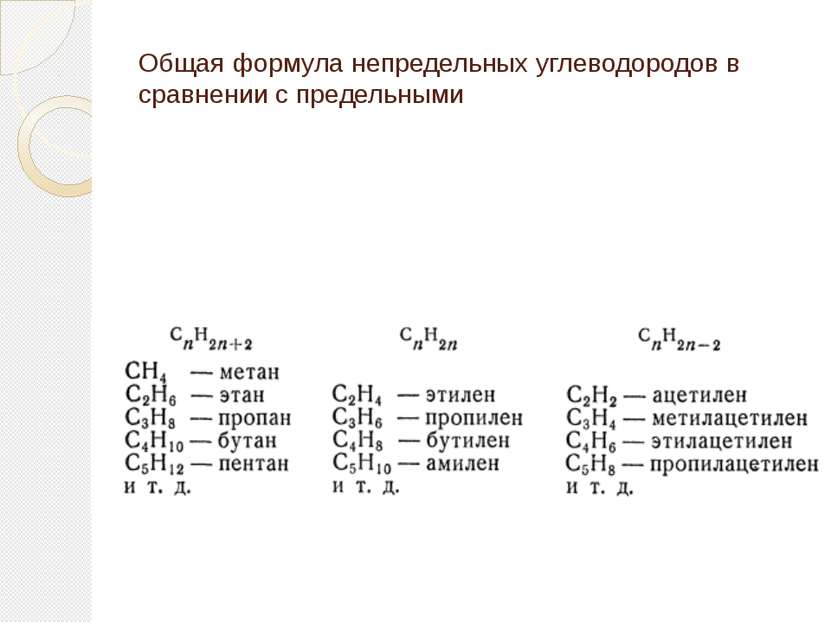
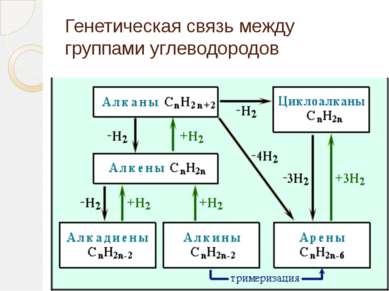
 Непредельные углеводороды Непредельные углеводороды - это углеводороды, содержащие кратные связи в углеродном скелете молекулы. Кратными называются двойные и тройные связи. К непредельным углеводородам относятся алкены, алкины, алкадиены и другие углеводороды с кратными связями в молекуле.
Непредельные углеводороды Непредельные углеводороды - это углеводороды, содержащие кратные связи в углеродном скелете молекулы. Кратными называются двойные и тройные связи. К непредельным углеводородам относятся алкены, алкины, алкадиены и другие углеводороды с кратными связями в молекуле.
Cлайд 42
 Определение алкенов Углеводородами ряда этилена, или этиленовыми углеводородами (олефинами или алкенами) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной двойной связи между углеродными атомами, т.е. – группировки >C=C
Определение алкенов Углеводородами ряда этилена, или этиленовыми углеводородами (олефинами или алкенами) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной двойной связи между углеродными атомами, т.е. – группировки >C=C
Cлайд 43
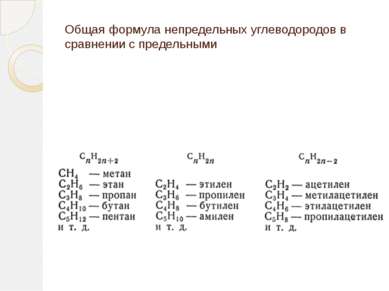
 Строение непредельных углеводородов Алкены CnH2n -одна двойная (- и -) связь Алкины CnH2n-2 - одна тройная (- и две -) связи Алкадиены CnH2n-2
Строение непредельных углеводородов Алкены CnH2n -одна двойная (- и -) связь Алкины CnH2n-2 - одна тройная (- и две -) связи Алкадиены CnH2n-2
Cлайд 44
 Изомерия непредельных углеводородов Структурная: изомерия углеродного скелета, изомерия положения заместителя или кратной связи. Пространственная (геометрическая или цис-транс; для алкенов и алкодиенов). Межклассовая (например: алкены и циклоалканы или алкины и алкадиены).
Изомерия непредельных углеводородов Структурная: изомерия углеродного скелета, изомерия положения заместителя или кратной связи. Пространственная (геометрическая или цис-транс; для алкенов и алкодиенов). Межклассовая (например: алкены и циклоалканы или алкины и алкадиены).
Cлайд 45
 Физические свойства алкенов С2 – С4 (газы) С5 – С18 (жидкости) С19 … – (твёрдые) Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.) Легче воды С увеличением Mr температуры плавления и кипения увеличиваются ЭТИЛЕН - в природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом.
Физические свойства алкенов С2 – С4 (газы) С5 – С18 (жидкости) С19 … – (твёрдые) Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.) Легче воды С увеличением Mr температуры плавления и кипения увеличиваются ЭТИЛЕН - в природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом.
Cлайд 46
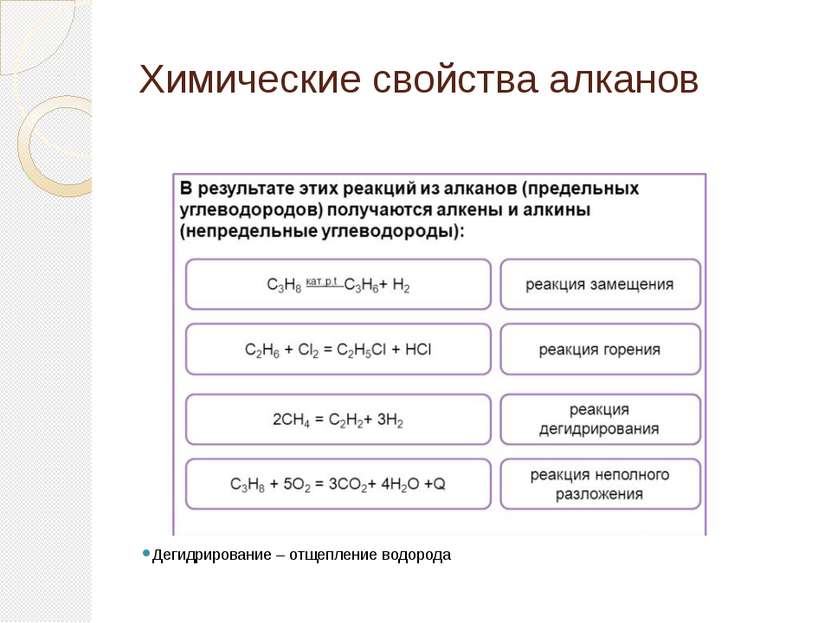
 Химические свойства алкенов 1.Присоединение галогенов CH2=CH-CH3+Cl2CH2Cl-CHCl-CH3 2.Присоединение водорода CH2=CH-CH3+Н2CH3-CH2-CH3 3.Присоединение галогенводородов CH2=CH-CH3+НClCH3-CHCl-CH3 Присоединение протекает по правилу Марковникова( водород присоединяется к наиболее гидрогенизированному атому углерода) 4.Присоединение воды 5.Окисление перманганатом калия в нейтральной или слабощелочной среде( реакция Вагнера) 6.Полимеризация алкенов
Химические свойства алкенов 1.Присоединение галогенов CH2=CH-CH3+Cl2CH2Cl-CHCl-CH3 2.Присоединение водорода CH2=CH-CH3+Н2CH3-CH2-CH3 3.Присоединение галогенводородов CH2=CH-CH3+НClCH3-CHCl-CH3 Присоединение протекает по правилу Марковникова( водород присоединяется к наиболее гидрогенизированному атому углерода) 4.Присоединение воды 5.Окисление перманганатом калия в нейтральной или слабощелочной среде( реакция Вагнера) 6.Полимеризация алкенов
Cлайд 47
 Как и предельные углеводороды, алкены горят на воздухе: C2H4 + 3O2 t→ 2CO2 + 2H2O + Q (пламя ярко светящее) Реакции присоединения алкенов (отдельно)
Как и предельные углеводороды, алкены горят на воздухе: C2H4 + 3O2 t→ 2CO2 + 2H2O + Q (пламя ярко светящее) Реакции присоединения алкенов (отдельно)
Cлайд 48
 Получение алкенов 1. Действие спиртовых растворов едких щелочей на галогенпроизводные H3C-CH2-CH2BrH3C-CH=CH2+NaBr+H2O 2.Действие на спирты водоотнимающих средств 3.Действие Zn или Mg на дигалогенпроизводные с двумя атомами галогена у соседних атомов 4.Гидрирование ацетиленовых углеводородов над катализаторами с пониженной активностью( Fe)
Получение алкенов 1. Действие спиртовых растворов едких щелочей на галогенпроизводные H3C-CH2-CH2BrH3C-CH=CH2+NaBr+H2O 2.Действие на спирты водоотнимающих средств 3.Действие Zn или Mg на дигалогенпроизводные с двумя атомами галогена у соседних атомов 4.Гидрирование ацетиленовых углеводородов над катализаторами с пониженной активностью( Fe)
Cлайд 49
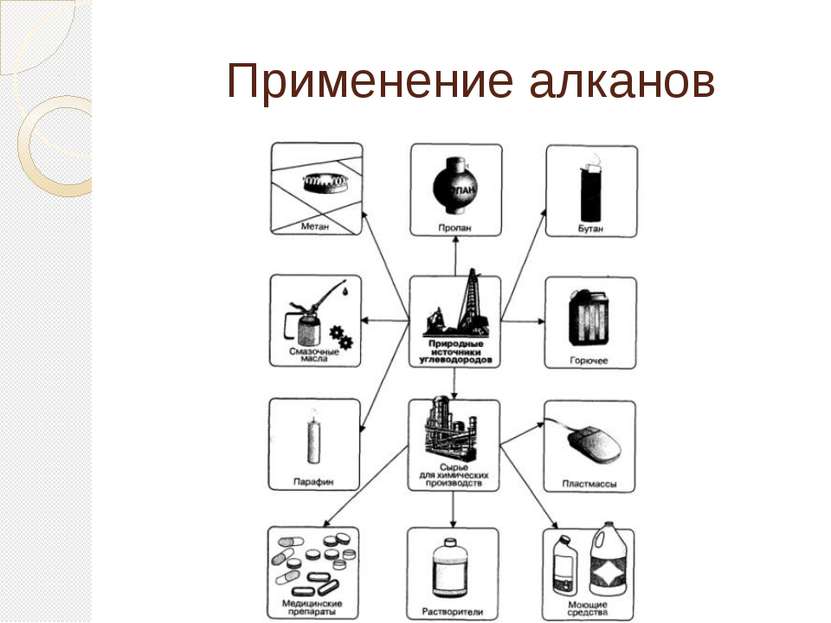
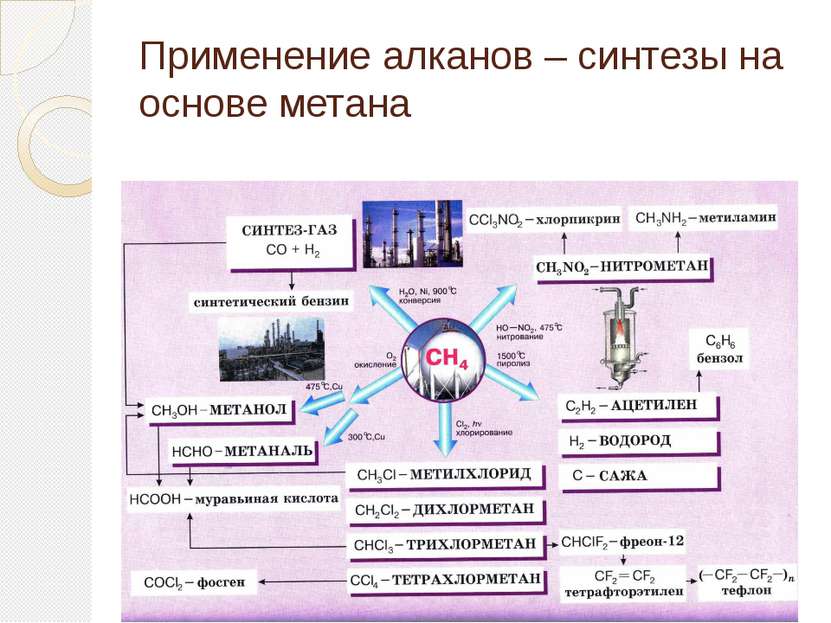
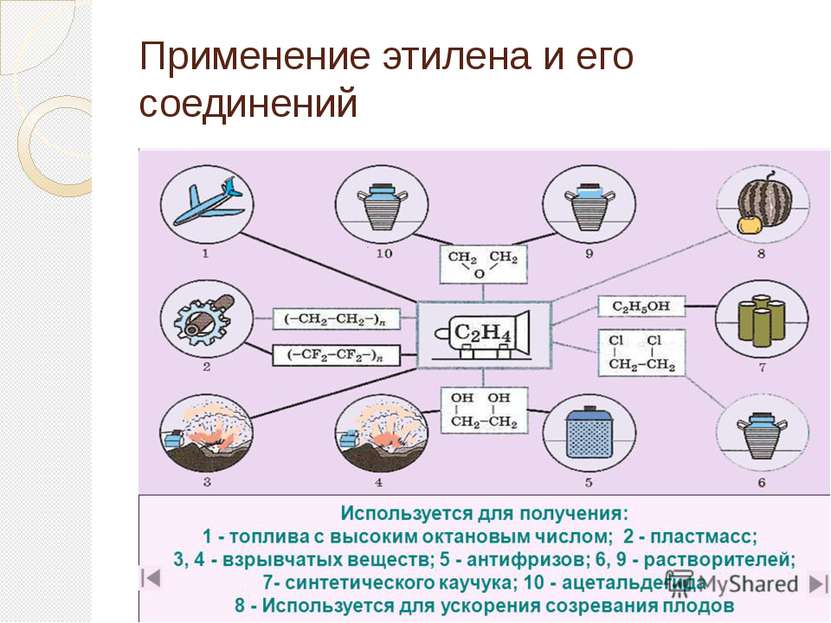
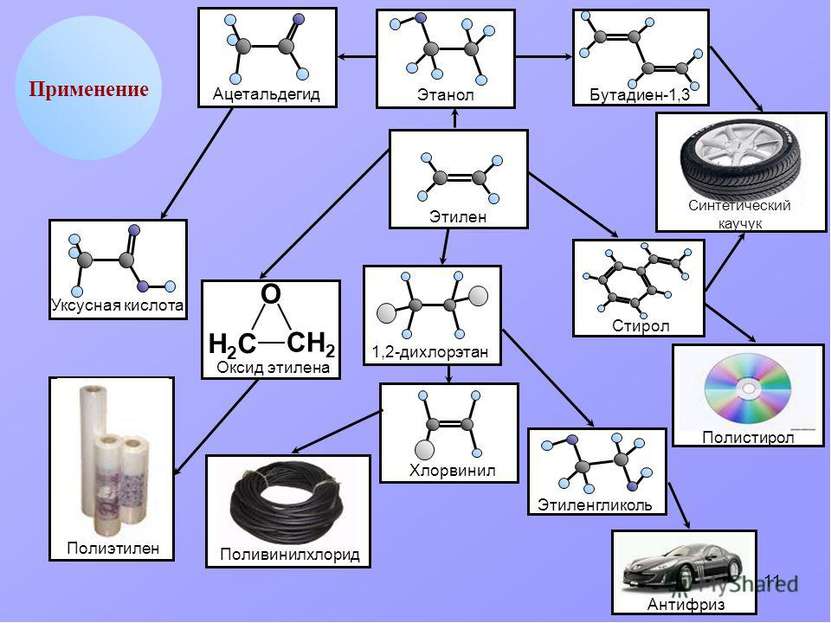
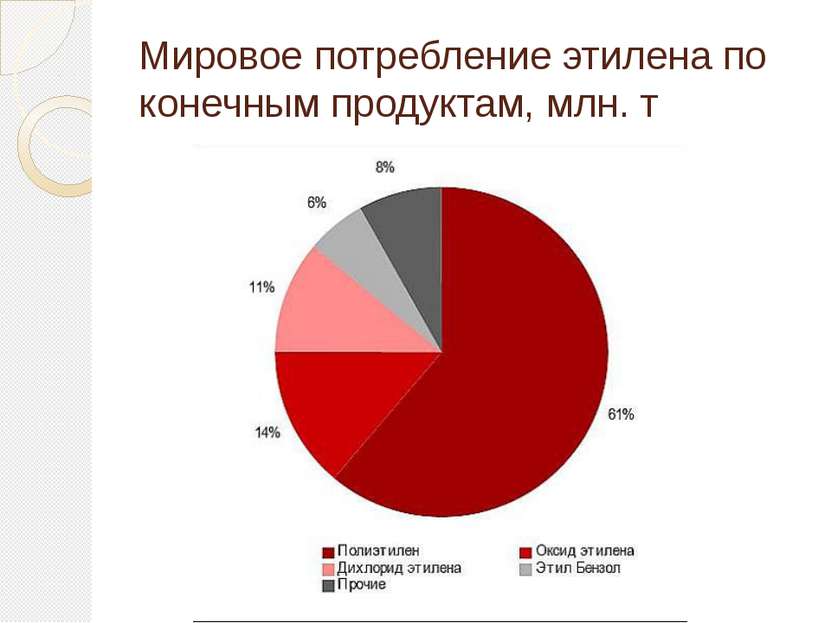
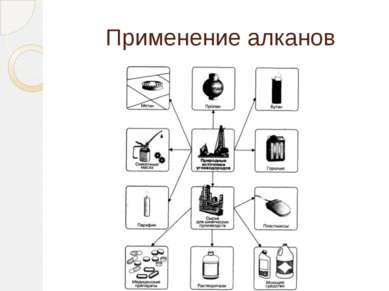
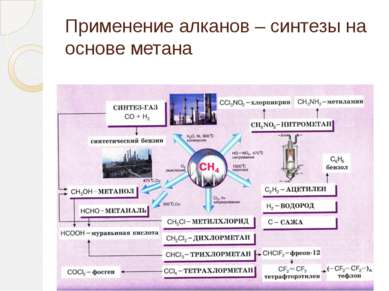
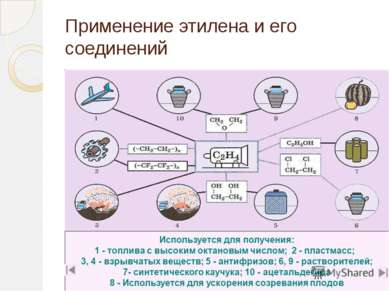
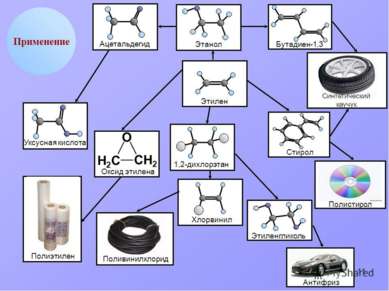
 Применение этилена Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена
Применение этилена Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена
Cлайд 50
 Применение этилена (2 часть) Этилен - исходное соединение для получения полиэтилена высокого и низкого давления и олигомеров этилена, являющихся основой ряда синтетических смазочных масел.
Применение этилена (2 часть) Этилен - исходное соединение для получения полиэтилена высокого и низкого давления и олигомеров этилена, являющихся основой ряда синтетических смазочных масел.
Cлайд 51
 Применение этилена (3 часть) Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Применение этилена (3 часть) Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Cлайд 52
 Применение этилена (4 часть) Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
Применение этилена (4 часть) Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
Cлайд 57
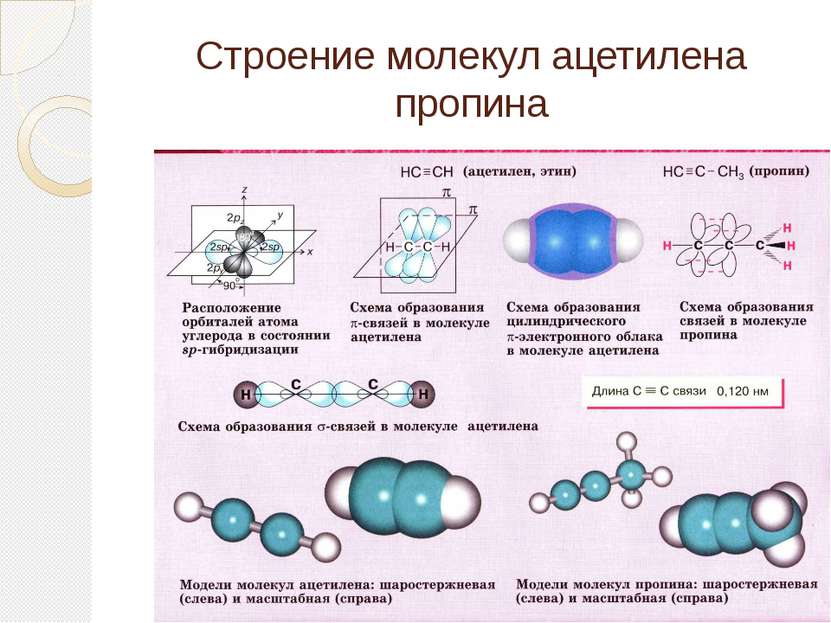
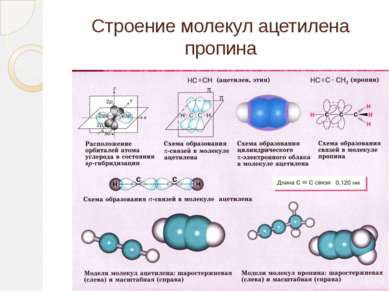
 Определение ацетиленовых углеводородов (алкинов) Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен H-C≡C-H. Алкины – это непредельные углеводороды с одной тройной углеродной связью в цепи и общей формулой СnH2n-2
Определение ацетиленовых углеводородов (алкинов) Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен H-C≡C-H. Алкины – это непредельные углеводороды с одной тройной углеродной связью в цепи и общей формулой СnH2n-2
Cлайд 58
 Ацетилен С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Ацетилен С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Cлайд 61
 Физические свойства ацетилена С2Н2 – газ без цвета и почти без запаха, технический ацетилен обладает неприятным запахом, легче воздуха, мало растворим в воде Свойства гомологов изменяются аналогично алкенам. Получение в лаборатории: из карбида кальция гидролизом (взаимодействие с водой) CaC2 + 2H2O → Ca(OH)2 + H-C≡C-H Получение в промышленности: термическим разложением метана (пиролиз) 2CH4 1500˚С→ HC≡CH + 3H2
Физические свойства ацетилена С2Н2 – газ без цвета и почти без запаха, технический ацетилен обладает неприятным запахом, легче воздуха, мало растворим в воде Свойства гомологов изменяются аналогично алкенам. Получение в лаборатории: из карбида кальция гидролизом (взаимодействие с водой) CaC2 + 2H2O → Ca(OH)2 + H-C≡C-H Получение в промышленности: термическим разложением метана (пиролиз) 2CH4 1500˚С→ HC≡CH + 3H2
Cлайд 62
 Химические свойства алкинов 1.Присоединение галогенов 2.Присоединение водорода 3.Присоединение галогенводородов 4.Присоединение воды 5.Присоединение спиртов 6.Присоединение кислот 7.Присоединение синильной кислоты 8.Реакция димеризации
Химические свойства алкинов 1.Присоединение галогенов 2.Присоединение водорода 3.Присоединение галогенводородов 4.Присоединение воды 5.Присоединение спиртов 6.Присоединение кислот 7.Присоединение синильной кислоты 8.Реакция димеризации
Cлайд 63
 Свойства гомологов Свойства гомологов изменяются аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами.
Свойства гомологов Свойства гомологов изменяются аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами.
Cлайд 65
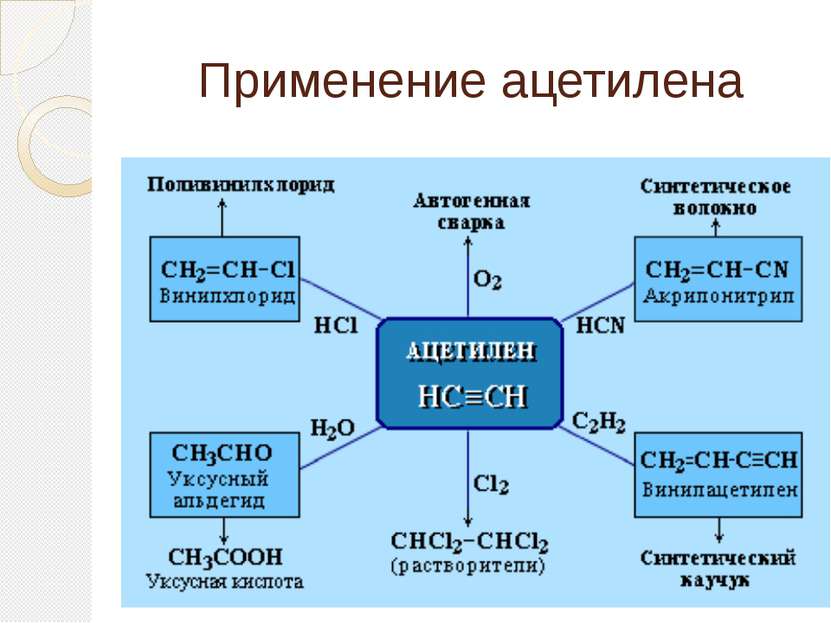
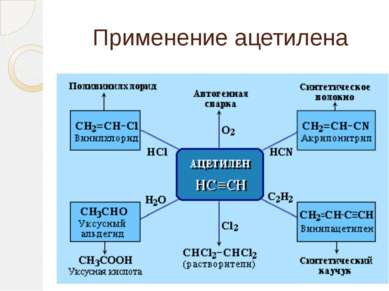
 Применение ацетилена Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена). В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники (источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение.
Применение ацетилена Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена). В конце 19-го — начале 20-го века широкой популярностью пользовались многочисленные ацетиленовые светильники (источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение.
Cлайд 68
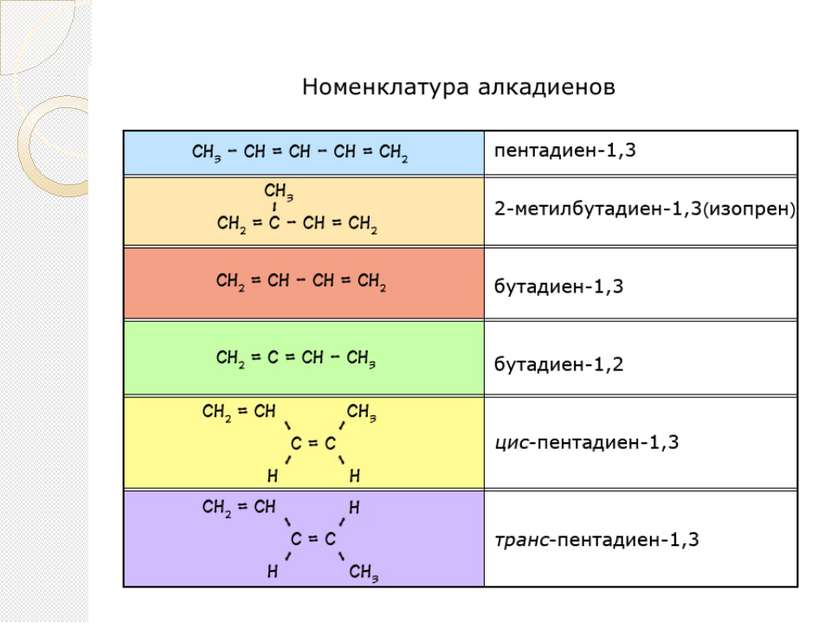
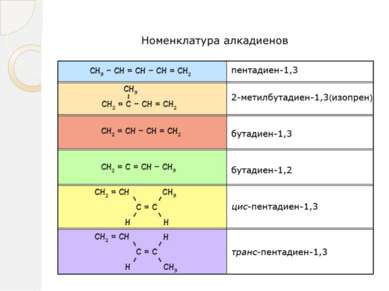
 ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ) Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод - углеродные связи. Общая формула алкадиенов CnH2n-2.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ) Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод - углеродные связи. Общая формула алкадиенов CnH2n-2.
Cлайд 70
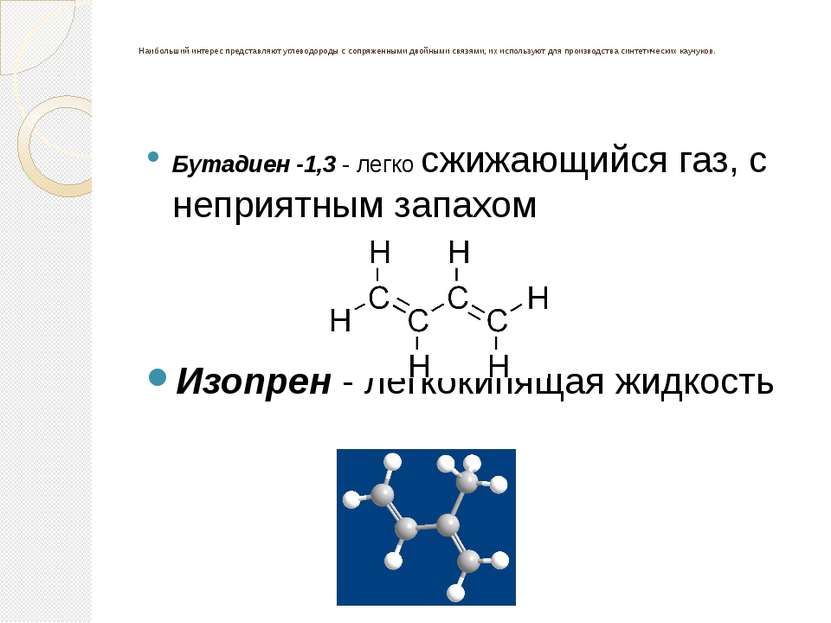
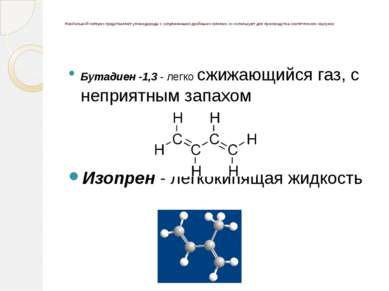 Наибольший интерес представляют углеводороды с сопряженными двойными связями, их используют для производства синтетических каучуков. Бутадиен -1,3 - легко сжижающийся газ, с неприятным запахом Изопрен - легкокипящая жидкость
Наибольший интерес представляют углеводороды с сопряженными двойными связями, их используют для производства синтетических каучуков. Бутадиен -1,3 - легко сжижающийся газ, с неприятным запахом Изопрен - легкокипящая жидкость
Cлайд 72
 Физические свойства алкадиенов Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется в эфире, бензоле, не растворяется в воде. 2- Метилбутадиен -1,3 – летучая жидкость, t°пл.= -146°C, t°кип.= 34,1°C; растворяется в большинстве углеводородных растворителей, эфире, спирте, не растворяется в воде.
Физические свойства алкадиенов Бутадиен -1,3 – легко сжижающийся газ с неприятным запахом, t°пл.= -108,9°C, t°кип.= -4,5°C; растворяется в эфире, бензоле, не растворяется в воде. 2- Метилбутадиен -1,3 – летучая жидкость, t°пл.= -146°C, t°кип.= 34,1°C; растворяется в большинстве углеводородных растворителей, эфире, спирте, не растворяется в воде.
Cлайд 74
 Способы получения бутадиена Известно много способов получения бутадиена, но промышленное значение имеют лишь некоторые из них. По виду исходного сырья получение бутадиена можно разделить на три группы: из н-бутана и н-бутиленов; из этилового спирта; из ацетилена.
Способы получения бутадиена Известно много способов получения бутадиена, но промышленное значение имеют лишь некоторые из них. По виду исходного сырья получение бутадиена можно разделить на три группы: из н-бутана и н-бутиленов; из этилового спирта; из ацетилена.
Cлайд 75
 Первый способ получения бутадиена Способ получения бутадиена, являющегося исходным веществом ( мономером) для изготовления синтетического каучука, разработан в 1928 г. академиком С.В.Лебедевым. Особенностью способа получения бутадиена из этилового спирта, разработанного С. В. Лебедевым, является то, что контактное превращение этилового спирта в бутадиен идет в одну стадию, на катализаторе, одновременно способствующем двум реакциям - дегидрирования и дегидратации. Промышленное производство натрийбутадиенового каучука впервые в мире было осуществлено в 1932 г. в СССР.
Первый способ получения бутадиена Способ получения бутадиена, являющегося исходным веществом ( мономером) для изготовления синтетического каучука, разработан в 1928 г. академиком С.В.Лебедевым. Особенностью способа получения бутадиена из этилового спирта, разработанного С. В. Лебедевым, является то, что контактное превращение этилового спирта в бутадиен идет в одну стадию, на катализаторе, одновременно способствующем двум реакциям - дегидрирования и дегидратации. Промышленное производство натрийбутадиенового каучука впервые в мире было осуществлено в 1932 г. в СССР.
Cлайд 76
 Получение бутадиена из этилового спирта Этот способ получения бутадиена был осуществлен в СССР в промышленном масштабе. Полимеры и сополимеры бутадиена представляют собой синтетические каучуки высокого качества.
Получение бутадиена из этилового спирта Этот способ получения бутадиена был осуществлен в СССР в промышленном масштабе. Полимеры и сополимеры бутадиена представляют собой синтетические каучуки высокого качества.
Cлайд 77
 Применение каучуков Наиболее массовое применение каучуков — это производство резин для автомобильных, авиационных и велосипедных шин. Из каучуков изготавливаются специальные резины огромного разнообразия уплотнений для целей тепло- звуко- воздухо- гидроизоляции разъёмных элементов зданий, в санитарной и вентиляционной технике, в гидравлической, пневматической и вакуумной технике.
Применение каучуков Наиболее массовое применение каучуков — это производство резин для автомобильных, авиационных и велосипедных шин. Из каучуков изготавливаются специальные резины огромного разнообразия уплотнений для целей тепло- звуко- воздухо- гидроизоляции разъёмных элементов зданий, в санитарной и вентиляционной технике, в гидравлической, пневматической и вакуумной технике.