X
Код презентации скопируйте его
Кислоты, основания, соли в свете ТЭД
Скачать эту презентациюПрезентация на тему Кислоты, основания, соли в свете ТЭД
Скачать эту презентациюCлайд 1
 Кислоты, основания, соли в свете ТЭД подготовила: Мартынова Е.Ю. Повторительно-обобщающий урок по теме:
Кислоты, основания, соли в свете ТЭД подготовила: Мартынова Е.Ю. Повторительно-обобщающий урок по теме:
Cлайд 2
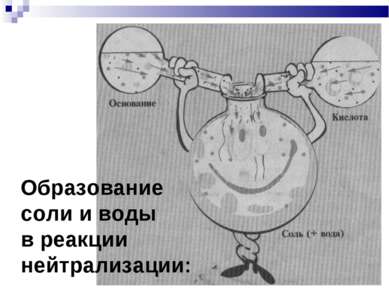
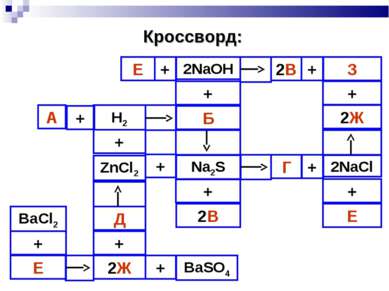
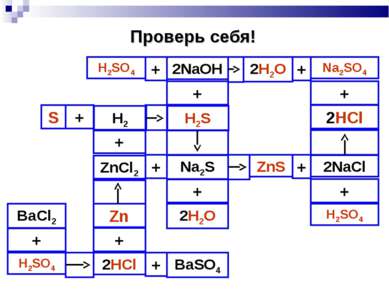
 План урока: Кислоты в свете Т.Э.Д. Основание в свете Т.Э.Д. Реакция нейтрализации. Соли в свете Т.Э.Д. Генетическая связь между классами неорганических соединений
План урока: Кислоты в свете Т.Э.Д. Основание в свете Т.Э.Д. Реакция нейтрализации. Соли в свете Т.Э.Д. Генетическая связь между классами неорганических соединений
Cлайд 3
 Кислоты – электролиты, которые при …………………… в водном растворе образуют .....……………. водорода и анионы …………….......остатка .
Кислоты – электролиты, которые при …………………… в водном растворе образуют .....……………. водорода и анионы …………….......остатка .
Cлайд 4
 Н Cl Н2 Н SO4 H2 NO3 H H2 CO3 H2 S H3 H PO4 H2 Br H SO3 H SiO3 H4 I H H Составьте формулы 10 различных кислот, комбинируя приведённые ниже их составные части:
Н Cl Н2 Н SO4 H2 NO3 H H2 CO3 H2 S H3 H PO4 H2 Br H SO3 H SiO3 H4 I H H Составьте формулы 10 различных кислот, комбинируя приведённые ниже их составные части:
Cлайд 5
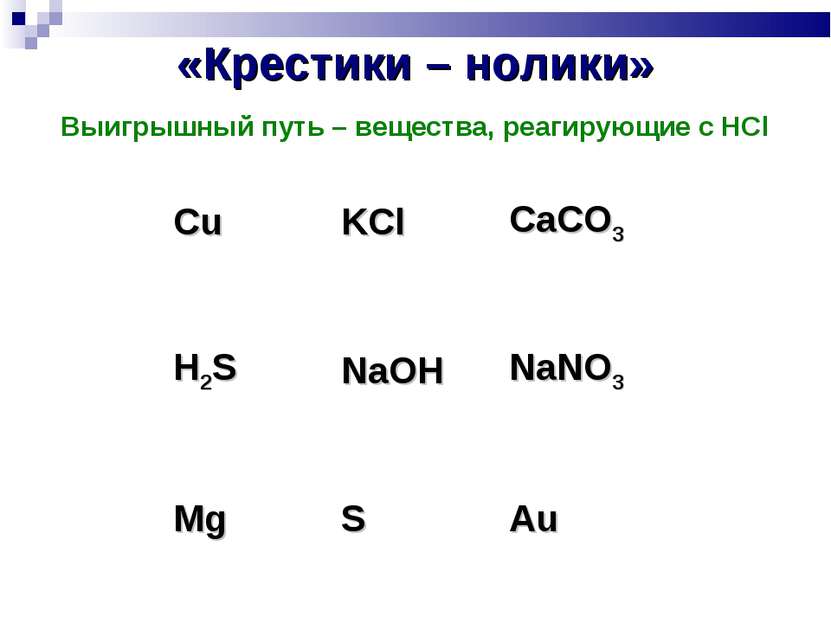
 «Крестики – нолики» Выигрышный путь – вещества, реагирующие с HCl Cu KCl CaCO3 H2S NaOH NaNO3 Mg S Au
«Крестики – нолики» Выигрышный путь – вещества, реагирующие с HCl Cu KCl CaCO3 H2S NaOH NaNO3 Mg S Au
Cлайд 6
 Основания – ………………, которые при диссоциации в ……………. растворе образуют катионы …………….. и ……………… гидроксогрупп.
Основания – ………………, которые при диссоциации в ……………. растворе образуют катионы …………….. и ……………… гидроксогрупп.
Cлайд 7
 «Крестики – нолики» Выигрышный путь – вещества, реагирующие с KOH Mg(OH)2 KCl BaCO3 Li NaOH CaO Al2O3 H2SO4 MgCl2
«Крестики – нолики» Выигрышный путь – вещества, реагирующие с KOH Mg(OH)2 KCl BaCO3 Li NaOH CaO Al2O3 H2SO4 MgCl2
Cлайд 9
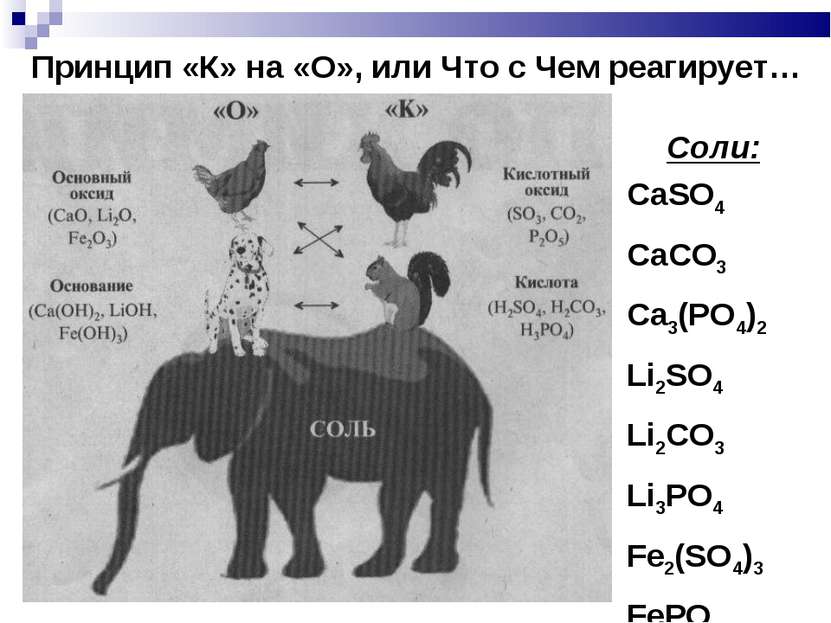
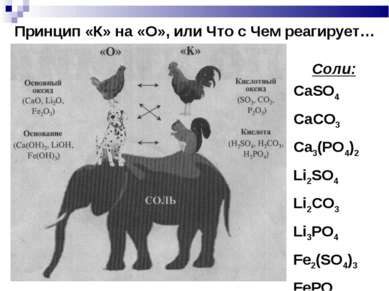 Принцип «К» на «О», или Что с Чем реагирует… Соли: CaSO4 CaCO3 Ca3(PO4)2 Li2SO4 Li2CO3 Li3PO4 Fe2(SO4)3 FePO4
Принцип «К» на «О», или Что с Чем реагирует… Соли: CaSO4 CaCO3 Ca3(PO4)2 Li2SO4 Li2CO3 Li3PO4 Fe2(SO4)3 FePO4
Cлайд 10
 Соли – …………………, которые при диссоциации в водном ………….... образуют ………….. металла(или аммония) и ……….. кислотного ……………...
Соли – …………………, которые при диссоциации в водном ………….... образуют ………….. металла(или аммония) и ……….. кислотного ……………...
Cлайд 11
 «Крестики – нолики» Выигрышный путь – вещества, реагирующие с CuSO4 Al NaNO3 KCl CaO NaOH Hg HCl Zn(NO3)2 BaCl2
«Крестики – нолики» Выигрышный путь – вещества, реагирующие с CuSO4 Al NaNO3 KCl CaO NaOH Hg HCl Zn(NO3)2 BaCl2